МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РЕСПУБЛИКИ БАШКОРТОСТАН
АКАДЕМИЯ НАУК РЕСПУБЛИКИ БАШКОРТОСТАН
ОТДЕЛЕНИЕ ХИМИКО-ТЕХНОЛОГИЧЕСКИХ НАУК
институт органической химии УНЦ РАН
Институт нефтехимии и КАтализа РАН
БАШКИРСКОЕ РЕСПУБЛИКАНСКОЕ ОТДЕЛЕНИЕ
РХО ИМ. Д. И. МЕНДЕЛЕЕВА
башкирский государственный университет
Уфимский Государственный нефтяной
технический университет
ИННОВАЦИОННЫЕ ТЕХНОЛОГИИ
в области химии и биотехнологии
Материалы Всероссийской научно-технической
конференции
г. Уфа, 22-23 ноября 2012 г.
Уфа
Изд-во УГНТУ
2012
УДК 378.147:54+547+577.1+60
ББК 28.072+24.2+74.58р+30.16
И73
Редакционная коллегия:
- д. т.н., проф., проректор по НИР УГНТУ
Ю. Р. Абрахимов – д. х.н., проф. (ИОХ УНЦ РАН)
А. Ф. Ахметов – д. т.н., проф. (УГНТУ)
Ф.З. Галин - д. х.н., проф. (БашГУ)
- член-корр. АН РБ, д. х.н., проф. (УГНТУ)
У. Б. Имашев - акад. АН РБ, д. х.н., проф. (УГНТУ)
М. Н. Рахимов – д. т.н., проф. (УГНТУ)
– д. х.н., проф. (БашГУ)
Р. И. Хуснутдинов – д. х.н., проф. (ИНК УНЦ РАН)
М. С. Юнусов - акад. РАН, д. х.н., проф. (ИОХ УНЦ РАН)
Г. Г. Ягафарова - д. т.н., проф. (УГНТУ)
Инновационные технологии в области химии и биотехнологии: Материалы Всероссийской научно-технической конференции / Уфа: Издательство Уфимского государственного нефтяного технического университета, 2012 - 332 с.
(Материалы помещены в сборник без редакторской правки)
Всероссийская научно-техническая конференция «Инновационные технологии в области химии и биотехнологии» проводится в рамках реализации «Программы развития и совершенствования инновационной инфраструктуры ФБГОУ ВПО УГНТУ» (Шифр программы 2010-219-001.052) в целях популяризации современных достижений в области био - и органической химии, биотехнологии, нефтехимии, экологии, а также развития интеграции высшей школы, науки и производства.
В сборнике приведены материалы, отражающие результаты научно-исследовательских работ инновационных проектов, выполняемых в высших учебных заведениях, НИИ, институтах РАН, проектных организациях и предприятиях Российской Федерации
ISBN 978-5-7831-1015-3 ©Уфимский государственный нефтяной технический университет, 2012
©Коллектив авторов, 2012
СЕКЦИЯ
«Био- и органическая химия, биотехнология»
УДК 547.517+547.78
, А. Пешич, ,
Структурные аналоги элеутеробина на основе производных 8-оксабицикло[3.2.1]октана
Московский Государственный Университет им. , г. Москва
E-mail: *****@***ru
Элеутеробин (Eleutherobin) – природный терпен, проявляющий на порядок более высокую противоопухолевую активность, чем имеющий аналогичное действие препарат таксол (паклитаксел). Основным фармакофором элеутеробина считают остаток N-метилурокановой [3-(1-метил-имидазол-4-ил)-проп-2-еновая] кислоты [1, 2].
Для поиска синтетически более доступных аналогов, в данной работе нами был проведен молекулярный докинг различных сложных эфиров
N-метилурокановой кислоты с каркасными диолами – производными
8-оксабицикло[3.2.1]октана в сайт связывания паклитаксела на белке тубулине (программный пакет SYBYL). В результате в качестве спейсеров были выбраны диастереомерно-чистые диолы 1 и 5, легко доступные из продукта реакции Дильса-Альдера фурана и тетрахлорциклопропена [3, 4].
Симметричный диол 1 был трансформирован в моноэфиры бензойных кислот 2 и 3 по реакциям с соответствующими хлорангидридами. Также была проведена модификация двойной связи. Для этого вначале был получен диацетат, который в результате син-гидроксилирования в системе N-оксид-N-метилморфолина (NMO) / OsO4 был превращен в диол 4. Было найдено, что гидроксилирование проходит стереоселективно, с образованием экзо-диола.
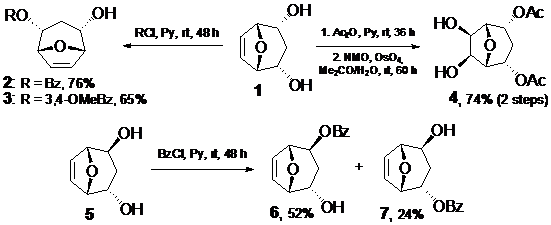
Разработанная нами методика получения моноэфиров была использована для синтеза бензоильных производных несимметричного диола 5 – моноэфиров 6 и 7. Было установлено, что преимущественно образуется производное 6, содержащее бензоильный заместитель в экзо-положении, что, очевидно, связано со стерическими факторами.
Следующим шагом нашей работы стало получение эфиров
N-метилурокановой кислоты и оксабициклических диолов. Для синтеза была использована известная методика на основе дициклогексилкарбодиимида (DCC) и диметиламинопиридина (DMAP) как сшивающих реагентов. Введение в реакцию спиртов 2, 3 и 6 позволило выделить эфиры 8, 9 и 10 с хорошими выходами.
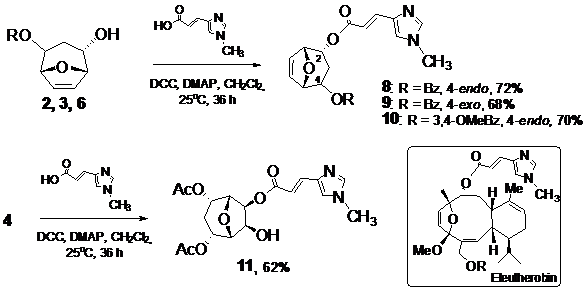
Также было исследовано получение сложного эфира диола 4 с
N-метилуроканой кислотой. Было показано, что реакция с одним эквивалентом кислоты приводит к моноэфиру 11, который был выделен с умеренным выходом. Таким образом, нами было синтезировано 4 новых производных
N-метилуроканой кислоты – структурных аналога элеутеробина.
Список литературы:
1 B. H. Long, J. M. Carboni, A. J. Wasserman, L. A. Cornell, A. M. Casazza, P. R. Jensen, T. Lindel, W. Fenical, C. R. Fairchild. Eleutherobin, a novel cytotoxic agent that induces tubulin polymerization, is similar to paclitaxel. Cancer Research, 1998, 58, 1111-1115.
2 D. J. Newman, G. M. Cragg. Advanced preclinical and clinical trials of natural products and related compounds from marine sources. Curr. Med. Chem, 2004, 11, 1693.
3 , , . Успехи в синтезе полигидроксипроизводных 8-оксабицикло[3.2.1]октана. Башкирский химический журнал, 2010, 17, 148-149.
4 D. A. Khlevin, S. E. Sosonyuk, M. V. Proskurnina, N. S. Zefirov. Stereoselective synthesis of highly substituted 8-oxabicyclo[3.2.1]octanes and 2,7-dioxatricyclo[4.2.1.03,8]nonanes. Tetrahedron 2012, 68, 5785–5792.
УДК 542.91:547.1’128
А.С. Солдатенко, С.В. Басенко, М.Г. Воронков
НОВЫЕ Si-ПЕРМЕТИЛЦИКЛО(1-МЕТОКСИФОСФОНА)СИЛОКСАНЫ
Федеральное государственное бюджетное учреждение науки Иркутский институт химии им. СО РАН, г. Иркутск
E-mail: *****@***irk. ru
Химия фосфорсодержащих циклогетеросилоксанов, продолжает привлекать внимание ученых [1-6].
Развивая исследования по поиску новых методов низкотемпературной генерации диорганилсиланонов, мы изучили взаимодействие диметил-дихлорсилана с триметилфосфатом. Реакция протекает уже при комнатной температуре, в отсутствии растворителя. По данным ЯМР 1Н, 13С, 29Si, 31P и хромато-масс-спектрометрии продуктами реакции являются P-метокси-фосфона-Si-гексаметилциклотри- (1) 38% и - циклотетрасилоксаны (2) 33%, а также перметилциклосилоксаны Dm [m = 3 (3) 4%, 4 (4) 15%, 5 (5) 10%]:
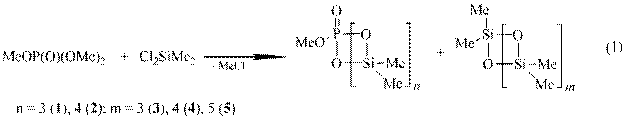
На начальном этапе реакции диметилдихлорсилана с триметилфосфатом ЯМР мониторинг обнаружил образование линейного диметил(диметокси-фосфаноилокси)хлорсилана (6),
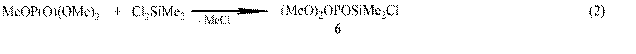
который через стадию внутримолекулярной циклизации распадается с образованием диметилсиланона и метилметафосфата:
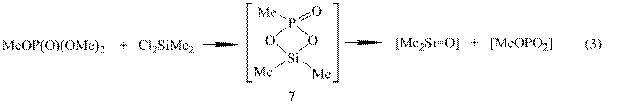
Диметилсиланон внедряется в соединения 6 и 7 с образованием (MeO)2OP(OSiMe2)2Cl, P-метоксифосфона-Si-гексаметилциклотри- (1) и –ци-клотетрасилоксанов (2).
При взаимодействии 1,3-дихлортетраметилдисилоксана с триметил-фосфатом методами ЯМР 1Н, 13С, 29Si, 31P был зафиксирован шестичленный
P-метоксифосфона-Si-тетраметилциклодисилоксан (8), однако конечными продуктами реакции являются восьми-, десяти - и двенадцатичленные P-метоксифосфона-Si-метилциклосилоксаны 1, 2, 9 с выходами 65, 31 и 4% соответственно:
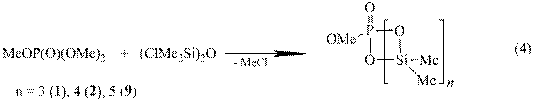
ЯМР мониторинг реакции (4) показал первоначальное образование 1,1,3,3-тетраметил-1-диметоксифосфаноилокси-3-хлордисилоксана (10),
![]()
а также 1,1,3,3,5,5-гексаметил-1-диметоксифосфаноилокси-5-хлортрисилоксана (11), продукта внедрения диметилсиланона в фосфордисилоксан:
![]()
Однако, как и в реакции с диметилдихлорсиланом, основными продуктами по данным ЯМР 1Н, 13С, 29Si, 31P и хромато-масс-спектрометрии оказались P-метоксифосфона-Si-гексаметилциклотри- (1), - циклотетрасилокса-ны (2), перметилциклосилоксаны 3-5.
Полученные результаты указывают на высокую лабильность исследуемых нами циклических фосфорсилоксановых структур, уменьшающуюся в ряду 7 > 8 > 1 > 2 > 9.
Список литературы:
1 , , Лукевиц производные фосфора и серы. Ленинград: Химия, 1968, 292 С.
2 Borisov S. N., Voronkov M. G., Lukevits E. J. Organosilicon Derivatives of Phosphorus and Sulfur. New York, London: Plenum Press, 1971, 343 P.
3 , , Роман соединения неметаллов. Производные азота и фосфора. Новосибирск: Наука. 1988. С. 146.
4 Voronkov M. G., Maletina E. A., Roman V. K. Heterosiloxanes. Derivatives of nitrogen and phosphorus. London: Hardwood academic publishers. 1991. P. 489.

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 |





