3 , Дубов основы метода магнитной памяти металла. - М.: , 2004. - 424 с.
УДК 66.095.5
, ,
ЭНЕРГИЯ АКТИВИРОВАННОГО КОМПЛЕКСА И
КОМПЕНСАЦИОННЫЙ ЭФФЕКТ ХИМИЧЕСКИХ РЕАКЦИЙ
Уфимский государственный университет экономики и сервиса,
«Нефтехимтехнологии»,г. Стерлитамак
E-mail:dinara441@mail.ru
Нами принято, что в ходе любого химического акта образуются два последовательных активированных комплекса, каждый из которых по конфигурации схож со структурой исходных реагентами и со структурой продуктов синтеза. Кроме того, активированный комплекс, представляет собой комбинацию двух или трех пар атомов, сорбированных друг в друга определенным ориентированным образом в некоторую конфигурацию со свойственным им определенным запасом энергии, достаточным для перехода их в продукты реакции данного элементарного процесса. Так как практически любая химическая реакция равновесная, то для протекания обратной реакции также должны соблюдаться аналогичные, но не одинаковые, требования по геометрическим и энергетическим составляющим второго комплекса. Для достижения ими превращения необходимого суммарного уровня энергии недостаточно для превращения активированных частей химических связей двух атомов молекул обратимых реакций сырье ![]() продукт. Для этого существенно, чтобы энергия определенным образом распределялась внутри двух разных комплексов, причем внутри таких активированных молекул энергия сосредоточилась на тех химических связях, разрыв или взаимодействие которых определяют направление данного химического превращения. Следовательно, любая траектория, описывающая изменение реагирующих частиц, в двух комплексах которой не достигается состояние, отвечающее конфигурации двух комплексов, даже если запас энергии превышает необходимый, не может довести систему до химического превращения. Внутри активированных частиц возможно последующее перераспределение энергии, например, вследствие столкновений они могут изменить конфигурацию и перейти в состояние активированных комплексов, либо, отдав избыток энергии, возвратиться в исходное состояние. Само понятие активированных комплексов предусматривает обязательное последовательное образование двух превращений в данной элементарной реакции. Если частицы, принявшие конфигурацию двух активированных комплексов с соответствующим запасом энергии, возвратятся в исходное состояние, то они не будут активированными комплексами, поэтому равновесная реакция не произойдет и система возвратится в исходное состояние. При образовании двух последовательных активированных комплексов лимитирующей стадией является та, которая протекает с затратой большей кинетической энергии. В качестве примера рассмотрим реакции вида:
продукт. Для этого существенно, чтобы энергия определенным образом распределялась внутри двух разных комплексов, причем внутри таких активированных молекул энергия сосредоточилась на тех химических связях, разрыв или взаимодействие которых определяют направление данного химического превращения. Следовательно, любая траектория, описывающая изменение реагирующих частиц, в двух комплексах которой не достигается состояние, отвечающее конфигурации двух комплексов, даже если запас энергии превышает необходимый, не может довести систему до химического превращения. Внутри активированных частиц возможно последующее перераспределение энергии, например, вследствие столкновений они могут изменить конфигурацию и перейти в состояние активированных комплексов, либо, отдав избыток энергии, возвратиться в исходное состояние. Само понятие активированных комплексов предусматривает обязательное последовательное образование двух превращений в данной элементарной реакции. Если частицы, принявшие конфигурацию двух активированных комплексов с соответствующим запасом энергии, возвратятся в исходное состояние, то они не будут активированными комплексами, поэтому равновесная реакция не произойдет и система возвратится в исходное состояние. При образовании двух последовательных активированных комплексов лимитирующей стадией является та, которая протекает с затратой большей кинетической энергии. В качестве примера рассмотрим реакции вида:
![]()
Для того чтобы понять механизм указанной реакции, необходимо зафиксировать координаты расположения указанных молекул, например, по отношению к одному атому водорода. Так как любое изменение положения атомов, молекул требует затраты кинетической энергии, которая переходит в потенциальную и фиксируется в виде их расположения по отношению к началу отсчета.
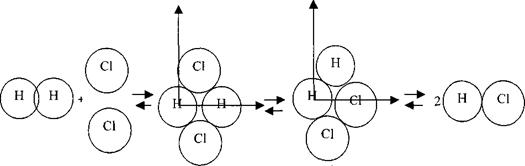
комплекс I комплекс II
Состояние атомов по отношению к атому водорода, находящегося в начале координат отсчета, образующих комплексы I, II, отличаются как геометрически, так и энергетическими составляющими. Кроме того, переход комплекс I ![]() комплекс II требует вращения атомов и их химических связей на 90°, на что требуется также затрата внутренней энергии (
комплекс II требует вращения атомов и их химических связей на 90°, на что требуется также затрата внутренней энергии (![]() ). Поэтому для осуществления любой равновесной реакции необходима затрата энергии (
). Поэтому для осуществления любой равновесной реакции необходима затрата энергии (![]() ) не только на образование двух активированных комплексов, но и на их вращение и на взаимную ориентацию атомов. Отличительной особенностью активированных комплексов друг от друга заключается в том, что комплекс I образуется из четырех атомов и двух химических связей геометрически и энергетически схожих атомам и химическим связям исходного сырья. Аналогично, комплекс II по аналогичным показателям схож с атомами и химическими связями атомов продукта реакции. В состоянии химического равновесия количества активированных комплексов, образующихся в обоих направлениях в единицу времени равны, что выражается равенством скоростей прямой и обратной реакций. Тогда количество активированных комплексов, образующихся в прямой реакции, должно быть равно половине общего количества их, возникающих в единицу времени. Таким образом, в активированном комплексе избыток энергии сконцентрирован по определенным степеням свободы, соответствующим направлению превращения в продукты реакции. Само понятие активированных комплексов предусматривает обязательное их превращение в продукты данной элементарной реакции (при адиабатическом протекании). Если частицы, принявшие конфигурацию активированного комплекса с соответствующим запасом энергии, возвратятся в исходное состояние, они не будут активированными комплексами и не учитываются в расчетах. Если максимальный уровень энергии промежуточных соединений реагирующих частиц хотя бы на бесконечно малую величину не доходит до энергетического уровня активированного комплекса, то реакция не произойдет и система возвратится в исходное состояние. Поэтому сам факт образования активированного комплекса и служит необходимым условием осуществления данного элементарного акта. Активированный комплекс образуется и разлагается, превращаясь в продукты реакции в одном элементарном акте, и в этом заключается коренное отличие активированного комплекса от промежуточных соединений, которые могут быть обнаружены. Делая попытку расчета количества активированных комплексов, образующихся в единицу времени в заданных условиях, мы пытаемся предсказать скорость элементарной реакции. Если реагирует 1 мкмоль исходных частиц и доля их, превращающихся в продукты реакции в единице времени составляет лишь 10-7, то она эквивалентна количеству возникающих активированных комплексов, превышающих 1010. Статистика Максвелла-Больцмана гласит, что протекание данной реакции происходит без нарушения равновесия. Это означает, что в превращении участвует малая доля всех частиц, и превращение протекает так медленно (т. е. не мгновенно), что статическое равновесие успевает восстановиться, время релаксации достаточно мало. Протекание реакции рассматривается как непрерывное изменение конфигурации частиц по ее координате с соответствующим изменением энергии вплоть до возникновения конфигурации активированного комплекса и его дальнейшего превращения в продукты реакции.
) не только на образование двух активированных комплексов, но и на их вращение и на взаимную ориентацию атомов. Отличительной особенностью активированных комплексов друг от друга заключается в том, что комплекс I образуется из четырех атомов и двух химических связей геометрически и энергетически схожих атомам и химическим связям исходного сырья. Аналогично, комплекс II по аналогичным показателям схож с атомами и химическими связями атомов продукта реакции. В состоянии химического равновесия количества активированных комплексов, образующихся в обоих направлениях в единицу времени равны, что выражается равенством скоростей прямой и обратной реакций. Тогда количество активированных комплексов, образующихся в прямой реакции, должно быть равно половине общего количества их, возникающих в единицу времени. Таким образом, в активированном комплексе избыток энергии сконцентрирован по определенным степеням свободы, соответствующим направлению превращения в продукты реакции. Само понятие активированных комплексов предусматривает обязательное их превращение в продукты данной элементарной реакции (при адиабатическом протекании). Если частицы, принявшие конфигурацию активированного комплекса с соответствующим запасом энергии, возвратятся в исходное состояние, они не будут активированными комплексами и не учитываются в расчетах. Если максимальный уровень энергии промежуточных соединений реагирующих частиц хотя бы на бесконечно малую величину не доходит до энергетического уровня активированного комплекса, то реакция не произойдет и система возвратится в исходное состояние. Поэтому сам факт образования активированного комплекса и служит необходимым условием осуществления данного элементарного акта. Активированный комплекс образуется и разлагается, превращаясь в продукты реакции в одном элементарном акте, и в этом заключается коренное отличие активированного комплекса от промежуточных соединений, которые могут быть обнаружены. Делая попытку расчета количества активированных комплексов, образующихся в единицу времени в заданных условиях, мы пытаемся предсказать скорость элементарной реакции. Если реагирует 1 мкмоль исходных частиц и доля их, превращающихся в продукты реакции в единице времени составляет лишь 10-7, то она эквивалентна количеству возникающих активированных комплексов, превышающих 1010. Статистика Максвелла-Больцмана гласит, что протекание данной реакции происходит без нарушения равновесия. Это означает, что в превращении участвует малая доля всех частиц, и превращение протекает так медленно (т. е. не мгновенно), что статическое равновесие успевает восстановиться, время релаксации достаточно мало. Протекание реакции рассматривается как непрерывное изменение конфигурации частиц по ее координате с соответствующим изменением энергии вплоть до возникновения конфигурации активированного комплекса и его дальнейшего превращения в продукты реакции.
Изменение энергии активации (![]() ) соответствует изменению внутренней энергии системы (
) соответствует изменению внутренней энергии системы (![]() ) при образовании активированного комплекса с поправкой на переход от абсолютного нуля к температуре эксперимента:
) при образовании активированного комплекса с поправкой на переход от абсолютного нуля к температуре эксперимента:
![]()
Поэтому при расчетной абсолютной скорости реакции с учетом найденной энергии активации имеем:
![]()
или: ![]()
![]()
Тогда: ![]() , (1)
, (1)
где ![]()
Данное соотношение очень важно тем, что связывает энергию активированного комплекса с энергией активации химической реакции. Следовательно, энергия активированного комплекса больше энергии активации химической реакции в 2,31 раза, а с учетом кинетической энергии (RT) в 2,50 раза, что подтверждается для многочисленных химических реакций. В дальнейших своих исследованиях теоретическими расчетами нами определяется энергия активированного комплекса и энергия активации, что позволяет оценить константу скорости гомогенных термических реакций и роль катализатора в изменении указанных термодинамических и кинетических параметров химических и каталитических реакций.
Из (1) следует, что для эндотермических реакций, не осложненных каталитическим действием реагента и стенок реактора компенсационный эффект 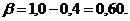 Роль тепловой и каталитической активации исходных молекул заключается в получении компенсационного эффекта
Роль тепловой и каталитической активации исходных молекул заключается в получении компенсационного эффекта ![]()
УДК 665.652.4
, ,
,
ИССЛЕДОВАНИЕ КИСЛОТНЫХ И КАТАЛИТИЧЕСКИХ СВОЙСТВ ИОННЫХ ЖИДКОСТЕЙ В ПРОЦЕССЕ ИЗОМЕРИЗАЦИИ Н-ГЕКСАНА
Уфимский государственный нефтяной технический университет, г. Уфа
*****@***ru
Одними из последних достижений в нефтехимии и органическом синтезе является применение в качестве, катализаторов, ионных жидкостей, систем, альтернативных по отношению к традиционным гетерогенным и гомогенным катализаторам. По физико-химическим свойствам ионные жидкости – это низкотемпературные расплавы солей, состоящие из гетероорганического катиона и неорганического аниона. ИЖ в процессах переработки нефти и нефтехимии и привлекают большое внимание благодаря низкому давлению насыщенных паров, отсутствию токсичности и возможности взаимодействия с металлорганическими соединениями. Некоторые хлоралюминатные ионные жидкости обладают суперкислотными свойствами и позволяют проводить процесс изомеризации легких алканов в термодинамически выгодных условиях, поскольку дают возможность осуществить изомеризацию при низких температурах, что приводит к увеличению равновесного выхода изопарафинов [4].

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 |





