a) O3, MeOH - H2O, 0oC; b) NH2C(O)NHNH2×HCl; c) NH2OH×HCl.
УДК 542.943.5 + 547.596
Г.Ю. Ишмуратов, В.С. Тухватшин, А.В. Баннова, Э.Р. Латыпова,
ПРЕВРАЩЕНИЯ ПЕРЕКИСНЫХ ПРОДУКТОВ ОЗОНОЛИЗА
(R)-4-МЕНТЕН-3-ОНА ПОД ДЕЙСТВИЕМ АЗОТСОДЕРЖАЩИХ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Институт органической химии УНЦ РАН, г. Уфа
Башкирский государственный университет
E-mail: *****@***ru
Ранее нами были представлены [1] пути превращений (R)-4-ментен-3-она (I) в реакции озонолиза, осуществляемой в среде апротонных растворителей (CH2Cl2 или CCl4) и их смесей с метанолом, которые заключались в перегруппировке промежуточного цвиттер-иона (II) в смешанный ангидрид (3R)-метил-5-оксопентановой и изомасляной кислот (III) либо в стабилизации интермедиата (II) в виде α-метоксигидропероксида (IV) соответственно. Этот перекисный продукт, как и ангидрид (III) и, вероятно, через стадию образования последнего, переводился кислотным метанолизом в ацеталеэфир (V).
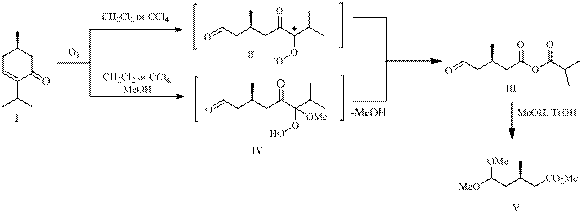
В данном сообщении нами приведены результаты исследований озонолитических превращений сопряженного циклоенона (I) в среде хлористого метилена или метанола и их смеси в присутствии азотсодержащих органических соединений (пиридин, триэтиламин, гидрохлорид семикарбазида) – известных акцепторов пероксидного кислорода.
Установлено, что проведение озонолиза енона (I) в хлористом метилене с добавкой пиридина приводит с хорошим выходом к дикетокислоте (VI) (опыт А).
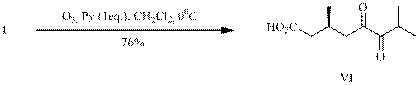
При замене хлористого метилена на метанол и сохранении остальных параметров (опыт В) с высоким выходом получен монометиловый эфир
(3R)-метилглутаровой кислоты (VII) – полупродукт в синтезах митозенов, проявивших фармакологическую активность против кишечной палочки и лейкемии у мышей; производных веррукарина, обладающих противоопухолевой, фунгицидной, цитотоксической, антибактериальной активностью, кетона Виндауза и Грундмана – синтона для витаминов D2 и D3.
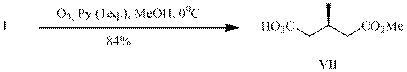
Применение в качестве растворителя в реакции озонолиза смеси (1:1) хлористого метилена и метанола (опыт С) снизило выход эфирокислоты (VII) до 63%. При этом в качестве минорных продуктов были зарегистрированы дикетокислота (VI), кетоэфир (VIII) – полупродукт в синтезе
(S)-(+)-гидропрена, и альдегидоэфир (IX).
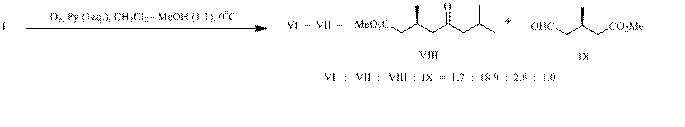 Аналогичные результаты были получены при замене пиридина на триэтиламин (опыт D).
Аналогичные результаты были получены при замене пиридина на триэтиламин (опыт D).
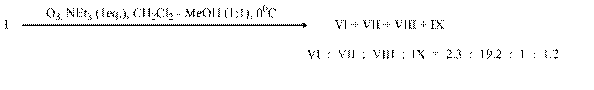
Использование для превращения перекисного продукта озонолиза циклоенона (I), образующегося в смеси (1:1) хлористого метилена и метанола, солянокислого семикарбазида (опыт Е) дало с высоким выходом ацеталеэфир (V) – ключевой синтон в синтезе целого ряда низкомолекулярных биорегуляторов насекомых.
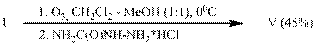
Список литературы:
1 , , ЖОрХ. 2002, 38, 1047.
УДК 547.512:547.25: 547.333
,1 ,2 ,2
,2 3
Новый метод получения циклопропилзамещенных аминов
1Башкирский государственный университет, инженерный факультет,
г. Уфа, E-mail: iramazan@inbox.ru
2 Федеральное государственное бюджетное учреждение науки
Институт нефтехимии и катализа РАН, г. Уфа.
3 Федеральное государственное бюджетное учреждение науки
Институт органической химии им. , г. Москва.
В последние годы авторы статьи развили новый подход к синтезу циклопропановых соединений, основанный на взаимодействии замещенных ацетиленов и алленов с карбеноидами алюминия [1,2]. В реакцию были успешно вовлечены пропаргиловые спирты и пропаргиламины [3,4]. Несмотря на простоту получения карбеноидов алюминия, их реакции с соединениями олефинового ряда были мало изучены. Так, к моменту начала наших исследований были известны лишь единичные примеры циклопропанирования карбеноидами алюминия гераниола, периллилового спирта, γ‑кремнийзамещенных аллиловых спиртов [5-7]. В продолжение наших исследований с целью разработки общего метода селективного получения функционально-замещенных циклопропанов изучены реакции карбеноидов алюминия с рядом ненасыщенных аминов.
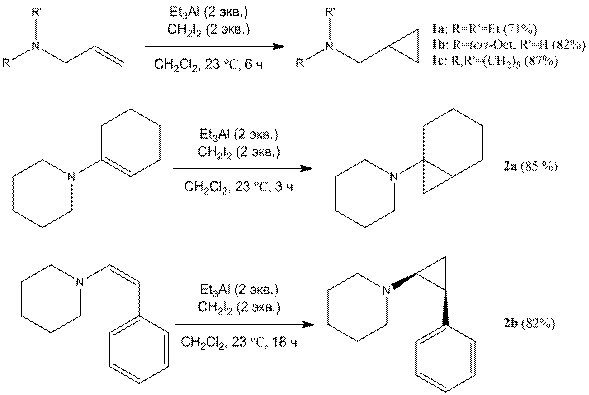
Нами установлено, что замещенные аллиламины и енамины (аллилдиэтиламин, аллил-трет-октиламин, аллилпиперидин, 1‑циклогексенилпиперидин, (Z)-1-стирилпиперидин) реагируют с двумя эквивалентами Et3Al и CH2I2 при комнатной температуре в дихлорметане с образованием соответствующих циклопропилметиламинов 1a-с и циклопропиламинов 2a, 2b с высокими выходами (71-87%). Аналогично, с высоким выходом продукты циклопропанирования образуются при проведении реакции в гексане. Использование в качестве растворителя бензола и толуола нежелательно вследствие побочной реакции алкилирования ароматического ядра. Проведение реакции в тетрагидрофуране и диэтиловом эфире ингибируют сам процесс образования карбеноидов алюминия из CH2I2 и Et3Al. В случае енаминов превращение проходит с сохранением конфигурации заместителей при двойной связи.
Преимущества предложенной методологии можно продемонстрировать на примере циклопропанирования 1-циклогексенилпирролидина. Продукт циклопропанирования был получен лишь с 8% выходом при использовании процедуры Симмонса-Смита (CH2I2-Cu/Zn) [8], с 48% выходом с помощью реагента Фурукава (CH2I2-Et2Zn) [9] и с 22% выходом посредством реагента CH2Br2-Zn/Cu-AcCl [10]. Наилучший результат (61%) был достигнут при использовании диазометана в присутствии каталитических количеств CuCl2 [9]. Предлагаемый реагент CH2I2-Et3Al позволяет получать 1‑аминобицикло[n.1.0]алканы с гораздо более высоким выходом. Мы не обнаружили следов исходного енамина в реакционной массе после завершения реакции, что является важным преимуществом при выделении продукта циклопропанирования в чистом виде методом вакуумной дистилляции, поскольку температуры кипения исходного субстрата и продукта превращения очень близки.
Список литературы:
1 I. R. Ramazanov, L. K. Dil'mukhametova, U. M. Dzhemilev, O. M. Nefedov, J. Organomet. Chem., 2010, 695, 1761-1767.
2 I. R. Ramazanov, A. V. Yaroslavova, U. M. Dzhemilev, O. M. Nefedov, Tetrahedron Lett., 2010, 51, 6268-6269.
3 I. R. Ramazanov, A. V. Yumagulova, U. M. Dzhemilev and O. M. Nefedov, Tetrahedron Lett., 2009, 50, 4233-4235.
4 I. R. Ramazanov, A. V. Yaroslavova, L. M. Khalilov, U. M. Dzhemilev, O. M. Nefedov, Russ. Chem. Bull., 2010, 59, 1668-1670.
5 К. Maruoka, Y. Fukutani, H. Yamamoto, J. Org. Chem., 1985, 50, 4412–4414.
6 A. B. Charette, A. Beauchemin, J. Organomet. Chem., 2001, 617-618, 702-708.
7 Y. Ukaji, K. Inomata, Chem. Lett., 1992, 2353-2356.
8 E. P. Blanchard , H. E. Simmons, J. S. Taylor, J. Org. Chem., 1965, 30, 4321–4322.
9 M. E. Kuehne, J. C. King, J. Org. Chem., 1973, 38, 304–311.
10 E. C. Friedrich , E. J. Lewis, J. Org. Chem., 1990, 55, 2491–2494.
УДК 634.0.813.2:542.61
Г.Г. Аминева, Н.С. Борисова, Ю.С. Зимин, А.Г. Мустафин
Взаимодействие окисленного АБИНОГАЛАКТАНА С ПРОИЗВОДНЫМИ УРАЦИЛа В ВОДНОЙ СРЕДЕ
ФГБОУ ВПО «Башкирский государственный университет», г. Уфа
E-mail: *****@***ru
В последнее время большое внимание уделяется созданию лекарственных препаратов пролонгированного действия для лечения и профилактики различных заболеваний. Подобные препараты позволят увеличить время действия лекарства в организме человека и одновременно снизить его суточную дозу. Одним из способов достижения такого результата является иммобилизация лекарственного вещества на полимерной матрице. В качестве такой матрицы было предложено использовать модифицированный природный полимер арабиногалактан Сибирской лиственницы, полученный озонированным окислением в водной среде. Окисленный полисахарид обладает меньшей молекулярной массой и большей комплексообразующей способностью по сравнению с исходным полимером, что позволяет использовать его в качестве носителя биологически активных веществ, например, производных урацила.
Комплексообразование окисленного арабиногалактана с урацилами изучали в водной среде, как при комнатной температуре, так и при нагревании. Показано, что в условиях эксперимента урацил и его производные (5-фторурацил, 6-метилурацил, 5-амино-6-метилурацил, 5-бром-6-метилурацил, 5-гидрокси-6-метилурацил, 5-нитро-6-метилурацил) находятся в дикето-форме.
Согласно литературным данным в УФ-спектре урацилов имеются две полосы поглощения в областях 200-220 и 255-275 нм. Методом ультрафиолетовой спектроскопии было установлено, что добавление окисленного арабиногалактана к водным растворам урацилов приводит к гипсохромным сдвигам максимумов поглощения и увеличению интенсивностей пиков полос поглощения, которые свидетельствую об образовании комплексов.
Состав полученных комплексных соединений определяли методами изомолярных серий и молярных отношений. Во всех случаях их состав оказывался равным 1:1, т. е. на одну карбоксильную группу арабиногалактана приходится одна молекула урацила или его производного. Константы устойчивости комплексов, образованных урацилами и арабиногалактаном, меняются в пределах (1÷5)·104 л/моль. Установлено, что электронодонорные заместители в пятом положении молекулы 6-метилурацила способствуют увеличению устойчивости образующихся комплексных соединений.

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 |





