Список литературы:
1 / / Защита от коррозии, старения и биоповреждеиий машин, оборудования и сооружений. – 1987. – М. – Т. 1 – С. 687. – Т. 2 – С. 783.
2 / / Методика выделения микроорганизмов, способных развиваться в аэробных и анаэробных условиях в зависимости от конечного акцептора электронов. – 1987 – М. – С. 92-93.
УДК 004.94
1, 2
вопросы математического моделирования физиологических процессов
1,
2Башкирский государственный университет, г. Уфа
E-mail: lindyub@yandex.ru
Одним из наиболее важных, но недостаточно изученных физиологических процессов является мышечная активность. С мышечным сокращением связано функционирование всех систем в организме человека, любое нарушение в работе мышц может привести к различным патологиям или даже к летальному исходу. Поэтому изучение процессов, происходящих в сокращающейся мышце, является одной из важных и актуальных задач биомеханики. В данной работе рассматривается механизм мышечного сокращения на молекулярном уровне, то есть в элементарной сократительной единице мышцы – саркомере.
Изучение молекулярных механизмов мышечного сокращения связано с определенными трудностями, которые, главным образом, заключаются в сложности отслеживания этих механизмов непосредственно в мышце. Исследование же изолированных сократительных белков может дать только косвенную информацию о процессе мышечного сокращения. Таким образом, актуальным является исследование молекулярных механизмов мышечного сокращения путем математического моделирования, основанного на знаниях о молекулярной конструкции саркомера и его физико-химических свойствах.
Механизм мышечного сокращения основан на взаимодействии актиновых и миозиновых нитей, которое осуществляется за счет энергии, выделяющейся при расщеплении молекулы АТФ до АДФ и фосфорной кислоты [1].
Для исследования кинетики протекания указанных реакций авторами на основе закона действующих масс построена математическая модель, представляющая собой задачу Коши для системы обыкновенных нелинейных дифференциальных уравнений:
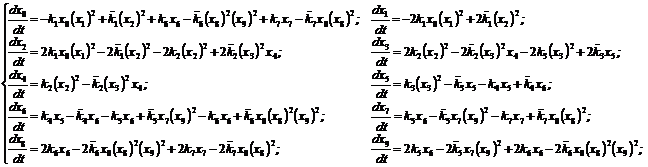 с начальными условиями: xi(t0)=xi0.
с начальными условиями: xi(t0)=xi0.
Здесь xi, i=0,…,9 – концентрации веществ, участвующих в акте мышечного сокращения, ![]() и
и ![]() , i=1,…,7 – соответственно, кинетические константы скоростей прямой и обратной стадий, t – время протекания реакции, t0 – начальное время.
, i=1,…,7 – соответственно, кинетические константы скоростей прямой и обратной стадий, t – время протекания реакции, t0 – начальное время.
Для полученной системы были решены прямая и обратная кинетические задачи. Прямая задача решена методом Кутты-Мерсона с динамической проверкой выполнения законов сохранения. Решение обратной задачи сводится к нахождению минимума критерия оптимизации, для которого предложен адаптированный вариант генетического алгоритма [2]. Для решения обратной кинетической задачи был поставлен псевдоэксперимент путем решения прямой задачи для набора кинетических констант, определенных на основании физико-химических соображений: k1=10, k2=0,1, k3=1, k4=5, k5=1, k6=1, k7=1, ![]() =1,
=1, ![]() =1,
=1, ![]() =1,
=1, ![]() =0,5,
=0,5, ![]() =1,
=1, ![]() =1,
=1, ![]() =0,5. В результате был получен следующий набор кинетических констант: k1=2,1, k2=0,1, k3=1,1, k4=4,3, k5=2,2, k6=2,3, k7=0,8,
=0,5. В результате был получен следующий набор кинетических констант: k1=2,1, k2=0,1, k3=1,1, k4=4,3, k5=2,2, k6=2,3, k7=0,8, ![]() =0,2,
=0,2, ![]() =1,
=1, ![]() =1,2,
=1,2, ![]() =0,4,
=0,4, ![]() =2,3,
=2,3, ![]() =1,2,
=1,2, ![]() =0,4, т. е. показана неединственность минимума критерия оптимизации.
=0,4, т. е. показана неединственность минимума критерия оптимизации.
Проведена проверка генетического алгоритма на макроуровне моделирования мышечного сокращения, которая показала корректность реализованного подхода [2], на основании чего был сделан вывод о том, что расхождение значений кинетических параметров с эталонными (для модельного примера) может быть вызвано существованием областей неопределенности решения обратной задачи, когда кинетические измерения задаются внутри некоторого интервала точности, определяемого величиной погрешности измерений. В настоящее время производится разработка алгоритмов оценки указанных областей неопределенности.
Таким образом, получена математическая модель мышечного сокращения на молекулярном уровне, которая может служить основой для построения математических моделей сокращения мышцы на других, более высоких, уровнях исследования.
Список литературы:
1 , Охотников нелинейных биологических процессов. Переход к хаосу. − Екатеринбург: Изд-во Урал ун-та, 2008, – 154 с.
2 , , Губайдуллин вычисления при моделировании мышечного сокращения. // В мире научных открытий. Красноярск: НИЦ, 2011. №8 (20), С. 242-248.
УДК 547.94
, ,
ПОЛУЧЕНИЕ ГИБРИДНОЙ МОЛЕКУЛЫ
2,3:20,22-БИС-О-[2-(6-ГИДРОКСИ-2,5,7,8-ТЕТРАМЕТИЛХРОМАН-2-ИЛ) ЭТИЛИДЕН]-20-ГИДРОКСИЭКДИЗОНА
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
Уфимский государственный нефтяной технический университет, г. Уфа
E-mail: *****@***ru
Экдистероиды – гормоны линьки, метаморфоза и диапаузы насекомых и ракообразных были впервые выделены из куколок непарного шелкопряда Bombyx mori в середине 1950-х годов. Спустя 10 лет зоогормоны были выделены из растений, причем в значительно более высоких концентрациях. К настоящему времени выделено и идентифицировано более 300 зоо - и фитоэкдистероидов.
Решающим событием, определившим интенсивное развитие области химии природных соединений, послужило открытие в
1966 г. веществ, близких по структуре α-экдизону, в растениях. В корневищах папоротника Polipodium vulgare содержание смеси экдистероидов достигало 2% от веса сухих корневищ. Эти вещества, выделенные из растений и по структуре близкие к α-экдизону получили название фитоэкдизонов или фитоэкдистероидов. Обнаружение гормонов насекомых в многократно больших количествах в растениях представляло практический интерес для эндокринологических исследований, поиска возможностей применения в медицине, а также для изучения химических трансформаций.
Характерными элементами структуры экдистероидов являются Δ7-6-кето-14α-группировка, цис-сочленение колец А и В, гидроксильные группы в стероидном скелете.
В качестве природного источника экдистероидов в работе используется растение Serratula coronata, а доступным природным экдистероидом является 20-гидроксиэкдизон.
Был синтезирован бис-конъюгат 2,3:20,22-Бис-О-[2-(-6-бензилокси-2,5,7,8-тетраметилхроман-2-ил)этилиден]-20-гидроксиэкдизон реакцией взаи-
модействия исходной молекулы 20-гидроксиэкдизона с 6-бензилокси2,5,7,8-
тетраметилхроман-2-ил) ацетальдегидом при катализе ТsOH и последующим
гидрогенолизе 6-бензильной функциональной группы в условиях (H2 /Pd-C).
Реакция взаимодействия 20-гидроксиэкдизона с хроманилальдегидом кислотно-
катализируемая.
Для целевого бисаддукта был снят масс-спектр MALDI TOF и зарегистрирован ион [М+Н]+. В спектрах ЯМР 1Н и 13С полученных гибридных соединений присутствуют сигналы всех атомов водорода и углерода экдистероидного и хроманильного фрагментов молекул.
УДК 579.66, 579.852.11, 577.15
, ,
ОЦЕНКА ВОЗМОЖНОСТИ ИСПОЛЬЗОВАНИЯ БАКТЕРИЙ BACILLUS SUBTILIS В КАЧЕСТВЕ ДЕСТРУКТОРОВ НОВЫХ БИОРАЗЛАГАЕМЫХ ПОЛИМЕРОВ
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования Башкирский государственный аграрный университет, г. Уфа
e-mail: *****@***ru
Несмотря на то, что в настоящее время масштабы производства биоразлагаемых полимеров крайне невысоки, их использование представляется перспективным в различных отраслях промышленности, например, при производстве различных упаковочных материалов и одноразовой посуды [1]. Одним из этапов создания биодеградируемых материалов является оценка способности полимера разрушаться под действием продуктов метаболизма редуцентов (бактерий и грибов). Эффективность и экспрессность скрининга данного свойства в большой степени определяется особенностями используемых в эксперименте микроорганизмов. Так как в состав биоразлагаемых полимеров наряду с синтетическими входят полимеры биогенные, такие как хитин, хитозан, целлюлоза, крахмал, пектин, коллаген, эластан и т. д., скорость разложения будет зависеть от активности и уровня синтеза гидролитических ферментов микроорганизмов-биодеструкторов. Данный факт, а также относительная небезопасность работы со смешанными и неидентифицированными культурами микроорганизмов, обуславливают целесообразность использования чистых культур продуцентов гидролаз в лабораторных экспериментах по оценке биодеградируемости сополимеров. В данной работе мы исследовали активность некоторых гидролитических ферментов трех эндофитных штаммов Bacillus subtilis 26Д, 11В и 49РН, выделенных из растений пшеницы. Активность ферментов определяли в культуральной жидкости, полученной после культивирования штаммов в жидких средах с добавлением коллоидного хитина, целлюлозы или пектина в качестве источников углерода. Отборы проб культуральной жидкости осуществляли через 12, 24, 36 и 48 часов культивирования. Активность хитиназы, целлюлазы и пектиназы, продуцируемых штаммами B. subtilis, определяли по реакции с динитросалициловой кислотой [2]. Активность протеаз определяли по реакции фермента с азоказеином (Sigma, США) [3]. В результате проведенных исследований нам не удалось обнаружить заметной активности для целого ряда гидролаз – хитиназы, целлюлазы и пектиназы, несмотря на наличие в среде культивирования штаммов субстратов и индукторов синтеза данных ферментов. В то же время все исследованные штаммы оказались способны продуцировать протеолитические ферменты в созданных условиях (рис. 1). Таким образом, было показано, что использование эндофитных бацилл в качестве биодеструкторов сополимеров на основе природных полисахаридов не представляется перспективным. Однако наличие высокой активности протеаз у штаммов открывает возможности их использования в качестве деструкторов биоразлагаемых полимеров на основе белковых молекул. В дальнейшей работе планируется провести выделение, идентификацию бактериальных изолятов из различных природных сред и скриниг активности их гидролаз для создания эффективной системы оценки биоразлагаемости новых полимеров на основе природных полисахаридов и белков.

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 |





