2 Абрамзон -активные вещества. Ленинград: изд-во Химия, 1981. – 303 с.
3 X. Ферментативная активность. Ф. X. Хазиев. – М.: Знание, 1976. – 322 с.
4 Svarovskaya L. bined physico-chemical and microbiological EOR method / L. I. Svarovskaya, L. K.Altunina, Z. A. Rozhenkova // Proceedings of the 10th European Symposium "Improved Oil Recovery". – Brighton, Unaited Kingdom, August 18-20. 1999. – Report N 038.6 pages.
5 Горелова метод определения карбамида в водных, спиртоводных и углеводородных растворах / , , // Заводская лаборатория. – 1992. – № 11. – С. 14-16.
6 Большой практикум по микробиологии под ред. . – М.: Высшая школа, 1962. – 491с.
7 ефтяная микробиология: пер. с англ. Э. Бирштехер. – СПб.: Гостоптехиздат, 1957. – 314 с.
УДК 544.473:577.15
, ,
ПОИСК БИОКАТАЛИЗАТОРОВ ДЛЯ ВОССТАНОВЛЕНИЯ
п-МЕТОКСИАЦЕТОФЕНОНА
Уфимский государственный нефтяной технический университет, г Уфа
E-mail: *****@***net
Оптически активный (S)-1-(4-метоксифенил)этанол является ключевым синтоном в синтезе циклоалкил[b]индолов, которые могут быть использованы при лечении аллергических реакций [1, 2]. Перспективным подходом к получению этого энантиомера является биовосстановление его прохирального предшественника (п-метоксиацетофенона) с помощью микроорганизмов.
С целью создания эффективного метода получения
(S)-1-(4-метоксифенил)этанола на первом этапе исследований осуществлен поиск продуцентов оксидоредуктаз, способных восстанавливать п-метоксиацетофенон в высокой концентрации (5 г/л).
Трансформацию п-метоксиацетофенона проводили при при 35°С в 0.1 М фосфатном буфере (рН 7), содержащем 10% изопропанола, 5 г/л субстрата и 0.3 г/л биомассы микроорганизмов, при перемешивании в течение 36-72 ч. В результате тестирования 15 дрожжевых культур из коллекции кафедры биохимии и технологии микробиологических производств Уфимского государственного нефтяного технического университета были выявлены 3 культуры базидиомицетных дрожжей (Р-3,
ГБ-3, ГБ-4), трансформирующих п-метоксиацетофенон в
1-(4-метоксифенил)этанол с выходом продукта 51-85%.

Таким образом, найдены перспективные микроорганизмы, способные осуществлять восстановление п-метоксиацетофенона при его концентрации в растворе 5 г/л. Показано, что для получения энзиматически активной биомассы найденных перспективных микроорганизмов в качестве доступного сырья может быть использован глицерин – отход производства биодизеля.
Список использованной литературы
1. Hillier C., Marcoux J. F., Zhao D. L., Grabowski E. J.J., Mckeown A. E., Tillyer R. D. // J. Org. Chem.- 2005.- V. 70.- P. 8385
2. Hillier C., Desrosiers J. N., Marcoux J. F., Grabowski E. J.J. // Org. Lett.- 2004.- V. 6.- P. 573
УДК 544.473:577.15
, ,
РАЗРАБОТКА МЕТОДА ПОЛУЧЕНИЯ ОПТИЧЕСКИ ЧИСТОГО
(S)-2-БРОМ-1-(4-НИТРОФЕНИЛ)ЭТАНОЛА
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
Уфимский государственный нефтяной технический университет, г. Уфа
E-mail: *****@***net
(S)-2-бром-1-(4-нитрофенил)этанол является предшественником в синтезе (S)-соталола – соединения, обладающего способностью блокировать
β-адренергические рецепторы и используемого для лечения сердечно-сосудистых заболеваний [1]. (S)-Соталол также применяется для лечения астмы и бронхита [2]. Терапевтическими свойствами обладает только (S)-энантиомер соталола. В связи с этим создание стереонаправленного метода синтеза оптически чистого (S)-2-бром-1-(4-нитрофенил)этанола является актуальной задачей.
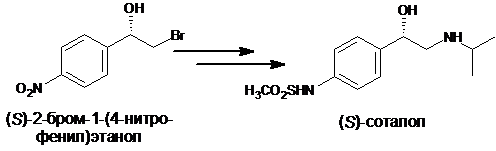
В результате скрининга микроорганизмов, способных катализировать энантиоселективное ацетилирование 2-бром-1-(4-нитрофенил)этанола винилацетатом, найдены культуры микроорганизмов Rhodococcus sp. 77-32s, Rhodococcus sp. 78-5 и Bacillus sp. 77-34, в присутствии которых преимущественно ацетилируется (R)-2-бром-1-(4-нитрофенил)этанол.
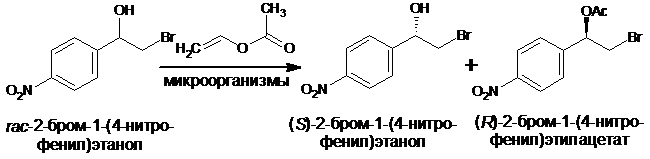
Установлено влияние состава среды культивирования микроорганизмов на активность и энантиоселективность клеточных катализаторов. На основе обезвоженной ацетоном биомассы Rhodococcus sp. 77-32s, выращенной на среде с содержанием 3оБ сусла, создан биокатализатор, способный трансформировать ~50% рацемического спирта с преимущественным образованием (R)-2-бром-1-(4-нитрофенил)этилацетата с оптической чистотой 60,3 % ее. Оптическая чистота остаточного спирта, в котором преобладает (S)-энантиомер, составляет 62,7 % ее.
Список литературы:
1 Agustian J., Kamaruddin A. H., Bhatia S. // Process Biochemistry.- 2010.- V. 45.- P. 1587
2 Kapoor M., Anand N., Ahmad K., Koul S., Chimni S. S., Taneja S. C., Qazi G. N. // Tetrahedron: Asymmetry.- 2005.- V. 16.- 717
УДК 577.3.001.57
,
ИССЛЕДОВАНИЕ ПРОЦЕССА БИОДЕГРАДАЦИИ ХЛОРФЕНО-ЛОВ
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
Уфимский государственный нефтяной технический университет, г. Уфа
E-mail: *****@***ru
С целью эффективной биодеградации хлорпроизводных фенолов была выделена культура микроорганизмов-деструкторов, способных потреблять хлорфенолы максимальной начальной концентрации 250 мг/л.
Через 7 дней после начала культивирования микроорганизмов в качалочных колбах наблюдается окрашивание раствора в малиновый цвет. Причем, окрашивание наблюдалось в колбах с начальными концентрациями хлорфенолов от 100 до 250 мг/л с увеличением интенсивности окрашивания пропорционально концентрации. Пигменты у многих микроорганизмов представляют собой вторичные метаболиты; это означает, что они не принадлежат к тем соединениям, которые имеются у всех этих организмов [1]. Мы предположили, что пигментация может быть связана с образованием фенолами, находящимися в среде в большой концентрации, соединений с компонентами клеток микроорганизмов.
Подобные явления были замечены и в других исследованиях. Так в опытах по утилизации высоких концентраций нетепродуктов культурой микроорганизмов рода Pseudomonas fluorescens отмечалось выделение насыщенного желто-зеленого пигмента в питательную среду через 12 часов после начала культивирования [2]. Как и в нашем случае, возможно, это связано с активизацией окисляющих путей метаболизма и адаптативной способностью штамма к повышенной концентрации субстрата.
Такие основные признаки, как: Грам(-), форма клеток, цвет колонии, аэробное окисление углеводов, гидролиз крахмала, разжижение желатины, рост на синтетической среде, каталазная активность согласно определителю Берги, позволяют предположить, что культура относится к роду Pseudomonas [1]. Выделение в среду нефлуоресцирующего пигмента и сравнение физиолого-биохимических признаков позволяет с большой долей вероятности считать выделенный штамм относящимся к виду Pseudomonas сepacia.
Список литературы:
1 Хоулт Дж. Определитель бактерий /Дж. Берджи Хоулт, Н., нит. — М., 1997.
2 Станкевич, углеводородокисляющих бактерий рода Pseudomonas для биоремедиации нефтезагрязненных почв: дис. канд. биол. наук: защищена 03.05.2002; утв. 05.07.2002; . – Москва, 2002 – 132с.
УДК 579.66
, ,
ПОИСК ДРОЖЖЕЙ - ПРОДУЦЕНТОВ КАРБОКСИЭСТЕРАЗ И ЭКЗОПОЛИМЕРОВ НА ГЛИЦЕРИНЕ
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
Уфимский государственный нефтяной технический университет, г. Уфа
E-mail: *****@***ru
Перспективными направлениями в переработке глицерина – отхода производства биодизеля является микробиологический синтез ферментов и полимеров с помощью микроорганизмов.
К практически важным ферментам относятся карбоксиэстеразы, которые катализируют реакции расщепления эфирной связи в сложных эфирах, проявляя широкую субстратную специфичность, высокую регио - и энантиоселективность, что позволяет их использовать в качестве эффективных биокатализаторов для получения оптически активных соединений методами биотрансформации. Ферменты стабильны и проявляют высокую активность в органических растворителях, используемых для трансформации гидрофобных соединений.
Особый интерес представляют продуценты внутриклеточных карбоксиэстераз, на основе которых могут быть созданы экономичные биокатализаторы, представляющие собой целые или пермеабилизованные клетки микроорганизмов. Рациональная переработка остатка культуральной жидкости после удаления из нее энзиматически активной биомассы, позволит получать дополнительные практически важные продукты и снизить затраты на приготовление биокатализатора.
Известно, что микроорганизмы способны продуцировать экологически безопасные внеклеточные полимеры, которые могут заменить токсичные синтетические флокулянты, эмульгаторы, ПАВы, загустители, широко используемые в различных отраслях промышленности. Получение внеклеточных полимеров и клеточных катализаторов в одном биотехнологическом процессе может быть экономически целесообразным.
С целью разработки такого процесса в настоящей работе осуществлен поиск культур дрожжей из коллекции микроорганизмов УГНТУ, способных при росте на глицерине одновременно продуцировать экзополимеры и внутриклеточные карбоксиэстеразы.
В результате исследования гидролиза этилацетоацетата микроорганизмами выявлены 13 культур, проявляющих карбоксиэстеразную активность. Обнаружено, что 5 культур накапливают в среде внеклеточные полимеры, осаждаемые органическими растворителями (этанолом, ацетоном).

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 |





