5 Haoudi-Mazzah A., Dhamelincourt P., Mazzah A., Lazraq M. // J. Raman Spectrosc. 1998. V. 29, N 12. P. 1047.
6 Hänish von C., Hampe O., Weigend F., Stahl S. // Angew. Chem. Int. Ed. 2007. V. 46, N 25. P. 4775.
УДК 547.426.23
, ,
, ,
СИНТЕЗ ОПТИЧЕСКИ ЧИСТЫХ МАКРОГЕТЕРОЦИКЛОВ
С ГИДРАЗИДНЫМ И СЛОЖНОЭФИРНЫМИ ФРАГМЕНТАМИ
ИЗ l-МЕНТОЛА И ТРИГЛИЦЕРИДА РИЦИНОЛЕВОЙ КИСЛОТЫ
Институт органической химии УНЦ РАН, г. Уфа
E-mail: *****@***ru
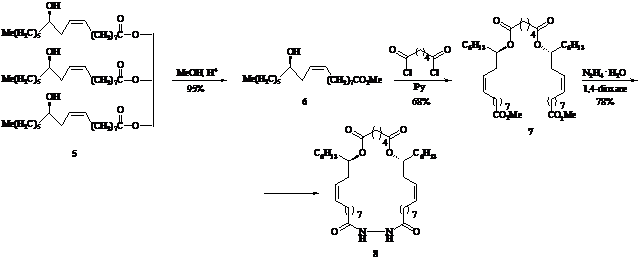
В данном сообщении представлен короткий и эффективный синтез оптически чистых содержащих гидразидный фрагмент макролидов (4) и (8) – соединений с потенциально комплексообразующими свойствами и биологической активностью, исходя из природных l-ментола (1) и касторового масла (5).
Синтезы макрогетероциклов (4) и (8) основаны на последовательно протекающих реакциях [2+1]-конденсации гидроксиэфиров (2) и (6) с хлорангидридами глутаровой и адипиновой кислот соответственно и [1+1]-взаимодействия полученных бис-производных (3) и (7) с гидразингидратом при комнатной температуре в 1,4-диоксане (мольное соотношение субстрат : реагент : растворитель, 1:1:100).
Строение макролидов (4) и (8) установлено методами ИК, ЯМР 1Н и 13С спектроскопии и хромато-масс-спектрометрии высокого разрешения, чистота подтверждена методом ВЭЖХ.
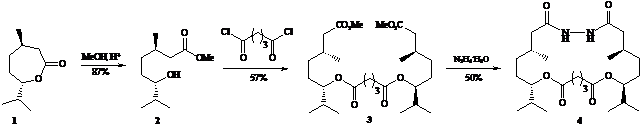
УДК 547.475.124
, ,
,
ГИДРОБОРИРОВАНИЕ-ОКИСЛЕНИЕ СЛОЖНОЭФИРНЫХ ПРОИЗВОДНЫХ РИЦИНОЛЕВОЙ КИСЛОТЫ
Институт органической химии УНЦ РАН, г. Уфа
E-mail: *****@***ru
Ранее [1] было показано, что в реакции гидроборирования-окисления оптически активный центр непредельных спиртов (I и II) – производных рицинолевой кислоты – незначительно влияет на региоселективность, о чем свидетельствует преобладание на 6 и 10% 1,3-диолов (III и IV) над их
1,4-изомерами (V и VI) соответственно, но индуцирует образование новых асимметрических центров преимущественно (S)-конфигурации, что доказано циклизацией 1,3-гликолей (III, IV) (de 32 и 50% соответственно) в соответствующие стереоизомерные 1,3-диоксаны, а 1,4-диолов (V и VI) (de 40 и 22% соответственно) – в 2,5-диалкилзамещенные тетрагидрофураны.
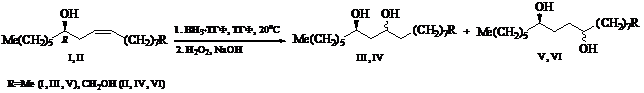
В продолжение исследований по влиянию оптически активного
12R-центра в рицинолевой кислоте на регио - и стереоселективность реакции гидроборирования-окисления двойной связи использованы его сложноэфирные производные – касторовое масло (содержание рицинолевой кислоты ~90%) (VII) и метиловый эфир (VIII).
При взаимодействии касторового масла (VII) даже с двухмольным избытком ВН3•ТГФ (ТГФ, 20оС) двойная связь не затрагивается, при этом проходит лишь гидридное восстановление карбоксильной группы с образованием непредельного диола (II) (табл., оп. 1). Инертность триглицерида (VII) по отношению к комплексу ВН3•ТГФ в этих условиях мы объясняем стерическими факторами.

В более жестких условиях (кипячение) триглицерид (VII) с 85% выходом превращен в смесь (57:43, по данным ВЭЖХ и ЯМР 1Н) 1,3- (IV) и
1,4-региоизомерных (VI) триолов – продуктов восстановления сложноэфирной группы и гидроборирования-окисления двойной связи (табл., оп. 2).
Гидроборирование метилового эфира (VIII) избытком ВН3•ТГФ при комнатной температуре приводило после окисления щелочной перекисью водорода к смеси и (87:13) региоизомерных триолов IV и VI (табл., оп.3), тогда как при кипячении региоселективность несколько снижалась, и была получена смесь (72:28) тех же региоизомеров (табл., оп. 4).
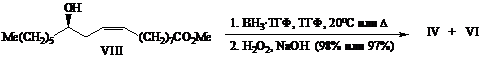
Сравнительный анализ спектров ЯМР 1,3- (IV)- и 1,4- (VI) - триолов со спектрами соединений III-VI, полученных при гидроборировании енолов I и II [2], показывает, что во всех случаях преобладают диастереомеры с
(S)-конфигурацией образующихся асимметрических центров. Данные по регио - и стереоселективности гидроборирования-окисления производных рицинолевой кислоты (VII и VIII) приведены в таблице.
Таблица - Состав продуктов гидроборирования-окисления производных рицинолевой кислоты (VII и VIII)
№ опыта | Исходное соеди-нение | темпера-тура реакции, оС | Содержание IV в реакционной смеси, % | Соотношение (10S,12R)-/(10R,12R)-IV | Содержание VI в реакционной смеси, % | Соотношение (9S,12R)-/(9R,12R)-VI |
1 | VII | 20 | - | - | ||
2 | VII | Δ | 57 | 1.8 : 1.0 | 43 | 1.0 : 1.0 |
3 | VIII | 20 | 87 | 5.0 : 1.0 | 13 | 1.0 : 0 |
4 | VIII | Δ | 72 | 1.3 : 1.0 | 28 | 5.0 : 1.0 |
Таким образом, в реакции гидроборирования-окисления среди производных рицинолевой кислоты наибольшая регио - и стереоселективность наблюдается для метилового эфира рицинолевой кислоты, о чем свидетельствует преобладание на 74% 1,3-диола над его 1,4-изомером и асимметрических центров преимущественно (S)-конфигурации: 1,3-гликолей до 87% и 1,4-диолов до 100%.
Список литературы:
1 , , Ж. орган. химии. 2008, 44, 1145.
УДК 547.256.2+547.473.41
, ,
, ,
НИЗКОТЕМПЕРАТУРНОЕ ВОССТАНОВЛЕНИЕ
МЕТИЛ-3R,7-ДИМЕТИЛ-6S-ГИДРОКСИОКТАНОАТА
ДИИЗОБУТИЛАЛЮМИНИЙГИДРИДОМ В ДИХЛОРМЕТАНЕ
Институт органической химии УНЦ РАН, Уфа, Россия
Е-mail: *****@***ru
Ранее [1] нами сообщалось об образовании О-изобутилового ацеталя
(-)-ментолактола (2) по новой реакции в химии алюминийорганических соединений – образование О-изобутильных производных семичленных лактолов в процессе низкотемпературного (-70оС) восстановления оксепанонов избытком (³ 2 экв.) диизобутилалюминийгидрида в хлористом метилене.
Нами обнаружено, что этот же циклический ацеталь (2) является главным продуктом [наряду с минорным лактолом (4)] в реакции низкотемпературного (-70оС) восстановления метил (3R,6S)-6-гидрокси-3,7-диметилоктаноата (3) – ациклического продукта метанолиза лактона (1) – диизобутилалюминийгидридом (4 экв.) в том же растворителе.

Список литературы:
1. , , Толстиков реакция в химии алюминийорганических соединений // Ж. орган. химии, 2011, Т. 47, Вып. 3. С. 471-472.
УДК 547.256.2+547.473.41-314
, ,
, ,
НОВЫЕ ПРИМЕРЫ НОВОЙ РЕАКЦИИ В ХИМИИ АЛЮМИНИЙОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Институт органической химии УНЦ РАН, г. Уфа
Е-mail: *****@***ru
Ранее нами сообщалось о новой реакции в химии алюминийорганических соединений – образование О-изобутильных производных семичленных лактолов (1-3) в процессе низкотемпературного (-70оС) восстановления
(-)-ментолактона (4), карвоментолактона (5) и α-камфолида (6) избытком (³ 2 экв.) диизобутилалюминийгидрида в хлористом метилене [1].
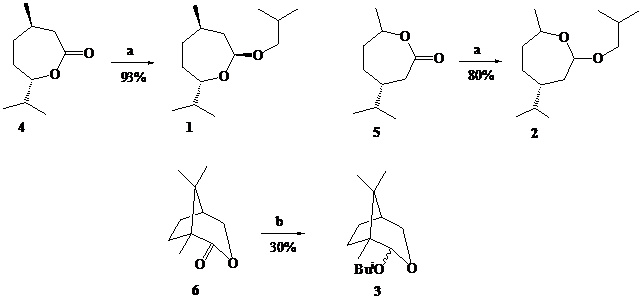
Реагенты: a. 2 eq. Bui2AlH, CH2Cl2, –70oC; b. 6 eq. Bui2AlH, CH2Cl2, –70oC.
В данном сообщении представлены новые примеры этой реакции – образование О-изобутилоксепанолов (11-13) – при восстановлении в тех же условиях адамантанолактона (7), b-камфолида (8) и лактона (10), полученного, в свою очередь, из аллобетулина (9) по методу [2].
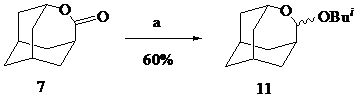
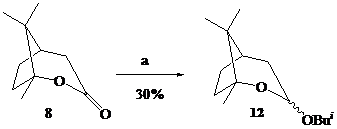

Реагенты: a. 4 eq. Bui2AlH, CH2Cl2, –70oC.
Список литературы:
1 , , // Ж. орган. химии, 2011, Т. 47, Вып. 3, С. 471-472.
2 Pradhan B. P., Chakraborty S. // Tetrahedron Lett., 1989, V. 30, N 40, P. 5463-5466.
УДК 542.943.5 + 546.172 + 547.313 + 547.497.1
Г.Ю. Ишмуратов, Ю.В. Легостаева, Л.П. Боцман, Л.Р. Гарифуллина,
, ,
ПРЕВРАЩЕНИЯ ПЕРЕКИСНЫХ ПРОДУКТОВ ОЗОНОЛИЗА ОЛЕФИНОВ В СИСТЕМЕ «МЕТАНОЛ-ВОДА»
Институт органической химии УНЦ РАН, г. Уфа
E-mail: insect@anrb.ru
Представлены результаты превращений перекисных продуктов озонолиза олефинов различной степени замещенности (1) – (4) под действием азотсодержащих органических соединений (гидрохлоридов семикарбазида и гидроксиламина) в системе «метанол-вода».

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 |





