![]() (2)
(2)
![]() (3)
(3)
где V1, V2 – объемные расходы теплоносителей, м3/с; ρ1, ρ2 – плотности теплоносителей, кг/м3; с1, с2 – удельные теплоемкости теплоносителей; t1н, t1к, t2н, t2к – температуры теплоносителей, ºС,
![]() (4)
(4)
где α3 – коэффициент теплообмена свободной конвекцией, Вт/(м2·град);
F – наружная поверхность теплообменника, м2; Δt – разность температур стенки и упругой жидкости, ºС.
Эксперимент проводили для 16 точек различных схем движения теплоносителей (прямоток и противоток) при различных расходах теплоносителей с регистрацией начальной и конечной температур потоков и учетом изменения температуры окружающей среды. В качестве теплоносителей использовались горячая и холодная вода.
В результате проведенных экспериментов, выполнения расчетов и построения графических зависимостей было доказано, что холодный теплоноситель принимает тепло от воздуха, подводимого к наружной поверхности теплообменника за счет свободной конвекции. При этом установлено и доказано, что загрязнение труб оказывает существенное влияние на данный процесс и на величину коэффициента теплопередачи. Это объясняется низким значением тепловой проводимости загрязнений стенок труб и их высоким термическим сопротивлением.
Список литературы:
1 , , Молоканов и аппараты нефтеперерабатывающей и нефтехимической промышленности. – М.: Химия, 1982.-584 с.
2 Зиганшин процессы. Лабораторный практикум по курсу «Процессы и аппараты химической технологии».– Уфа: УГНТУ. 1995.- 33 с.
УДК 547.525.5
,
РАСЧЕТ ЭНЕРГИИ ДЕЛОКАЛИЗАЦИИ БЕНЗОЛА
Уфимский государственный нефтяной технический университет, г. Уфа
Ароматичность ― проявление электронной делокализации в циклических молекулах, что приводит к снижению энергии молекулы и ряду необычных химических и физических свойств. Возможность существования ароматических систем обусловлена тем, что циклическая делокализация π-электронов повышает термодинамическую стабильность молекулы, снижая величину ее внутренней энергии. Мерой энергетической оценки ароматичности служит энергия резонанса Ерез – разница между энергиями ароматической молекулы и молекулы с локализованными связями. В тоже время, ароматическая молекула и молекула с делокализованными связями не являются тождественными понятиями [1, 2] Энергия делокализации не соответствует эмпирической энергии резонанса, так как она основывается на гипотетической модели локализации с геометрией, идентичной геометрии делокализованной системы. Для того чтобы установить соотношение между ними, необходимо от эмпирической энергии резонанса отнять энергию, необходимую для сжатия структуры с чередующимися простыми и кратными связями до структуры с не чередующимися связями:
Ерез = Есж + Едел
где Есж – энергия сжатия структуры;
Едел – энергия делокализация связей.
Эта энергия деформации, рассчитанная для бензола, равна
Есж = –27 ккал/моль (–113 кДж/моль), т. е. весьма существенную величину по сравнению с эмпирической энергией резонанса Ерез = –36÷–38 ккал/моль
(–150,7÷–159,0 кДж/моль) [3], т. е. Едел = –9÷–11 ккал/моль (–37,7÷–46,0 кДж/моль):
Нами проанализировано влияние пиррольных колец сконденсированных с центральным бензольным ядром на ароматичность молекулярной системы. Выявлены структуры, позволяющие оценить разность между энергией резонанса и энергией делокализации. При последовательном увеличении числа пиррольных колец, сконденсированных с молекулой бензола по положению 3, 4 в пирроле, от изоиндола 1 к дипирроло[3,4-e]изоиндолу 2 и
трис(3,4-пирролдиил)у 3, наблюдается выравнивание длин связей в бензольном кольце (рисунок 1) при уменьшении ароматичности бензольного остова (таблица 1) вплоть до ее потери для структуры 3.
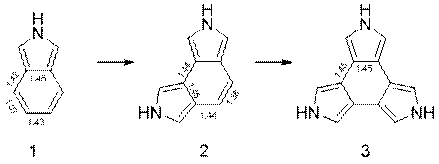
Рисунок 1 – Значения длин связей в молекулах 1, 2, 3
Однако, если рассматривать увеличение числа пиррольных колец, сконденсированных с молекулой бензола по положению 2, 3 в пирроле, ситуация меняется – ароматичность не теряется, а остается практически прежней. В ряду от индола 4 к дипирроло[2,3-e]индолу 5 и трис(2,3-пирролдиил)у 6, как и в первом случае, наблюдается выравнивание длин связей в бензольном кольце (рисунок 2), но с сохранением ароматичности центрального фрагмента на прежнем уровне (таблица 1).
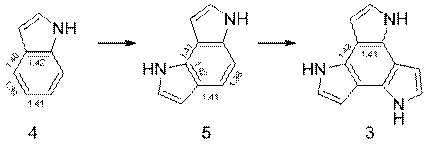
Рисунок 2 –Значения длин связей в молекулах 4, 5, 6
Таблица 1 – Рассчитанные значения критерия NICS (1) для центрального бензольного фрагмента молекул 1 – 6 (B3LYP/6-31G(d, p))
Молекулы | Величина NICS (1) | Молекулы | Величина NICS (1) |
1 | -9,54 | 4 | -11,90 |
2 | -5,69 | 5 | -11,50 |
3 | -2,5 | 6 | -10,40 |
Для бензола NICS (1) = –11,3. Таким образом, ароматичность шестичленного цикла 6 соответствует бензолу, а молекулы 3 – неароматическому шестичленному кольцу с выровненными связями.
Можно предположить, что разности полных энергий изомеров 6 и 3 соответствует энергия делокализации (разница между энергиями резонанса и сжатия связей): Eдел = ΔЕ = Еполн (6) – Еполн (3) = –393430,8 – (–393418,4) = –12,4 ккал/моль (–51,9 кДж/моль). Поскольку, встречающаяся в литературе,
Едел = –9÷–11 ккал/моль (–37,7÷–46,0 кДж/моль), то можно говорить о соответствии полученного нами результата и известного из литературных источников.
Таким образом, нами предложен новый подход к оценке величины энергии делокализации бензола по разностям полных энергий изомеров соединений бензола, сконденсированного с пиррольными кольцами.
Список литературы:
1 Zhongfang Chen, Nucleus-Independent Chemical Shifts (NICS) as an Aromaticity Criterion Chem. Rev. 2005, 105, 3842-3888
2 Кузнецов концепции ароматичности: полиэдрические структуры. Институт общей и неорганической химии им. . Наука 2009.
3 имия гетероциклических соединений: Пер. с англ. – М.: Мир, 1996 г.
УДК 665.7 (088.77)
,
НОВЫЕ ХИММОТОЛОГИЧЕСКИЕ ПОКАЗАТЕЛИ АЛЬТЕРНАТИВНЫХ МОТОРНЫХ ТОПЛИВ
Уфимский государственный нефтяной технический университет, г. Уфа
E-mail: *****@***ru
Для более полной оценки эксплуатационных качеств моторных топлив нами предлагается принципиально новые химмотологические показатели - топливная энергоемкость (Эт, МДж/кгвоз.) и относительный расход топлива (Gотн.). Эт - отношение низшей теплоты сгорания топлива (Qн, МДж/кг) к стехиометрическому (α=1) расходу воздуха (lвоз, кгвоз/кг топл.). Значения Qн и lвоз рассчитываются по данным элементного состава топлива. Поскольку мощности поршневых ДВС принято оценивать по суммарному литражу цилиндров, т. е. по объему расходуемого воздуха, то показатель Эт косвенно характеризует мощностную возможность моторного топлива применительно к двигателям с одинаковыми степенями сжатия [1].
Относительный расход топлива удобнее определить как отношение низшей теплоты сгорания и условного топлива (эквивалента) н.-гептана с Qн=45 МДж/кг i-го топлива. У прямогонных бензинов в зависимости от их фракционного состава Qн составляет около 45 МДж/кг.
Ниже приведена таблица с результатами расчетов Эт и Gотн. некоторых индивидуальных углеводородов и оксигенатов.
Результаты расчета показывают, что у алканов, цикланов и аренов по мере увеличения молярной массы энергоемкость практически остается одинаковой, а относительный расход топлива увеличивается. Низшая теплота сгорания увеличивается по мере снижения мольной доли водорода, но по мере уменьшения мольной доли кислорода у оксигенатов низшая теплота сгорания растет. У оксигенатов по мере увеличения молярной массы энергоемкость остается также одинаковой, а относительный расход топлива уменьшается. Отсюда следует, что применяя биоспирты и биоэфира в качестве топлива или добавки к ним, значительно уменьшается расход топлива.
Таблица - Результаты расчетов химмотологических показателей углеводородов и оксигенатов
Углеводород, оксигенат | М | mc | mН | mo | Qн, МДж /кг | lвоз., кгвоз/кг топл | Эт, МДж/кгвоз. | Gотн. |
Гептан, С7Н16 | 100,2 | 0,8391 | 0,1610 | - | 45,02 | 3,53 | 12,772 | 0,990 |
Октан, С8Н18 | 114,22 | 0,8413 | 0,1589 | - | 44,88 | 3,51 | 12,771 | 1,003 |
Нонан, С9Н20 | 128,26 | 0,8428 | 0,1572 | - | 44,76 | 3,50 | 12,771 | 1,003 |
Декан, С10Н22 | 142,29 | 0,8441 | 0,1559 | - | 44,67 | 3,50 | 12,770 | 1,007 |
Циклогексан, С6Н12 | 84,16 | 0,8563 | 0,1437 | - | 43,83 | 3,43 | 12,767 | 1,027 |
Циклогептан, С7Н14 | 98,19 | 0,8363 | 0,1437 | - | 43,83 | 3,43 | 12,767 | 1,027 |
Бензол, С6Н6 | 78,12 | 0,9225 | 0,0774 | - | 39,25 | 3,08 | 12,745 | 1,126 |
Этилбензол, С8Н10 | 106,17 | 0,9050 | 0,0949 | - | 39,95 | 3,17 | 12,749 | 1,112 |
Пропилбензол, С9Н12 | 120,19 | 0,8994 | 0,1006 | - | 40,46 | 3,20 | 12,773 | 1,101 |
Метанол СН3ОН | 32,04 | 0,9749 | 0,1258 | 0,4994 | 20,22 | 1,50 | 13,421 | 2,224 |
Этанол С2Н5ОН | 46,07 | 0,5214 | 0,1313 | 0,3473 | 27,41 | 2,09 | 13,094 | 1,641 |
Бутанол С4Н9ОН | 74,12 | 0,6482 | 0,1342 | 0,2159 | 33,62 | 2,60 | 12,903 | 1,338 |
Диметиловый эфир | 46,07 | 0,5214 | 0,1360 | 0,3473 | 27,41 | 2,09 | 13,094 | 1,641 |
Диэтиловый эфир | 74,12 | 0,6482 | 0,1360 | 0,2159 | 33,62 | 2,60 | 12,930 | 1,338 |
Дибутиловый эфир | 130,23 | 0,7378 | 0,1393 | 0,1229 | 38,02 | 2,95 | 12,849 | 1,183 |
МТБЭ | 88,15 | 0,6813 | 0,1372 | 0,1815 | 35,25 | 2,73 | 12,898 | 1,276 |
ЭТБЭ | 102 | 0,7065 | 0,1384 | 0,1569 | 36,49 | 2,83 | 12,876 | 1,233 |
Список литературы:

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 |





