УДК 665.7 + 547.281.1 + 546.221.1
1, 2, 1,2
РЕАКЦИЯ ЦИКЛОПЕНТАДИЕНА С ФОРМАЛЬДЕГИДОМ
И СЕРОВОДОРОДОМ
1Башкирский государственный университет, г. Уфа
2Институт нефтехимии и катализа РАН, г. Уфа
E-mail: *****@***ru, *****@***ru
Интерес к получению на основе циклопентадиена различных спиртов и их производных, вызван тем обстоятельством, что последние могут быть мономерами в различных полимерных синтезах, служить модификаторами в композиционных материалах [1]. Между тем, известно [2], что взаимодействие циклопентена и параформа в присутствии соляной кислоты приводит к изомерам 1,3-диоксана 1a, b в соотношении 2 : 1.
В настоящей работе изучено каталитическое взаимодействие циклопентадиена с формальдегидом и сероводородом. Установлено, что реакция циклопентадиена с тиометилирующим реагентом «СН2О-H2S» в присутствии каталитического количества H2SO4 (0,5 ммоль), проходит с разложением целевого продукта 2 до 4.5-бис(гидроксиметил)циклопентан-1.3-диола 3 (76%). А взаимодействие с тиометилирующим реагентом в присутствии 0,5 ммоль BuОNa в н-бутаноле приводит к смеси продуктов – тетраола 3 с выходом 61% и тетрацикло[13.2.1.47.17.49.16.022.26]3,5,11,13-тетраокса-19,21,23,25-тетратиагексакозана 4 (35%). Строение синтезированных соединений установлено на основании спектральных данных и элементного анализа.
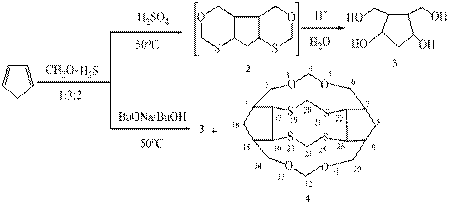
Таким образом, каталитическое взаимодействие циклопентадиена с формальдегидом и сероводородом в присутствии BuОNa приводит к продукту межмолекулярной гетероциклизации 4.
Список литературы:
1 . Фульвены и фульвенилметанолы на основе нефтехимического циклопентадиена и формальдегида //Автореферат на соискание ученой степени к. х.н., Кубанский ун-т. 2001, С. 24.
, , и др. Реакция Принса с циклопентеном и синтез оксиметилциклопентена-2 // Изв. АН СССР. Сер. хим. 1973, С. 1080–1085.
УДК 612.015.161
,
ИЗУЧЕНИЕ БИОХИМИЧЕСКИХ СВОЙСТВ SACCHAROMYCES СEREVISIAE ВКПМ Y-1693 ПРИ ДЛИТЕЛЬНОМ КУЛЬТИВИРОВАНИИ
Бийский технологический институт (филиал) ФГБОУ ВПО
«Алтайский государственный технический университет
им. », г. Бийск
Федеральное государственное бюджетное учреждение науки
Институт проблем химико-энергетических технологий
Сибирского отделения Российской академии наук, г. Бийск
E-mail: *****@***ru
Целью данной работы было изучение биохимических особенностей дрожжей Saccharomyces сerevisiae при длительном культивировании. Штамм Saccharomyces сerevisiae ВКПМ Y-1693 был выделен из ферментера Котласского целлюлозно-бумажного комбината.
Штамм культивировали в течение одного года на двух средах: стерильном солодовом сусле и стерильной дистиллированной воде при температуре 28 ºС. Культивирование проводили в химических пробирках с ватно-марлевыми пробками. С целью исключения возможности инфицирования анализа каждый раз отбиралась одна пробирка. Через год культивирования жидкость в пробирках полностью испарилась, дрожжи были распределены по стенкам.
Содержимое пробирки переносилось в стерильное солодовое сусло с соблюдением правил асептики. После этого проводилось спиртовое брожение в анаэробных условиях при 28 ºС в течение двух суток. Редуцирующие вещества (РВ) в средах определялись спектрофотометрическим методом в пересчете на глюкозу. Крепость бражек (объемная доля спирта) определялась ареометром для спирта в дистилляте, полученном после предварительной перегонки спирта из бражки, согласно ГОСТ Р 51135-98-2003. По крепости полученных бражек и концентрации РВ в исходном сусле был рассчитан выход этанола.
При сбраживании сусла дрожжами, культивированными в течение года на среде солодового сусла, получен выход этанола 93 % от теоретического, а при сбраживании сусла дрожжами, культивированными в течение года на дистиллированной воде, выход этанола составил 96 %. Сравнивая эти данные, можно сделать вывод, что продукты обмена оказывают негативное воздействие на клетки дрожжей и их присутствие в среде более критично, чем отсутствие в среде питательных веществ. В то же время, дрожжи очень жизнеспособны и устойчивы к продуктам своего обмена, их биохимическая активность сохраняется высокой в течение года культивирования в истощенных средах. Эти характеристики предопределяют успешность применения штамма Saccharomyces сerevisiae ВКПМ Y-1693 для сбраживания гидролизатов растительного сырья.
Штамм используется в ИПХЭТ СО РАН для синтеза биоэтанола на средах ферментативных гидролизатов нетрадиционного недревесного растительного сырья.
УДК 634.0.813
ЛЕКТИНЫ RICINUS COMMUNIS КАК ИНСТРУМЕНТ ДЛЯ БОРЬБЫ С ГРИБКОВЫМИ ИНФЕКЦИЯМИ РАСТЕНИЙ
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
Уфимский государственный нефтяной технический университет, г. Уфа
E-mail:baichicli@mail.ru
Лектины – углеводсвязывающие белки-агглютинины, способные обратимо и специфически связывать углеводные остатки различной химической природы [2]. В литературе встречается много информации о рицине – лектине семян клещевины обыкновенной. Однако сведений о лектинах из других органов растения клещевины практически нет, их биохимические свойства до настоящего времени не изучались. Знания биохимических свойств и углеводной специфичности данных лектинов может быть использовано для агглютинации клеток паразитических микроскопических грибов, содержащих в своих клеточных стенках известные углеводные детерминанты.
Лектины экстрагировали ацетатным буфером рН 3,8 из стеблей, листьев, семян, корней, далее определяли концентрацию белка по методу Лоури. Гемагглютинирующую активность лектинов определяли реакцией гемагглютинации с самопроизвольным оседанием эритроцитов I группы крови. Углеводную специфичность определяли методом подавления активности лектина углеводами, выступающими в роли гаптенов. Брали набор гаптенов – моно-, ди-, полисахаридов, в частности хитин из клеточных стенок грибов. Для определения состава и функциональности лектины из различных частей растения клещевины инкубировали с растворами трипсина для разрушения белкового компонента лектина и с KIO4 для разрушения углеводной части [1; 3]. Исчезновение активности рассматривали как доказательство наличия и функциональной активности соответствующей части. Для определения стабильности применяли кипячение раствора лектина, последовательное замораживание и оттаивание при комнатной температуре [4]. При определении количества белка по методу Лоури было выявлено, что в зависимости от исследуемого органа растения клещевины наблюдается различное содержание белка, в том числе лектинов (табл. 1).
Таблица 1 - Содержание лектинов в различных частях Ricinus communis
Часть растения | Показ. ФЭК | V, мл | Показ. графика | Количество белка, мг/мл |
Стебель | 0,17 | 3,5 | 1,17 | 8,2±0,3 |
Семена | 0,57 | 4,5 | 2,87 | 22,9±0,6 |
Листья | 0,45 | 5,5 | 2,315 | 50,9±0,7 |
Корни | 0,85 | 5 | 3,15 | 63±0,7 |
Наибольшее количество белка обнаружено в корнях, что, возможно, можно объяснить тем, что этот орган часто подвергается инфицированию со стороны фитопатогенов, и лектины выполняют в данном органе защитную функцию. Небольшое содержание лектинов выявлено в семенах, это может быть связано с фазой развития растения и сезоном года.
Гемагглютинирующая активность лектинов Ricinus communis к поверхностным углеводам эритроцитов I группы крови оказалась высокой и отличалась по титру: у корней и семян (1:6), стеблей и листьев (1: 3) (рис. 1).

Рисунок 1 - Гемагглютинирующая активность лектинов Ricinus communis:
А–стебли, В–листья, С–корни, D–семена
Высокая гемагглютинирующая активность лектинов корней также может быть причиной того, что данные гликопротеины выполняют защитную функцию в корнях.
Для определения углеводной специфичности использовались лектины корней и листьев. Лектины корней клещевины обыкновенной специфичны к N-ацетилглюкозамину, маннозе, галактозе, а также к хитину. У лектинов листьев выявлена специфичность лишь к маннозе и галактозе. Для определения состава и функциональности брали лектины корней. Инкубация препарата лектина с трипсином приводила к исчезновению его гемагглютинирующей активности, что указывает на наличие в его составе белковой части и ее функциональной необходимости. Кроме того, это свидетельствует о наличии на поверхности молекулы агглютинина лизин-аргининовых детерминант. Агглютинирующая активность пропадала при воздействии на лектин перйодатом калия, окисляющего сахара, но слабо влияющего на белковый компонент, это свидетельствует о наличии и функциональной значимости в составе лектина углеводной части. Полученные данные позволяют заключить, что лектин корней клещевины имеет гликопротеиновую природу, причём как его белковый, так и углеводный компоненты необходимы для проявления гемагглютинирующей активности, что характерно для большинства лектинов.
Высокотемпературная обработка лектина приводила к исчезновению его агглютинирующей активности. Это вызывается диссоциацией лектиновой субъединицы, либо всей молекулы гликопротеина или изменением пространственно-конформационной структуры. Серия последовательных замораживаний и оттаиваний препарата лектина не приводила к исчезновению его агглютинирующей активности.

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 |





