Список литературы:
1 , , . «Синтез и превращения диеновых аддуктов смоляных кислот» // Химия и компьютерное моделирование. Бутлеровские сообщения, 2004, 5(2), 9.
Работа выполнена при финансовой поддержке гранта Президента Российской Федерации для ведущих научных школ № НШ-7014.2012.3, программы фундаментальных исследований Президиума РАН №8П и федеральной целевой программы «Научные и научно-педагогические кадры инновационной России» на 2009-2013 годы – гос. контракт № 14.740.11.0367
УДК 547.972
1,2, 2, 1
СИНТЕЗ 3-О-ЭТИЛОВОГО ЭФИРА
2,3,6,8,5’-ПЕНТАБРОМКВЕРЦЕТИНА
1Башкирский государственный университет, г. Уфа
2Институт органической химии УНЦ РАН, г. Уфа
E-mail: *****@***ru
Кверцетин – биологически активное вещество из группы флавоноидов, которое входит в группу витамина Р. Обладает антиоксидантным, противоопухолевым, гиполипидемическим, иммуномоделирующим эффектом, улучшает клеточный метаболизм, укрепляет сосудистую стенку и снижает ее проницаемость, выявляет антигистаминное действие.
Бромпроизводные кверцетина представляют интерес в качестве новых биологически активных веществ и исходных субстратов для введения новых функциональных групп в ароматическое ядро.
Ранее были изучены реакции кверцетина с бромом в различных условиях с получением 6-моно- и 6,8-дибромпроизводных: бромирование КВ в 50% серной кислотой бромом, выделяемым in situ, при взаимодействии KBr с 30% H2O2, радикальное бромирование N-бромсукцинимидом, электрофильное бромирование кверцетина в диоксане и в уксусной кислоте. Увеличение количества реагента до 3.5 ммоль на 1 ммоль кверцетина, времени реакции и нагревание приводило к увеличению чистоты 6,8-дибромкверцетина и выхода до 82%. Структуры всех полученных соединений подтверждены спектральными методами.
Нами изучена реакция кверцетина с бромом в этиловом спирте. Взаимодействием кверцетина 1 с тремя эквивалентами брома в абсолютном EtOH в присутствии молекулярных сит 4 À при 0-5 °С с последующим выдерживанием реакционной смеси при 20-22 °С в течение 22-24 ч получен 6,8,5'-трибромкверцетин 2, с пятью эквивалентами брома – 3-О-этиловый эфир 2,3,6,8,5’-пентабромдигидрокверцетин 3. Данное соединение получено нами впервые.
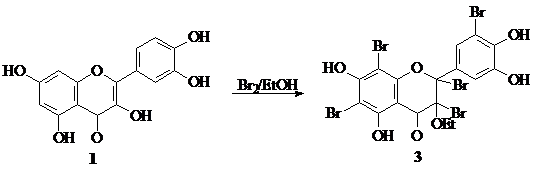
Работа выполнена при поддержке НШ - 7014.2012.3
УДК 547.413
, ,
Исследование влияния ультразвука на синтез акридонуксусной и a-акридонпропионовой кислот и их эфиров
Уфимский государственный нефтяной технический университет, г. Уфа
E-mail: *****@***net
Одной из групп иммуномодулирующих средств цитокининового ряда являются интерфероны, обладающие противовирусной и противоопухолевой активностью. Некоторые производные акридинов проявляют противоопухолевые свойства, в частности, путем ингибирования фермента теломеразы. В настоящее время препараты на основе 9-оксоакридин-10-уксусной кислоты и ее солей предлагаются для лечения и профилактики широкого круга заболеваний в онкологии и гинекологии.
С целью оптимизации условий синтеза и поиска новых физиологически активных соединений, нами исследованы новые подходы к синтезу акридонуксусной, α-акридонпропионовой кислот и их эфиров, а так же изучена возможность интенсификации реакций, лежащих в основе их синтеза, с помощью ультразвука.
Установлено, что при взаимодействии пропилового эфира хлоруксусной (1) и бутилового эфира α-бромпропионовой (2) кислот с акридоном металлированным натрием при температуре 100 оС в ДМСО в течение 6 часов образуются соответствующие алкиловые эфиры акридонуксусной (3) и α-акридонпропионовой (4) кислот с выходами 90% и 93%, соответственно.

При проведении синтеза в ультразвуковом поле необходим отвод тепла, поэтому реакцию осуществляли в ледяной бане. В этих условиях синтез продуктов (3) и (4) завершается через 3.5 часа с выходами 95% и 96%, соответственно.
Кислотно-катализируемый гидролиз полученных эфиров (3, 4) приводит к образованию акридонуксусной (5) и α-акридонпропионовой (6) кислот с выходами 93% и 95%, соответственно.
Строение и чистота полученных соединений подтверждены данными ЯМР 1H, 13C - спектроскопии и хроматомасс-спектрометрии.
УДК 615.322
, ,
НЕКОТОРЫЕ ХИМИЧЕСКИЕ ТРАНСФОРМАЦИИ ХРИЗОФЕНОЛА С
ФГБОУ Башкирский государственный университет, г. Уфа
Институт органической химии УНЦ РАН, г. Уфа
E-mail: *****@***ru
Широкое распространение флавоноидов в растительных организмах и разнообразное биологическое действие обусловливает интерес исследователей к этому классу соединений. Основное внимание ученых направлено на изучение группового состава фенольных соединений различных растений, в то время как публикации по химическим свойствам флавоноидов весьма малочисленны. Флавоноиды относятся к веществам с высокой реакционной способностью, имеющих несколько разноплановых центров: ароматические кольца А и В, гетероциклическое кольцо С и большое число гидроксильных групп (обычно от 3 до 5-6) [1]. В связи с этим становится актуальным поиск путей направленной модификации флавоноидов для изменения или усиления имеющегося биологического действия.
Было показано, что, попадая в организм человека, природные полифенолы претерпевают биодеградацию ферментами ЖКТ, превращаясь в метаболиты. Более того, содержание данных метаболитов в крови и лимфе очень мало. Однако имеются данные о превращении некоторых их ацилпроизводных после прохождения биологических барьеров в исходные флавоноиды [1-4]. Поэтому становится актуальным синтез прекурсоров природных полифенолов с целью увеличения их биодоступности для организма, а именно повышение устойчивости к действию ферментов, проникающей способности и растворимости в биологических жидкостях. Данная задача решается путем введения в молекулу флавоноида сложноэфирных групп, в частности синтезированы полифенолы содержащие остатки аминокислот и другие ацильные группы.
Использование в качестве ацилирующего агента хлорангидрида жирной кислоты позволяет получить сложные эфиры хризофенола С с хорошим выходом. Полученные сложные эфиры разделяли колоночной хроматографией (SiO2, элюэнт этилацетат – хлороформ 3:7). Как оказалось, в случае линолевой кислоты ацилирование условиях протекает с образованием двух продуктов. Ацилирование во всех случаях не затрагивает гидроксил в 5 положении, по-видимому, в связи с тем, что он связан с карбонильной группой при С4 прочной водородной связью и идет неселективно, хотя для олеиновой кислоты получен единственный продукт 6,4’–диолеат с удовлетворительным выходом (36%). Образование сложных эфиров подтверждено ИК - спектрами (сигнал в области 1748-1750 см-1) и данными ЯМР С13 – (сигнал в области 170 м. д.) COOR.

Хризофенол С в силу своей малой растворимости в воде и липидах обладает низкой биодоступностью и способностью проникать через трансдермальные барьеры. Кроме этого известно, что метаболизм флавоноидов осуществляется через стадию этерификации жирными или желчными кислотами и последующим эмульгированием в липидах.
Для сложных эфиров хризофенола и жирных кислот была определена их растворимость в липидах, а также тип образуемой ими эмульсии. Оказалось, что сложные эфиры хризофенола и ненасыщенных жирных кислот хорошо растворимы в масле, бензоле и образуют прямые или обратные эмульсии в зависимости от порядка смешения компонентов. Эфиры стеариновой кислоты практически не растворимы в масле и образуют малоустойчивые эмульсии обратного типа. Результаты измерений сравнивались с контролем. Контролем являлась эмульсионная смесь водной и масляной фазы в соотношении 1:3 без добавления эмульгатора: В результате было установлено, что устойчивость эмульсии эфиров хризофенола С зависит от степени ненасыщенности жирной кислоты. Эфиры хризофенола и олеиновой кислоты образуют более устойчивые эмульсии, по сравнению с эфирами линолевой кислоты.
Список литературы:
1 Manson, M. M.; Farmer, P. B.; Gescher, A.; Steward, W. P. Innovative agents in cancer prevention. Recent Results Cancer Res. 2005, 166, 257-275.
2 Kundu, J. K.; Surh, Y. J. Molecular basis of chemoprevention by resveratrol: NF-kappaB and AP-1 as potential targets. Mutat. Res. 2004, 555, 65-80.
3 Bode, A. M.; Dong, Z. Cancer prevention by food factors through targeting signal transduction pathways. Nutrition 2004, 20, 89-94.
4 Aggarwal, B. B.; Shishodia, S. Molecular targets of dietary agents for prevention and therapy of cancer. Biochem. Pharmacol. 2006, 71, 1397-1421.
УДК 579.66
, ,
ДЕСТРУКЦИЯ 2,4-ДИХЛОРФЕНОКСИУКСУСНОЙ КИСЛОТЫ МИКРООРГАНИЗМАМИ
Федеральное государственное бюджетное учреждение науки Институт биологии Уфимского научного центра РАН, г. Уфа
E-mail: *****@***ru
На сегодняшний день в результате хозяйственной деятельности в биосфере циркулирует большое число различных чужеродных для человека и животных соединений, многие из которых имеют исключительно высокую токсичность. Из органических соединений - загрязнителей выделены "приоритетные", то есть те из них, которые представляют наибольшую опасность для человека сейчас и в будущем. Это прежде всего хлорсодержащие органические соединения, в том числе пестициды, используемые для борьбы с болезнями и вредителями сельского хозяйства. Одним из наиболее широко применяемых галогенсодержащих ароматических соединений является 2,4-дихлорфеноксиуксусная кислота (2,4-Д), на основе которой создан ряд гербицидов для уничтожения сорной растительности [1].

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 |





