95. Критическая температура для СО2 равна 310С. Способ превращения газообразного СО2 в жидкий при температуре 400С (Ркр, Vкр - параметры критического состояния):
1) Сжимать при Р>Ркр; 2) сжимать до V<Vкр; 3) превращение невозможно
98. Изотерма а, приведенная на рис., соответствует температуре (для СО2 критическая температура 310С):
1) 200 С 2) 400 С 3) 310 С 4) 250 С
99. Изотерма b, приведенная на рис., соответствует температуре (для СО2 критическая температура 310С):
1) 200 С 2) 400 С 3) 310 С 4) 500 С
100. Критический объем 1 моля реального газа (b - постоянная Ван-дер-Ваальса):
1) Vкр=b/3 2) Vкр=3b 3) Vкр=RT/P 4) Vкр=Pμ/RT
101. Потенциальная энергия взаимодействия молекул одного моля реального газа не равна (Р′- внутреннее давление газа, а - постоянная Ван-дер-Ваальса):
1) - а /V 2) - a/ V2 3) ∫ρ′dV 4) CV⋅T
102. Внутренняя энергия одного моля реального газа (а - постоянная Ван-дер-Ваальса, Сv-молярная теплоемкость, V - объем моля):
1) СvТ 2) СVТ - а/V2 3) СVТ - а/V 4) - a /V 5) СvT+a/V
103. Изменение внутренней энергии 1 моля реального газа при расширении (а - постоянная Ван-дер-Ваальса):
1) СV(T2-T1)+a![]() 2) СV(T2-T1) 3) a
2) СV(T2-T1) 3) a![]() 4) CV(T1-T2)- a
4) CV(T1-T2)- a![]()
104. Изменение температуры идеального газа при адиабатическом расширении в пустоту:
1) понижается 2) повышается 3) не меняется 4) зависит от плотности газа
105. Изменение температуры реального газа при адиабатическом расширении в пустоту:
1) понижается 2) повышается 3) не меняется 4) зависит от плотности газа
106. Работа при адиабатическом расширении в пустоту идеального газа (а - постоянная Ван-дер-Ваальса):
1) Сv ΔT 2) ![]() 3) 0 4) P(V2-V1)
3) 0 4) P(V2-V1)
107. Работа при адиабатическом расширении реального газа в пустоту
(а - постоянная Ван-дер-Ваальса):
1) Сv ΔT 2) ![]() 3) 0 4) Сv ΔT+
3) 0 4) Сv ΔT+ ![]()
108. Изменение внутренней энергии 1 моля реального газа выражается:
1) Сv(T2-T1)+ ![]() ; 2) Сv(T2-T1) -
; 2) Сv(T2-T1) - ![]() ; 3) Сv(T1-T2)+
; 3) Сv(T1-T2)+ ![]() ; 4) Сv(T2-T1); 5)
; 4) Сv(T2-T1); 5) ![]()
109. Положительный эффект Джоуля-Томсона (понижение температуры) объясняется:
1) взаимным притяжением молекул реального газа
2) влиянием собственного объема молекул
3) адиабатическим расширением газа
4) адиабатическим сжатием газа.
110. Отрицательный эффект Джоуля-Томсона (повышение температуры) объясняется:
1) взаимным притяжением молекул реального газа
2) влиянием собственного объема молекул
3) адиабатическим расширением газа
4) адиабатическим сжатием газа.
Ответы к задачам
§1.
1.1.1)18; 2)44; 3)58,4. 1.2.М=Мrk=98 кг/моль (Мr – относительная молекулярная масса; k=10-3кг/моль) 1.3.1)7,31⋅10-26 кг; 2)9,7⋅10-26 кг. 1.4. р=Мrkv/V=3,2 кг/м3 (Мr – относительная молекулярная масса; k=10-3 кг/моль) 1.5. v=7,14 моль; N=4,3⋅1024 молекул. 1.6. 0,125 моль; 7,52⋅1021 молекул. 1.7. Известно, что молярный объем Vm любого газа при нормальных условиях равен 22,4 л/моль. Поэтому n=V/Vm=0,5 моль; m=Mv=Мrkv=16 г. 1.8. v=pV/M=9,97⋅10-3 моль. 1.9. N=NAV/Vm1,34∙1022 молекул (Vm-молярный объем идеального газа при нормальных условиях; Vm=22,4∙103 м3/моль) 1.10. 1)1,5⋅ 1023 атомов; 2)5,02⋅1022 атомов; 3)3,17⋅1022 атомов; 4)2,87⋅1021 атомов. 1.11. Для определения вида газа найдем его относительную молекулярную массу: Mr=рV/(kv)=28.Следовательно, данный газ - азот. 1.12. ![]() 2,87⋅1020 частиц. 1.13. Пусть жидкость заполняет куб. Число молекул в кубе
2,87⋅1020 частиц. 1.13. Пусть жидкость заполняет куб. Число молекул в кубе ![]() . Число молекул можно выразить также формулой
. Число молекул можно выразить также формулой ![]() . Приравняв правые части (1) и (2) и выразив из полученного равенства диаметр молекулы, найдем
. Приравняв правые части (1) и (2) и выразив из полученного равенства диаметр молекулы, найдем ![]() ; d1=0,464 нм; d2=0,290 нм. 1.14. Диаметр молекулы воды
; d1=0,464 нм; d2=0,290 нм. 1.14. Диаметр молекулы воды ![]() . Среднее расстояние между центрами молекул
. Среднее расстояние между центрами молекул ![]() . Искомое решение:
. Искомое решение: ![]() . 1.15. 1) v=V/Vm= 50 ммоль; Vm=22,4⋅10-3 м3/моль; 2) vмол=v(1-б)=35 ммоль; 3) vat=2vб=30 ммоль; 4) vпол=65 ммоль. 1.16 105 см3. 1.17. 2,5⋅1019 см-3. 1.18. 1,1 МПа. 1.19.
. 1.15. 1) v=V/Vm= 50 ммоль; Vm=22,4⋅10-3 м3/моль; 2) vмол=v(1-б)=35 ммоль; 3) vat=2vб=30 ммоль; 4) vпол=65 ммоль. 1.16 105 см3. 1.17. 2,5⋅1019 см-3. 1.18. 1,1 МПа. 1.19. ![]()
1.20. ![]() 1.21.
1.21. 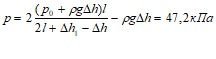
1.22. 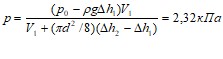 1.23.
1.23. ![]() (Т0=2730С) 1.24. 350 К. 1.25.
(Т0=2730С) 1.24. 350 К. 1.25. ![]() г. 1.26.
г. 1.26. ![]() Н. 1.27.
Н. 1.27. ![]() кН. 1.28.
кН. 1.28. ![]() см3. 1.29. Давление воздуха р в цилиндрическом сосуде до понижения температуры уравнивается атмосферным давлением р0: р0=р1.(1) После понижения температуры атмосферное давление уравнивается суммой двух давлений: р2 воздуха в сосуде и Др, создаваемого столбом воды высотой Дh: p0=p2+Дp=p2+сgДh.(2)
см3. 1.29. Давление воздуха р в цилиндрическом сосуде до понижения температуры уравнивается атмосферным давлением р0: р0=р1.(1) После понижения температуры атмосферное давление уравнивается суммой двух давлений: р2 воздуха в сосуде и Др, создаваемого столбом воды высотой Дh: p0=p2+Дp=p2+сgДh.(2)
Приравняв правые части формул (1) и (2) и выразив р2, найдем
p2=p1-сgДh.(3)
Давление, объем и температура воздуха в цилиндре связаны уравнением газового состояния
![]() , или
, или ![]() . Сократим на S.
. Сократим на S.

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 |





