Изоэнтропийным называется процесс, протекающий при постоянной энтропии (![]() ).
).
В обратимом адиабатическом процессе ![]() , так что
, так что ![]() и
и ![]() , поэтому адиабатический процесс является изоэнтропийным.
, поэтому адиабатический процесс является изоэнтропийным.
Рассмотрим для примера идеальный газ, который совершает равновесный переход из состояния 1 в состояние 2. Изменение его энтропии
![]() .
.
Используя ![]() ;
; ![]() ;
; ![]() и
и ![]() ,
,
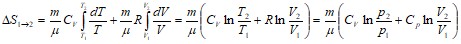 .
.
Изменение энтропии в процессах идеального газа
Изохорный ( | Изобарический ( | Изотермический ( | Адиабатический ( |
|
|
|
|
Статистическое толкование энтропии.
Термодинамическая вероятность W состояния тела и системы – это число способов, которыми может быть реализовано данное конкретное термодинамическое состояние (макросостояние). Иначе говоря, это число всевозможных микрораспределений частиц по координатам и скоростям (микросостояний), которыми может быть осуществлено данное макросостояние.
Формула Больцмана: ![]() ,
,
где ![]() - постоянная Больцмана.
- постоянная Больцмана.
Энтропия системы определяется логарифмом числа микросостояний, с помощью которых может быть реализовано данное макросостояние.
Энтропия является мерой неупорядоченности системы, - чем больше число микросостояний, реализующих данное макросостояние, тем больше энтропия.
Принцип возрастания энтропии.
Все процессы в замкнутой системе ведут к увеличению ее энтропии. В замкнутой системе идут в направлении от менее вероятных состояний к более вероятным, до тех пор, пока вероятность состояния не станет максимальной. В состоянии равновесия – наиболее вероятного состояния системы – число микросостояний максимально, при этом максимальна и энтропия.
Второе начало термодинамики.
Любой необратимый процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает (закон возрастания энтропии).
Первое начало термодинамики выражает закон сохранения и превращения энергии применительно к термодинамическим процессам.
Второе начало термодинамики определяет направление протекания термодинамических процессов, указывая, какие процессы в природе возможны, а какие – нет.
Существуют еще две формулировки второго начала термодинамики, эквивалентных закону возрастания энтропии:
по Кельвину: невозможен круговой процесс, единственным результатом которого является превращение теплоты, полученной от нагревателя, в эквивалентную ей работу.
по Клаузиусу: невозможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому.
Третье начало термодинамики.
|
Третье начало термодинамики – теорема Нернста-Планка – постулирует поведение термодинамических систем при нуле Кельвина (абсолютном нуле): энтропия всех тел в состоянии равновесия стремится к нулю по мере приближения температуры к нулю Кельвина.
Теплоемкости ![]() и
и ![]() при
при ![]() равны нулю, поскольку:
равны нулю, поскольку:
![]() ,
, ![]() ,
, 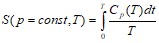 ,
, 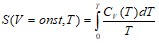
Круговой процесс (цикл).
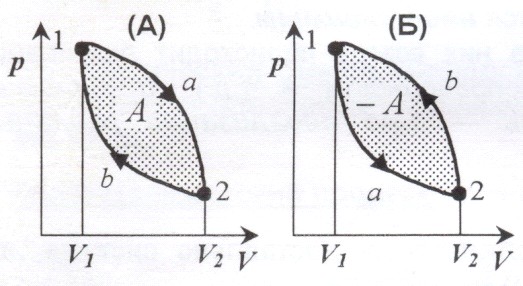
Круговым процессом (или циклом) называется процесс, при котором система, пройдя через ряд состояний, возвращается в исходное состояние. На (p, V)-диаграмме цикл изображается замкнутой кривой, где участок 1-2 соответствует расширению, а 2-1 – сжатию газа.
Работа расширения ![]() (площадь фигуры
(площадь фигуры ![]() ) положительна:
) положительна:![]() .
.
Работа сжатия ![]() (площадь фигуры
(площадь фигуры ![]() ) отрицательна:
) отрицательна: ![]() .
.
Работа за цикл А определяется площадью, охватываемой замкнутой кривой:
![]() .
.
Таким образом, работа – это функция не только состояния термодинамической системы, но и вида процесса, который происходит. Поэтому работа не является однозначной функцией состояния (такой, как внутренняя энергия). Из первого начала термодинамики следует, что теплота Q, также как и работа А, является функцией процесса, который происходит с системой.
Цикл называется прямым, если за цикл совершается положительная работа ![]() (цикл протекает по часовой стрелке – рисунок (А)).
(цикл протекает по часовой стрелке – рисунок (А)).
Цикл называется обратным, если за цикл совершается отрицательная работа ![]() (цикл протекает против часовой стрелки – рисунок (Б)).
(цикл протекает против часовой стрелки – рисунок (Б)).
Прямой цикл используется в тепловых двигателях (совершают работу за счет полученной извне теплоты). Обратный цикл используется в холодильных машинах (за счет работы внешних сил теплота переносится к телу с более высокой температурой).
КПД кругового процесса.
В результате кругового процесса система возвращается в исходное состояние, полное изменение внутренней энергии равно нулю. Поэтому ![]() , т. е. работа, совершаемая за цикл, равна количеству полученной извне теплоты. Если в ходе кругового процесса система не только получает количество теплоты
, т. е. работа, совершаемая за цикл, равна количеству полученной извне теплоты. Если в ходе кругового процесса система не только получает количество теплоты ![]() , но и теряет (отдает) количество теплоты
, но и теряет (отдает) количество теплоты ![]() , то
, то ![]() .
.
Термический коэффициент полезного действия для кругового процесса – это величина, равная отношению работы, совершенной системой, к количеству теплоты, полученному в этом цикле системой:
![]() .
.
Обратимый и необратимый процессы.
Термодинамический процесс называется обратимым, если он может происходить как в прямом, так и в обратном направлении. Причем, если такой процесс происходит сначала в прямом, а затем в обратном направлении и система возвращается в исходное состояние, то в окружающей среде и в этой системе не происходит никаких изменений. Всякий процесс, не удовлетворяющий этим условиям, является необратимым.
Реальные процессы необратимы, в них всегда происходит диссипация (потеря) энергии (из-за трения, теплопроводности и т. д.). Обратимые процессы – это физическая модель – это идеализация реальных процессов.

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 |





