По закону Дальтона:
р=р1+р2
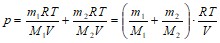 .
.
Найдем молярную массу смеси газов по формуле:
![]()
Где число молей гелия и водорода соответственно. Число молей газов найдем по формуле:
![]()
![]()
Получим: 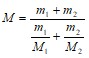 .
.
![]() Па.
Па.
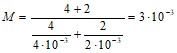 кг/моль
кг/моль
Пример 13. В закрытом сосуде емкостью 3 м3 находится m1=1,4 кг азота и m2=2 кг гелия. Определить температуру газовой смеси и парциальное давление гелия, если парциальное давление азота равно p1=1,3⋅105 Па.
Решение. Парциальное давление гелия и температура газовой смеси определяются из уравнения Менделеева-Клапейрона:
![]() и
и ![]()
Находим температуру:
![]() ,
,
Потом можно определить парциальное давление гелия:
![]() .
.
Подставим все величины в формулы:
![]() К;
К; ![]() Па.
Па.
Молекулярное строение вещества.
1.1. Определить относительную молекулярную массу Mr: 1) воды; 2) углекислого газа СО2; 3) поваренной соли NaCl.
1.2. Найти молярную массу М серной кислоты H2SO4.
1.3. Определить массу m1 молекулы: 1) углекислого газа; 2) поваренной соли.
1.4. В сосуде вместимостью V=2 л находится кислород, количество вещества v которого равно 0,2 моль. Определить плотность с газа.
1.5. Определить количество вещества v и число N молекул азота массой m=0,2 кг.
1.6. В баллоне вместимостью V=3л находится кислород массой m=4 г. Определить количество вещества v и число N молекул газа.
1.7. Кислород при нормальных условиях заполняет сосуд вместимостью V=11,2 л. Определить количество вещества v газа и его массу m.
1.8. Определить количество вещества v водорода, заполняющего сосуд вместимостью V=3 л, если плотность газа с=6,65⋅10-3 кг/моль.
1.9. Колба вместимостью V=0,5 л содержит газ при нормальных условиях. Определить число N молекул газа, находящихся в колбе.
1.10. Сколько атомов содержится в газах массой 1 г каждый:
1) гелии, 2) углероде, 3) фторе, 4) полонии?
1.11. В сосуде вместимостью V=5л находится однородный газ количеством вещества v=0,2 моль. Определить, какой это газ, если его плотность с=1,12 кг/м3.
1.12. Одна треть молекул азота массой m=10 г распалась на атомы. Определить полное число N частиц, находящихся в газе.
1.13. Рассматривая молекулы жидкости как шарики, соприкасающиеся друг с другом, оценить порядок размера диаметра молекулы сероуглерода CS2. При тех же предположениях оценить порядок размера диаметра атомов ртути. Плотности жидкостей считать известными.
1.14. Определить среднее расстояние <l> между центрами молекул водяных паров при нормальных условиях и сравнить его с диаметром d самих молекул (d=0,311 нм).
1.15. В сосуде вместимостью V=1,12 л находится азот при нормальных условиях. Часть молекул газа при нагревании до некоторой температуры оказалась диссоциированной на атомы. Степень диссоциации α=0,3. Определить количество вещества: 1) v — азота до нагревания; 2) vмол—молекулярного азота после нагревания;
3) vат — атомарного азота после нагревания: 4) vпол — всего азота после нагревания.
Примечание. Степенью диссоциации называют отношение числа молекул, распавшихся на атомы, к общему числу молекул газа. Степень диссоциации показывает, какая часть молекул распалась на атомы.
1.16. Современные вакуумные насосы позволяют получать давление p=4⋅10-15 атм. Считая, что газом является азот при комнатной температуре, найти число молекул в 1см3.
1.17. Воздух в аудитории находится при нормальных условиях. Найти число его молекул в 1см3.
1.18. Определить давление, при котором 1 см3 газа содержит N=2,4⋅1026 молекул. Температура газа 00 С.
Уравнение газового состояния.
1.19. В цилиндр длиной l=1,6 м, заполненный воздухом при нормальном атмосферном давлении p0, начали медленно вдвигать поршень площадью 5=200 см2. Определить силу F, которая будет действовать на поршень, если его остановить на расстоянии li=10 см от дна цилиндра.
1.20. Колба вместимостью V=300 см3, закрытая пробкой с краном, содержит разреженный воздух. Для измерения давления в колбе горлышко колбы погрузили в воду на незначительную глубину и открыли кран, в результате чего в колбу вошла вода массой m=292 г. Определить первоначальное давление p в колбе, если атмосферное давление p0=100 кПа.
1.21. В U-образный манометр налита ртуть. Открытое колено манометра соединено с окружающим пространством при нормальном атмосферном давлении ρ0, и ртуть в открытом колене стоит выше, чем в закрытом, на Δh=10 см. При этом свободная от ртути часть трубки закрытого колена имеет длину l=20 см. Когда открытое колено присоединили к баллону с воздухом, разность уровней ртути увеличилась и достигла значения Δh1=26 см. Найти давление ρ воздуха в баллоне.
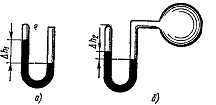
1.22. Манометр в виде стеклянной U-образной трубки с внутренним диаметром d=5 мм (рис. а) наполнен ртутью так, что оставшийся в закрытом колене трубки воздух занимает при нормальном атмосферном давлении объем V1==10 мм3. При этом разность уровней Δh1 ртути в обоих коленах трубки равна 10 см. При соединении открытого конца трубки с большим сосудом (рис. б) разность Δh2 уровней ртути уменьшилась до 1 см. Определить давление ρ в сосуде.
1.23. В баллоне содержится газ при температуре t1= 100°С. До какой температуры t2 нужно нагреть газ, чтобы его давление увеличилось в два раза?
1.24. При нагревании идеального газа на ΔТ=1 К при постоянном давлении объем его увеличился на 1/350 первоначального объема. Найти начальную температуру T газа.
1.25. Полый шар вместимостью V=10 см3, заполненный воздухом при температуре T1=573 К, соединили трубкой с чашкой, заполненной ртутью. Определить массу m ртути, вошедшей в шар при остывании воздуха в нем до температуры Т2=293 К. Изменением вместимости шара пренебречь.
1.26. Оболочка воздушного шара вместимостью V=800 м3 целиком заполнена водородом при температуре T1=273 К. На сколько изменится подъемная сила шара при повышении температуры до Т2=293 К? Считать вместимость V оболочки неизменной и внешнее давление нормальным. В нижней части оболочки имеется отверстие, через которое водород может выходить в окружающее пространство.
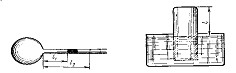
1.27. В оболочке сферического аэростата находится газ объемом V=1500 м3, заполняющий оболочку лишь частично. На сколько изменится подъемная сила аэростата, если газ в аэростате нагреть от Т0 =273 К до T=293 К? Давления газа в оболочке и окружающего воздуха постоянны и равны нормальному атмосферному давлению.
1.28. Газовый термометр состоит из шара с припаянной к нему горизонтальной стеклянной трубкой. Капелька ртути, помещенная в трубку, отделяет объем шара от внешнего пространства (рис. 8.2). Площадь S поперечного сечения трубки равна 0,1 см2. При температуре T1=273 К капелька находилась на расстоянии l1=30 см от поверхности шара, при температуре Т2=278 К — на расстоянии l2=50 см. Найти вместимость V шара.
1.29. В большой сосуд с водой был опрокинут цилиндрический сосуд (рис. 8.3). Уровни воды внутри и вне цилиндрического сосуда находятся на одинаковой высоте. Расстояние l от уровня воды до дна опрокинутого сосуда равно 40 см. На какую высоту Δh поднимется вода в цилиндрическом сосуде при понижении температуры от T1=310 К до Т2=273 К? Атмосферное давление нормальное.
1.30. Баллон вместимостью V=12 л содержит углекислый газ. Давление p газа равно 1 МПа, температура Т=300 К. Определить массу m газа в баллоне.
1.31. Какой объем V занимает идеальный газ, содержащий количество вещества v=l кмоль при давлении p=1 МПа и температуре T=400 К?
1.32. Котел вместимостью V=2 м3 содержит перегретый водяной пар массой m=10 кг при температуре T=500 К. Определить давление p пара в котле.
1.33. Баллон вместимостью V=20 л содержит углекислый газ массой m=500 г под давлением p=1,3 МПа. Определить температуру Т газа.
1.34. Газ при температуре Т=309 К и давлении p=0,7 МПа имеет плотность ρ=12 кг/м3. Определить относительную молекулярную массу Mr газа.
1.35. Определить плотность ρ насыщенного водяного пара в воздухе при температуре Г=300 К. Давление р насыщенного водяного пара при этой температуре равно 3,55 кПа.
1.36. Оболочка воздушного шара имеет вместимость V=1600 м3. Найти подъемную силу F водорода, наполняющего оболочку, на высоте, где давление p=60 кПа и температура T=280 К. При подъеме шара водород может выходить через отверстие в нижней части шара.
1.37. В баллоне вместимостью V=25 л находится водород при температуре T=290 К. После того как часть водорода израсходовали, давление в баллоне понизилось на Δp=0,4 МПа. Определить массу m израсходованного водорода.
1.38. Оболочка аэростата вместимостью V=1600 м3, находящегося на поверхности Земли, на k=7/8 наполнена водородом при давлении p1=100 кПа и температуре T=290 К. Аэростат подняли на некоторую высоту, где давление p2==80 кПа и температура Т2=280 К. Определить массу Δm водорода, вышедшего из оболочки при его подъеме.

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 |





