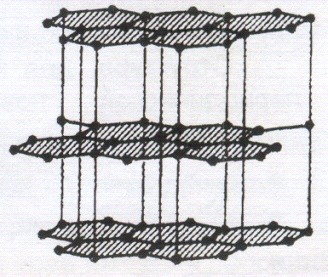
Пример атомных кристаллов – алмаз и графит.
В алмазе каждый атом углерода связан с четырьмя такими же атомами, которые располагаются на одинаковых расстояниях от него в вершинах тетраэдра. В графите атомы углерода упакованы в плоские слои, связанные между собой слабыми ван-дер-ваальсовыми силами.
Металлические кристаллы. В узлах кристаллической решетки располагаются положительные ионы металла. При образовании кристаллической решетки валентные электроны, слабо связанные с атомами, отделяются от атомов и коллективизируются: они уже принадлежат не одному атому, как в случае ионной связи, и не паре соседних атомов, как в случае ковалентной связи, а всему кристаллу в целом.
Молекулярные кристаллы. В узлах кристаллической решетки располагаются нейтральные молекулы вещества, силы взаимодействия между которыми обусловлены незначительным взаимным смещением электронов в электронных оболочках атомов. Эти силы называются ван-дер-ваальсовыми, так как они имеют ту же природу, что и силы притяжения между молекулами, приводящими к отклонению газов от идеальности. Примеры молекулярных кристаллов – органические соединения (например, парафин), инертные газы (Ne, Ar, Kr, Xe) и атмосферные газы CO2, O2, N2 в твердом состоянии, лед и т. д.
Дефекты в кристаллах.
Дефектами кристаллической решетки называются отклонения от упорядоченного расположения частиц в узлах решетки. Дефекты делятся на макроскопические,
возникающие в процессе образования и роста кристаллов (например, трещины, поры, инородные макроскопические включения), и микроскопические, обусловленные микроскопическими отклонениями от периодичности.
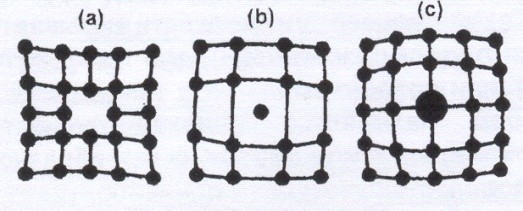
Микродефекты делятся на точечные и линейные. Точечные дефекты бывают трех типов: 1) вакансия – отсутствие атома в узле кристаллической решетки (а); 2) междоузельный атом – атом, внедрившийся в междоузельное пространство (b); 3) примесный атом – атом примеси, либо замещающий атом основного вещества в кристаллической решетке (примесь замещения (c)), либо внедрившийся в междоузельное пространство (примесь внедрения). Точечные дефекты нарушают только ближний порядок в кристаллах.
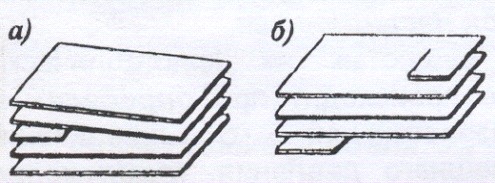
Линейные дефекты нарушают дальний порядок. Особое место среди линейных дефектов занимают дислокации – линейные дефекты, нарушающие правильное чередование атомных плоскостей. Различают краевые (край атомной плоскости, обрывающейся в кристалле (а)) и винтовые (атомные плоскости образуют винтовую поверхность (б)) дислокации.
Теплоемкость твердых тел.
Рассмотрим идеальную кристаллическую решетку, в узлах которой частицы, принимаемые за материальные точки, колеблются вблизи положений равновесия в трех взаимно перпендикулярных направлениях (три колебательные степени свободы, каждая из которых обладает энергией kT).
Внутренняя энергия моля твердого тела ![]() , где
, где ![]() - число Авогадро, R – молярная газовая постоянная.
- число Авогадро, R – молярная газовая постоянная.
Молярная теплоемкость твердого тела:
![]() - закон Дюлонга и Пти –
- закон Дюлонга и Пти –
молярная теплоемкость химически простых тел в кристаллическом состоянии одинакова (равна 3R) и не зависит от температуры.
Если твердое тело является химическим соединением (например, NaCl), то число частиц в моле равно ![]() , где n – число атомов в молекуле (для NaCl число частиц в моле равно
, где n – число атомов в молекуле (для NaCl число частиц в моле равно ![]() , поскольку в одном моле NaCl содержится
, поскольку в одном моле NaCl содержится ![]() атомов Na и
атомов Na и ![]() атомов Cl).
атомов Cl).
Молярная теплоемкость твердых химических соединений
![]() ,
,
т. е. равна сумме атомных теплоемкостей элементов, составляющих эти соединения.
Отклонения от закона Дюлонга и Пти (особенно при низких температурах) объясняются исходя из квантовых представлений.
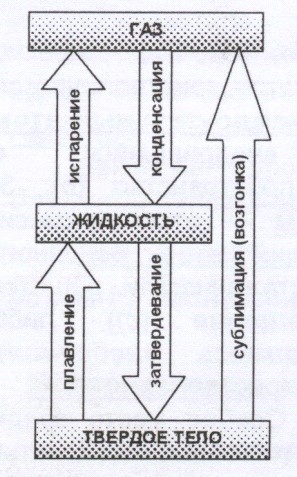
Изменение агрегатного состояния.
И в жидкостях и в твердых телах всегда есть некоторое число молекул, энергия которых достаточна для преодоления притяжения к другим молекулам, и которые способны покинуть поверхность жидкости или твердого тела. Такой процесс для жидкости называется испарением (или парообразованием), для твердых тел – сублимацией (или возгонкой).
Конденсацией называется переход вещества вследствие его охлаждения или сжатия из газообразного состояния в жидкое.
Если число молекул, покидающих жидкость за единицу времени через единичную поверхность, равно числу молекул, переходящих из пара в жидкость, то наступает динамическое равновесие м2жду процессами испарения и конденсации. Пар, находящийся в равновесии со своей жидкостью, называется насыщенным.
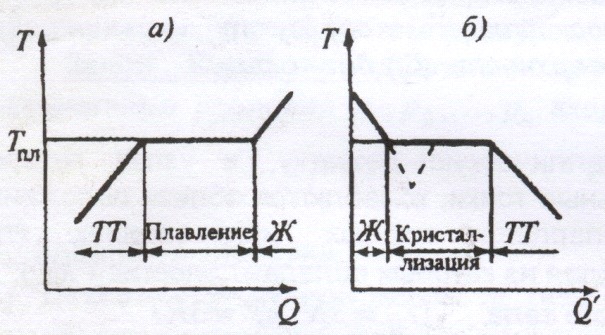
Плавлением называется переход вещества из кристаллического (твердого) состояния в жидкое. Плавление происходит при определенной, возрастающей с увеличением внешнего давления, температуре плавления ![]() .
.
В процессе плавления теплота Q, сообщаемая веществу, идет на совершение работы по разрушению кристаллической решетки, и поэтому ![]() (рис (а)) до расплавления всего кристалла.
(рис (а)) до расплавления всего кристалла.
Количество теплоты L, необходимое для расплавления 1 кг вещества, называется удельной теплотой плавления.
Если жидкость охлаждать, то процесс пойдет в обратном направлении (рис (б), ![]() - количество теплоты, отдаваемое телом при кристаллизации): сначала температура жидкости понижается, затем при постоянной температуре, равной
- количество теплоты, отдаваемое телом при кристаллизации): сначала температура жидкости понижается, затем при постоянной температуре, равной ![]() , начинается кристаллизация.
, начинается кристаллизация.
Для кристаллизации вещества необходимо наличие центров кристаллизации – кристаллических зародышей, которыми могут быть как кристаллики образующего вещества, так и любые инородные включения. Если в чистой жидкости нет центров кристаллизации, то она может быть охлаждена до температуры, меньшей температуры кристаллизации, образуя при этом переохлажденную жидкость (рис (б) – пунктир).
Аморфные тела являются переохлажденными жидкостями.
Фазовые переходы.
Фазой называется термодинамически равновесное состояние вещества, отличающееся по физическим свойствам от других возможных равновесных состояний того же вещества.
Переход вещества из одной фазы в другую – фазовый переход – всегда связан с качественными изменениями свойств вещества.
Фазовый переход первого рода – это переход, сопровождающийся поглощением или выделением теплоты (например, плавление, кристаллизация). Он характеризуется постоянством температуры, изменениями энтропии и объема.
Фазовый переход второго рода – переход не связанный с поглощением или выделением теплоты и изменением объема. Он характеризуется постоянством объема и энтропии, но скачкообразным изменением теплоемкости.
Фазовые переходы второго рода связаны с изменением симметрии: выше точки перехода система обладает более высокой симметрией, чем ниже точки перехода.
Примеры фазовых переходов второго рода: переход ферромагнитных веществ при определенных давлениях и температуре в парамагнитное состояние; переход металлов и сплавов при низких температурах в сверхпроводящее состояние; превращение обыкновенного жидкого гелия в сверхтекучий.
Диаграмма состояния.
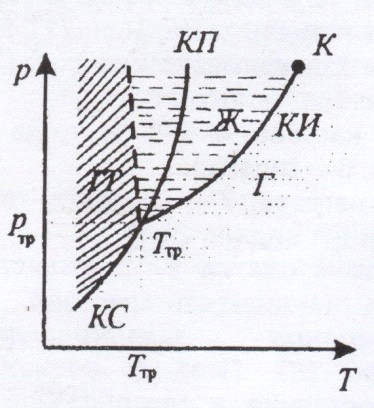
Если система является однокомпонентной, т. е. состоящей из химически однородного вещества или его соединения, то понятие фазы совпадает с понятием агрегатного состояния.
Для наглядного изображения фазовых превращений используется диаграмма состояния, на которой в координатах (p, Т) задается зависимость между температурой фазового перехода и давлением в виде кривых испарения (КИ), плавления (КП) и сублимации (КС), разделяющих поле диаграммы на три области, соответствующие условиям существования твердой (ТТ), жидкой (Ж) и газообразной (Г) фаз.
Кривые на диаграмме называются кривыми фазового равновесия, каждая точка на них соответствует условиям равновесия двух сосуществующих фаз.
Тройной точкой называется точка, в которой пересекаются кривые фазового равновесия и которая, следовательно, определяет условия (температуру ![]() и давление
и давление ![]() ) одновременного равновесного сосуществования трех фаз вещества.
) одновременного равновесного сосуществования трех фаз вещества.

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 |





