РЕАЛЬНЫЕ ГАЗЫ. ЖИДКОСТИ
При рассмотрении реальных газов необходимо учитывать собственный объем молекул и силы межмолекулярного взаимодействия.
Силы межмолекулярного взаимодействия – короткодействующие – они проявляются на расстоянии менее 10-9 м. Сила взаимодействия молекул – это равнодействующая сил притяжения ![]() (они преобладают на больших расстояниях). На расстоянии
(они преобладают на больших расстояниях). На расстоянии ![]() эти силы уравновешивают друг друга и
эти силы уравновешивают друг друга и ![]() . Таким образом, расстояние
. Таким образом, расстояние ![]() - это равновесное расстояние между молекулами, на котором бы они находились в отсутствие теплового движения. Потенциальная энергия взаимодействия молекул U минимальна в состоянии устойчивого равновесия при
- это равновесное расстояние между молекулами, на котором бы они находились в отсутствие теплового движения. Потенциальная энергия взаимодействия молекул U минимальна в состоянии устойчивого равновесия при ![]() .
.
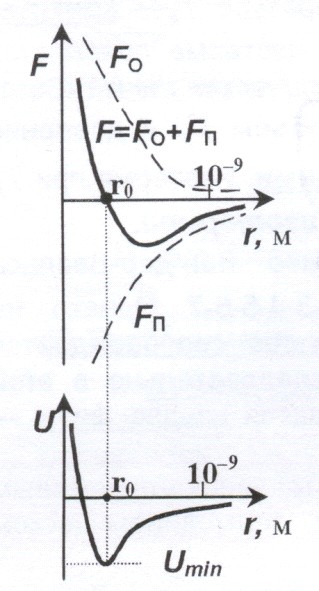
Соотношение между ![]() и kT является критерием различных агрегатных состояний.
и kT является критерием различных агрегатных состояний. ![]() определяет работу, которую нужно совершить против сил притяжения, чтобы разъединить молекулы, находящиеся в равновесии (
определяет работу, которую нужно совершить против сил притяжения, чтобы разъединить молекулы, находящиеся в равновесии (![]() ). kT определяет удвоенную среднюю энергию, приходящуюся на одну степень свободы теплового движения молекул.
). kT определяет удвоенную среднюю энергию, приходящуюся на одну степень свободы теплового движения молекул.
При ![]() вещество находится в газообразном состоянии, т. к. тепловое движение молекул препятствует соединению (конденсации) молекул.
вещество находится в газообразном состоянии, т. к. тепловое движение молекул препятствует соединению (конденсации) молекул.
При ![]() вещество находится в твердом состоянии, т. к. тепловой энергии недостаточно, чтобы «оторвать» молекулы друг от друга.
вещество находится в твердом состоянии, т. к. тепловой энергии недостаточно, чтобы «оторвать» молекулы друг от друга.
При ![]() вещество находится в жидком состоянии, т. к. в результате теплового движения молекулы перемещаются в пространстве, обмениваясь местами, но не расходясь на расстояния, превышающие
вещество находится в жидком состоянии, т. к. в результате теплового движения молекулы перемещаются в пространстве, обмениваясь местами, но не расходясь на расстояния, превышающие ![]() .
.
Уравнение Ван-дер-Ваальса.
Внесем в уравнение состояния идеального газа ![]() поправки, учитывающие собственный объем молекул и силы межмолекулярного взаимодействия.
поправки, учитывающие собственный объем молекул и силы межмолекулярного взаимодействия.
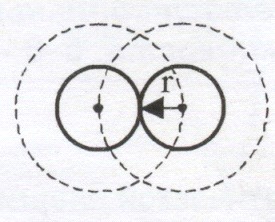
Фактический объем реального газа будет ![]() , где b – объем, занимаемый самими молекулами. Две молекулы радиуса r не могут сблизиться на расстояние меньше 2r, следовательно, для центров двух молекул недоступен сферический объем радиуса 2r. Этот объем b в восемь раз больше объема одной молекулы и в расчете на одну молекулу равен учетверенному объему молекулы.
, где b – объем, занимаемый самими молекулами. Две молекулы радиуса r не могут сблизиться на расстояние меньше 2r, следовательно, для центров двух молекул недоступен сферический объем радиуса 2r. Этот объем b в восемь раз больше объема одной молекулы и в расчете на одну молекулу равен учетверенному объему молекулы.
Учет сил межмолекулярного притяжения осуществляется введением дополнительного давления ![]() на газ, называемого внутренним давлением:
на газ, называемого внутренним давлением: ![]() , где a – постоянная Ван-дер-Ваальса.
, где a – постоянная Ван-дер-Ваальса.
Уравнение Ван-дер-Ваальса для моля газа – уравнение состояния реальных газов: ![]() . Для произвольной массы газов:
. Для произвольной массы газов:
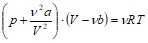 , где
, где ![]() ,
, ![]() .
.
Изотермы реальных газов.
Изотерма реального газа представляет собой зависимость молярного объема газа от давления при постоянной температуре.
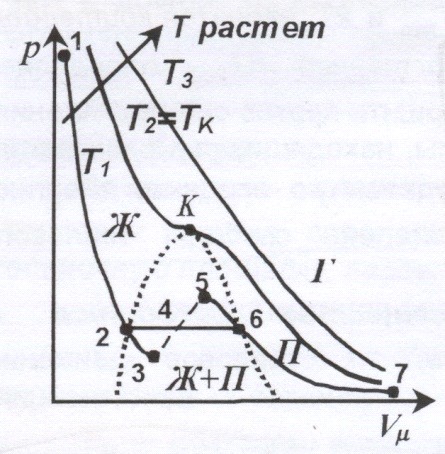
При высоких температурах (![]() ) изотерма реального газа отличается от изотермы идеального газа только некоторым искажением формы.
) изотерма реального газа отличается от изотермы идеального газа только некоторым искажением формы.
При некоторой температуре ![]() - критической температуре – на изотерме появляется точка перегиба К – критическая точка. Соответствующие этой точке объем
- критической температуре – на изотерме появляется точка перегиба К – критическая точка. Соответствующие этой точке объем ![]() и давление
и давление ![]() называются критическими. Изотерма при
называются критическими. Изотерма при ![]() называется критической изотермой.
называется критической изотермой.
При ![]() уравнению Ван-дер-Ваальса соответствует кривая 1-2-3-4-5-6-7. Однако, на участке 5-3 сжатие вещества сопровождается уменьшением давления, следовательно в этой области вещество распадается на две фазы – жидкость и пар.
уравнению Ван-дер-Ваальса соответствует кривая 1-2-3-4-5-6-7. Однако, на участке 5-3 сжатие вещества сопровождается уменьшением давления, следовательно в этой области вещество распадается на две фазы – жидкость и пар.
Фаза – совокупность всех частей системы, обладающих одинаковым химическим составом и находящихся в одинаковом термодинамическом состоянии.
Истинные докритические изотермы реального газа имеют вид 1-2-6-7 и являются кривыми непрерывного перехода вещества из газообразного состояния (Г) (участок 6-7) в жидкое (Ж) (участок 2-1). Участок 6-2 соответствует равновесному сосуществованию жидкости и газа.
Вещество в газообразном состоянии при температуре ниже критической называется паром (П), а пар, находящийся в равновесии со своей жидкостью, называется насыщенным (Ж + П). Пар при изотермическом сжатии претерпевает процесс сжижения. Газ, при температурах ![]() , не может быть превращен в жидкость ни при каком давлении (Г).
, не может быть превращен в жидкость ни при каком давлении (Г).
При некоторых условиях могут быть реализованы метастабильные состояния 5-6 и 2-3. Участок 2-3 изображает перегретую жидкость, 5-6 – пересыщенный пар.
Внутренняя энергия реального газа.
Внутренняя энергия реального газа складывается из кинетической энергии теплового движения молекул (![]() ) и потенциальной энергии межмолекулярного взаимодействия (
) и потенциальной энергии межмолекулярного взаимодействия (![]() ):
): ![]() .
.
Если газ расширяется без теплообмена с окружающей средой (адиабатически, т. е. ![]() ) и не совершает работы (так называемое расширение газа в вакуум, т. е.
) и не совершает работы (так называемое расширение газа в вакуум, т. е. ![]() ), из первого начала термодинамики (
), из первого начала термодинамики (![]() ) следует, что:
) следует, что: ![]() .
.
При адиабатическом расширении без совершения внутренней работы внешняя энергия газа не меняется.
Для идеального газа это означает ![]() (температура не изменяется).
(температура не изменяется).
Для реального газа ![]() , поэтому
, поэтому 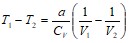 .
.
Реальный газ при адиабатическом расширении в вакууме охлаждается.
Жидкости и их описание.
Жидкость является агрегатным состоянием вещества, промежуточным между газообразным и твердым. В газах нет закономерности во взаимном расположении молекул (хаотическое расположение). В твердых телах наблюдается дальний порядок – молекулы образуют кристаллическую решетку. В жидкостях дальний порядок отсутствует, а имеет место ближний порядок в расположении молекул – их упорядоченное расположение повторяется на расстояниях, сравнимых с межатомными. Тепловое движение молекулы в жидкости это ее колебание около определенного положения равновесия в течение некоторого времени, после чего молекула скачком переходит в новое положение, отстоящее от исходного на расстояние порядка межатомного.
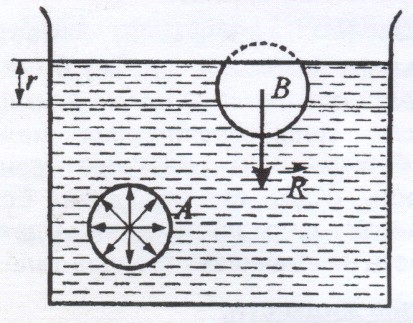
Радиус r молекулярного действия – расстояние (порядка 10-9 м), при котором можно пренебречь силами притяжения между молекулами жидкости. Сфера радиусом r называется сферой молекулярного действия.
Силы, действующие на молекулу А внутри объема жидкости со стороны окружающих молекул, в среднем скомпенсированы. Для молекулы В, расположенной на поверхности, равнодействующая сил ![]() направлена внутрь жидкости. Результирующие силы всех молекул поверхностного слоя оказывают на жидкость молекулярное (внутреннее) давление.
направлена внутрь жидкости. Результирующие силы всех молекул поверхностного слоя оказывают на жидкость молекулярное (внутреннее) давление.

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 |





