Дело в том, что внутренняя энергия системы является однозначной функцией состояния системы. Отсюда следует, что при совершении системой произвольного процесса, в результате которого она вновь возвращается в исходное состояние, полное изменение внутренней энергии системы равно нулю (![]() ). Ни работа, ни теплота не являются функциями состояния системы.
). Ни работа, ни теплота не являются функциями состояния системы.
Все величины, входящие в первое начало термодинамики могут быть как положительными, так и отрицательными.
Если к системе подводится теплота то ![]() > 0; если от системы отводится теплота, то
> 0; если от системы отводится теплота, то ![]() < 0.
< 0.
Если система совершает работу над внешними телами, то ![]() > 0, если же над системой внешние силы совершают работу, то
> 0, если же над системой внешние силы совершают работу, то ![]() < 0.
< 0.
Другая формулировка первого начала термодинамики связана с тем, что если система периодически возвращается в первоначальное состояние, и, следовательно ![]() , то A = Q, т. е. вечный двигатель первого рода – периодически действующих двигатель, который совершал бы бульшую работу, чем сообщенная ему извне энергия – невозможен.
, то A = Q, т. е. вечный двигатель первого рода – периодически действующих двигатель, который совершал бы бульшую работу, чем сообщенная ему извне энергия – невозможен.
Работа газа при его расширении.
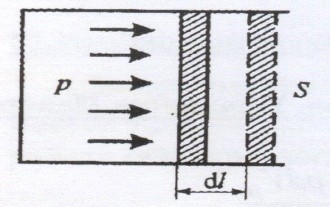
Если находящийся под поршнем в цилиндрическом сосуде, газ, расширяясь, передвигает поршень на расстояние dl, то производит над ним работу ![]() , где S – площадь поршня.
, где S – площадь поршня.
Полная работа A, совершаемая газом при изменении его объема от ![]() до
до ![]() :
:
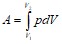 .
.
Равновесные процессы – это процессы, состоящие из последовательности равновесных состояний. Они протекают так, что изменение термодинамических параметров за конечный промежуток времени бесконечно мало. Все реальные процессы неравновесны, но в ряде случаев (достаточно медленные процессы) неравновесностью реальных процессов модно пренебречь.
Равновесные процессы можно изображать графически в координатах (p, V). Так как работа ![]() определяется площадью заштрихованной полоски, а полная работа – площадью кривой между
определяется площадью заштрихованной полоски, а полная работа – площадью кривой между ![]() и
и ![]() .
.
При неравновесных процессах значения параметров в разных частях системы различны и не существует (p, V)-точек, характеризующих состояние всей системы. Поэтому графическое изображение неравновесного процесса невозможно.
ИЗОПРОЦЕССЫ.
Рассмотрим равновесные процессы, происходящие с термодинамическими системами, при которых один из основных параметров состояния сохраняется постоянным.
Изохорный процесс (![]() ).
).
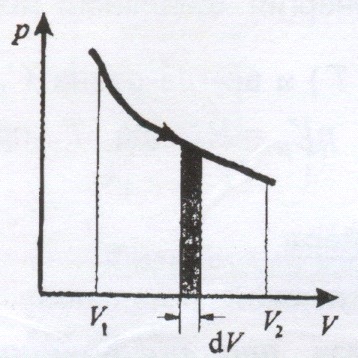
Диаграмма этого процесса – изохора – в координатах (p, V) изображается прямой,
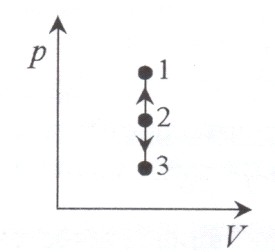
параллельной оси ординат (ось p). Процесс 2-1 – изохорный нагрев, процесс 2-3 – изохорное охлаждение.
При изохорном процессе газ не совершает работу над внешними телами (![]() ) и вся теплота, сообщаемая газу, идет на увеличение его внутренней энергии (
) и вся теплота, сообщаемая газу, идет на увеличение его внутренней энергии (![]() ). Поскольку
). Поскольку ![]() , то для произвольной массы газа:
, то для произвольной массы газа:
![]() .
.
Изобарный процесс (p=const).
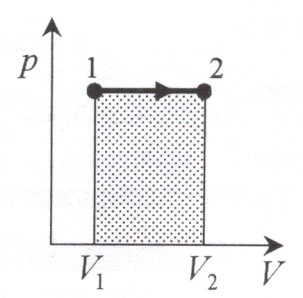
Диаграмма этого процесса – изобара – в координатах (p, V) изображается прямо параллельной оси абсцисс (ось V). При изобарном процессе работа газа при увеличении объема от ![]() до
до ![]() равна:
равна:
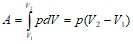
и определяется площадью заштрихованного прямоугольника. Используя уравнение Клайперона ![]() , получаем
, получаем ![]() , отсюда
, отсюда
![]() .
.
Физический смысл универсальной газовой постоянной: К численно равна работе изобарного расширения 1 моля идеального газа при нагревании его на 1 К.
Изотермический процесс (![]() ).
).
Диаграмма этого процесса – изотерма – в координатах (p, V) представляет собой
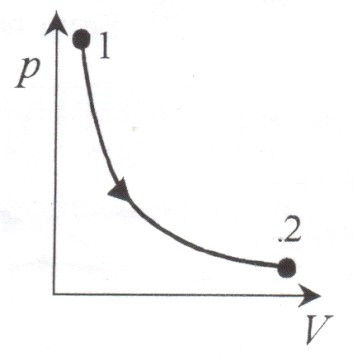
гиперболу. Изотермический процесс описывается законом Бойля-Мариотта (![]() ).
).
Работа изотермического расширения газа:
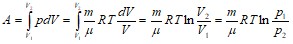 .
.
Так как при ![]() внутренняя энергия идеального газа не изменяется, то из первого начала термодинамики следует, что
внутренняя энергия идеального газа не изменяется, то из первого начала термодинамики следует, что ![]() , то есть все количество теплоты, сообщаемое газу, расходуется на совершение им работы против внешних сил.
, то есть все количество теплоты, сообщаемое газу, расходуется на совершение им работы против внешних сил.
Поэтому, для того, чтобы при расширении газа температура не понижалась, к газу в течение изотермического процесса необходимо подводить количество теплоты, эквивалентное внешней работе расширения.
Адиабатический процесс (![]() ).
).
Адиабатическим называется процесс, при котором отсутствует теплообмен между системой и окружающей средой (![]() ).
).
К адиабатическим процессам можно отнести все быстропротекающие процессы (теплообмен не успевает совершиться), например, распространение звука в среде, циклы расширения и сжатия в двигателях внутреннего сгорания, в холодильных установках и т. д.
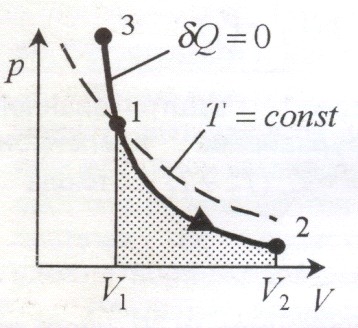
Из первого начала термодинамики следует, что при адиабатическом процессе ![]() . Используя
. Используя ![]() и
и ![]() , получим
, получим ![]() (1). С другой стороны, из
(1). С другой стороны, из ![]() следует
следует ![]() (2). Разделив (2) на (1) получим:
(2). Разделив (2) на (1) получим:
![]() или
или ![]() ,
,
|
где ![]() - коэффициент Пуассона. Интегрирование этого уравнения дает
- коэффициент Пуассона. Интегрирование этого уравнения дает ![]() , откуда следует уравнение Пуассона – уравнение адиабатического процесса.
, откуда следует уравнение Пуассона – уравнение адиабатического процесса.
Используя уравнение Менделеева-Клайперона ![]() , получаем:
, получаем:
![]() ,
, ![]() .
.
Диаграмма адиабатического процесса – адиабата – в координатах (p, V) изображается гиперболой. Адиабата (![]() ) более крута, чем изотерма (
) более крута, чем изотерма (![]() ). Это объясняется тем, что при адиабатическом сжатии 1-3 увеличение давления газа обусловлено не только уменьшением его объема, но и повышением температуры.
). Это объясняется тем, что при адиабатическом сжатии 1-3 увеличение давления газа обусловлено не только уменьшением его объема, но и повышением температуры.

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 |





