Лечение. Современная терапия ММ включает цитостатические средства (химиопрепараты, лучевое лечение), кортикостероидные и анаболические гормоны, восстановительные методы, а также комплекс мер, устраняющих или предупреждающих метаболические нарушения и проявления вторичного иммунодефицита.
Если заболевание диагностируется рано (I, частично II стадия болезни), то при отсутствии клинической симптоматики, нормальных показателях крови (СОЭ не принимается в расчет) и функции почек противоопухолевую терапию начинать не следует; показана выжидательная тактика с ежемесячным контролем крови, мочи и уровней секреции монокло-нального парапротеина. У части таких больных имеется «тлеющая» ММ, которая в течение нескольких лет не прогрессирует и не нуждается в терапии.
Однако при появлении симптомов нарастания опухолевой массы (снижение гемоглобина и эритроцитов, повышение уровня парапротеина в крови или моче, появлении сильных болей в костях) следует начинать лечение.
При проведении цитостатической химиотерапии следует придерживаться определенных принципов:
• подбор цитостатического препарата осуществляется с учетом стадии
болезни (величины опухолевой массы) и критериев риска;
• оценка эффективности лечения должна проводиться по определен
ным критериям:
1) снижение концентрации парапротеина в сыворотке крови более
чем на 50 %;
2) снижение экскреции белка Бене-Джонса более чем на 50 %;
3) появление рентгенологических признаков заживления костных
деструкции;
4) уменьшение площади пораженных опухолью костей;
• непрерывное лечение с соблюдением доз и интервалов в течение 2
лет (не менее).
Используют комбинацию цитостатического препарата — мелфалана (алкерана) с преднизолоном. Существуют различные подходы к назначению этих препаратов.
У больных с III стадией болезни при отсутствии явных признаков «агрессивности» (медленно прогрессирующая ММ) проводят пролонгированную терапию с поддерживающим лечением ударными прерывистыми курсами. Мелфалан сочетается с преднизолоном, одновременно назначают
441
анаболические стероиды (неробол, ретаболил). Через 4 нед назначают поддерживающую терапию меньшими дозами используемых препаратов.
Еще один вариант «пролонгированной терапии» — применение вин-кристина в сочетании с мелфаланом и преднизолоном, возможно также использование циклофосфана и преднизолона.
Другая методика — «ударная прерывистая терапия» — рекомендуется больным с медленно прогрессирующей ММ I и II стадий. Применяют более короткие курсы лечения теми же препаратами — мелфаланом (или циклофосфаном) в сочетании с преднизолоном.
При быстропрогрессирующей ММ с симптомами, указывающими на плохой прогноз, и резистентностью к ранее проводимой терапии, проводят полихимиотерапию. В течение 3 — 4 нед назначают комбинацию винкрис-тина, циклофосфана, мелфалана и преднизолона.
У молодых больных с резистентностью к терапии и соматической сохранностью применяют так называемую интенсивную терапию.
«Интенсивная терапия» включает использование высоких доз мелфалана в сочетании с трансплантацией костного мозга и тотальным облучением тела.
В лечении ММ применяют также сс-интерферон (сс-ИФН), который не имеет самостоятельного значения в терапии ММ, но его назначение рационально вместе с химиотерапией, а также в перерывах между курсами; а-ИФН подавляет пролиферацию клона опухолевых клеток.
Лечение считается эффективным только у тех больных, которые имеют стабильные или улучшающиеся показатели красной крови, сывороточного альбумина, у которых не нарастают размеры остеодеструктивных очагов. Эти критерии существенно важны, так как ориентация на уровень снижения парапротеина не всегда верна — прямая зависимость между опухолевой массой и уровнем секреции парапротеина может быть весьма различной. Эффект лечения оценивается через 3 мес от его начала. При отсутствии признаков улучшения больные относятся к прогностически весьма неблагоприятным — так называемым нереагирующим.
Локальная лучевая терапия показана во всех случаях угрозы патологических переломов (позвоночник, крестцово-подвздошная область, бедренные, берцовые кости), даже при отсутствии болевого синдрома. Локальное облучение используется при наличии ограниченных опухолевых узлов в костях и мягких тканях, радикулярных болях, связанных со сдав-лением корешков спинного мозга опухолью. Сочетать лучевое лечение и химиотерапию не рекомендуется.
При инфекционных осложнениях рекомендуется применять антибиотики, не обладающие нефротоксичностью. При выраженной протеинемии и парапротеинемии следует использовать плазмаферез. При поражении костной ткани (переломы и пр.) необходимо назначать комплекс средств, улучшающих костную репарацию (миокальцик внутримышечно, оксиде-вит и пероральные препараты кальция). При переломах костей проводят иммобилизацию, вытяжение на щите (особенно при компрессионных переломах позвоночника).
Прогноз. Современная комбинированная терапия увеличивает продолжительность жизни больных. Удается восстановить активность больных и поддерживать их удовлетворительное состояние. Гибель больных наступает вследствие хронической почечной недостаточности или инфекционных осложнений.
442
АНЕМИИ
Анемия — состояние, характеризующееся уменьшением гемоглобина в единице объема крови за счет снижения его общего количества в организме. В большинстве случаев анемия сопровождается и снижением концентрации эритроцитов в единице объема крови, за исключением отдельных видов анемии (железодефицитная анемия, талассемия). От истинной анемии следует отличать гидремию — разжижение крови за счет тканевой жидкости.
В основе развития анемии лежат различные патологические процессы, в связи с чем все анемии следует разделять с патофизиологической точки зрения на следующие группы (классификация анемий, предложенная в 1985 г. , представлена в несколько сокращенном и упрощенном виде):
1) острые постгеморрагические;
2) железодефицитные;
3) связанные с нарушением синтеза или утилизации порфиринов (си-
дероахрестические);
4) связанные с нарушением синтеза РНК и ДНК (мегалобластные);
5) гемолитические;
6) связанные с нарушением пролиферации клеток костного мозга.
Каждый из указанных патогенетических вариантов анемических состояний имеет различную этиологию (например, железодефицитная анемия может наблюдаться при мено-, метроррагиях, кровотечениях из пищеварительного тракта, при беременности, нарушении всасывания железа и др.). Однако в ряде случаев самый тщательный диагностический поиск не может выявить лежащее в основе анемии заболевание; тогда следует говорить об идиопатической форме анемии. Поэтому при обследовании больного с предполагаемой анемией необходимо: 1) определить патогенетический вариант анемии; 2) выявить заболевание, лежащее в основе имеющейся у больного анемии.
Проявления анемий чрезвычайно разнообразны и определяются: 1) патогенетическим вариантом анемии; 2) этиологией; 3) изменениями в организме, обусловленными реакцией организма на гипоксию тканей, вызванную нарушением дыхательной функции крови (доставка кислорода тканям) — циркуляторно-гипоксическим синдромом. Этот синдром проявляется слабостью, повышенной утомляемостью, одышкой при физической нагрузке, сердцебиениями, «анемическим» шумом в крупных сосудах, увеличением объема циркулирующей крови, ускорением кровотока. Цир-куляторно-гипоксический синдром наблюдается в большей или меньшей степени при всех видах анемических состояний; выраженность его зависит от степени гипоксии тканей, что в свою очередь определяется кислородной емкостью крови (иначе говоря, выраженностью анемического состояния).
ЖЕЛЕЗОДЕФИЦИТНАЯ АНЕМИЯ
Сущность железодефицитной анемии (ЖДА) состоит в нехватке железа в организме (истощение запасов железа в органах-депо), вследствие чего нарушается синтез гемоглобина, отчего каждый эритроцит со-
443
держит меньшее, чем в норме, количество гемоглобина. ЖДА встречаются чаще всех остальных форм анемий, что объясняется множеством обстоятельств, ведущих к дефициту железа в организме.
Этиология. Выделяют основные причины дефицита железа:
• Кровотечения: а) маточные (дисфункция яичников, фибромиома
матки, рак шейки матки, эндометриоз и др.); б) желудочно-кишеч
ные (язвенная болезнь, геморрой, рак, диафрагмальная грыжа, не
специфический язвенный колит, полипоз); в) легочные (рак, брон-
хоэктазы, изолированный легочный гемосидероз).
• Повышенный расход железа: а) беременность, лактация; б) период
роста и полового созревания; в) хронические инфекции, опухоли.
• Нарушение всасывания железа: а) резекция желудка; б) энтерит,
спру.
• Нарушение транспорта железа.
• Врожденный дефицит железа (этот механизм возможен при ЖДА у
матери во время беременности).
Из перечисленных причин следует, что ЖДА чаще развивается у женщин в результате обильных маточных кровотечений, повторных беременностей, а также у подростков.
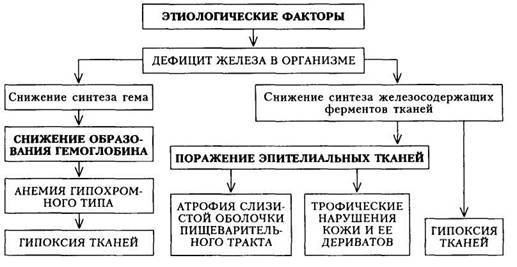
Патогенез. ЖДА возникает прежде всего в результате нарушения синтеза гемоглобина, так как железо входит в состав гема. Недостаточное образование гемоглобина служит причиной гипоксии тканей и развития циркуляторно-гипоксического синдрома. Дефицит железа способствует также нарушению синтеза тканевых ферментов, что приводит к изменению тканевого метаболизма. При этом прежде всего поражаются быстро обновляющиеся эпителиальные ткани — слизистая оболочка пищеварительного тракта, кожа и ее дериваты. Патогенез ЖДА представлен на схеме 25.
Клиническая картина. Проявление болезни, как это вытекает из схемы патогенеза, складывается из следующих синдромов:
1) циркуляторно-гипоксического (при достаточной выраженности
анемии и кислородного голодания тканей);
2) поражения эпителиальных тканей (гастроэнтерологические рас
стройства, трофические нарушения кожи и ее дериватов);
3) гематологического (анемия гипохромного типа и признаки дефици
та железа).
Кроме этих синдромов, клиническая картина определяется также заболеванием, на основе которого развилась ЖДА (например, язвенная болезнь желудка или двенадцатиперстной кишки с повторными кровотечениями, мено - и метроррагии, какая-либо хроническая инфекция и пр.). Имеет значение стадия течения:
1) скрытого дефицита железа, проявляющегося снижением уровня
сывороточного железа при отсутствии уменьшения содержания гемогло
бина;
2) тканевый сидеропенический синдром (проявляется гастроэнтеро
логическими расстройствами, трофическими изменениями кожи и ее дери
ватов);
3) анемия (снижение уровня гемоглобина).
444
|
Схема 25. Патогенез железодефицитной анемии |
На I этапе диагностического поиска при достаточно выраженной анемии можно выявить жалобы на слабость, шум в ушах, сердцебиение, одышку при физической нагрузке, ноющие боли в области сердца (проявления циркуляторно-гипоксического синдрома). Очень своеобразны проявления гастроэнтерологических расстройств в виде извращения вкуса, обоняния, снижения и извращения аппетита (желание есть мел, сухие макароны, зубной порошок), отмечаются затруднение при глотании, неопределенные болевые ощущения в эпигастрии. Нередко больные отмечают субфебрильную температуру тела.
При умеренно выраженной анемии и дефиците железа все указанные жалобы могут быть выражены незначительно или отсутствовать. В анамнезе таких больных — сведения о случайном обнаружении снижения уровня гемоглобина (например, во время профилактического осмотра). Больные могут предъявлять разнообразные жалобы, а также сообщать те или иные сведения о фоновом заболевании (или состоянии), обусловившем появление дефицита железа и последующей анемии.
На II этапе диагностического поиска следует активно искать симптомы поражения эпителиальной ткани и трофических расстройств кожи и ее дериватов (волосы, ногти). Так, можно обнаружить сглаженность сосочков языка, сухость и шелушение кожных покровов, ломкость ногтей, сухость и выпадение волос. Циркуляторно-гипоксический синдром проявляется тахикардией, систолическим шумом над верхушкой сердца, на крупных сосудах (при этом тоны сердца не изменены); на яремных венах может прослушиваться шум «волчка». Кожные покровы и слизистые оболочки обычно бледные; размеры селезенки, как правило, нормальные. Умеренное ее увеличение встречается обычно у тех больных, которым проводили многочисленные гемотрансфузии.
На III этапе диагностического поиска проводят исследования, результаты которых подтверждают не только наличие и выраженность анемии, но также ее патогенетический вариант (обусловленность дефицитом железа).
445
При исследовании периферической крови выявляют сниженный уровень гемоглобина, микроцитоз (увеличение количества эритроцитов малого диаметра) и гипохромию эритроцитов, снижение цветового показателя, среднего содержания гемоглобина в эритроците (весовое и процентное). Содержание ретикулоцитов в норме или повышено. Изменяются показатели обмена железа: снижается содержание свободного железа в сыворотке крови и насыщение трансферрина железом; повышается ОЖСС (общая железосвязывающая способность сыворотки — общий трансферрин). Это связано с тем, что в организме снижено содержание железа. Для изучения резервов железа в организме применяется десфераловая проба. В норме взрослый человек теряет 0,6—1,3 мг железа с мочой после введения 500 мг десферала; при ЖДА содержание железа в моче после введения десферала значительно ниже (0,2 — 0,4 мг), что указывает на снижение запасов железа в организме. Десферал — продукт метаболизма актиноми-цетов, способный связывать железо. Известное представление о снижении запасов железа в организме можно получить, изучая всасывание радиоактивного железа. При ЖДА всасывание радиоактивного железа повышается.
В костном мозге при ЖДА отмечается уменьшение количества сиде-робластов — эритрокариоцитов, содержащих железо (как известно, в норме 20 — 40 % эритрокариоцитов костного мозга содержат единичные гранулы железа). В ряде случаев гранулы выявить не удается.
При исследовании пищеварительного тракта достаточно часто выявляют снижение желудочной секреции (базальной и стимулированной), а также атрофические изменения слизистой оболочки пищевода и желудка.
При выраженном гипоксически-циркуляторном синдроме могут наблюдаться признаки поражения миокарда (миокардиодистрофия вследствие анемии) в виде умеренного расширения сердца (определяется при рентгенологическом исследовании) и изменений конечной части ЭКГ (снижение амплитуды или негативизации зубцов Т, преимущественно в грудных отведениях).
Диагностика. При постановке диагноза ЖДА выделяют два этапа:
1) доказательство дефицита железа в организме (как причины анемии);
2) выявление причин железодефицитного состояния.
Критериями дефицита железа и анемии являются: гемоглобин ниже 120 г/л у мужчин и ниже 116 г/л у женщин, снижение цветового показателя (ниже 0,86), среднего содержания гемоглобина в эритроцитах (24 пг), средней концентрации гемоглобина в эритроцитах (ниже 30 %), повышение количества микроцитов (эритроцитов диаметром менее 6 мкм) более 20 %, снижение сывороточного железа — менее 11,6 мкмоль/л; повышение свободного трансферрина — более 35,8 мкмоль/л и общего трансферрина (ОЖСС) — более 71,6 мкмоль/л; снижение насыщения трансферрина железом (менее 25 %); повышение всасывания радиоактивности железа; положительная десфераловая проба (уменьшение содержания железа в моче после введения десферала).
Чтобы установить причину железодефицитного состояния, прежде всего необходимо найти источник кровотечения. Для этого наряду с тщательным клиническим исследованием необходимо проведение эндоскопических (эзофагогастродуоденоскопия, ректоромано - и колоноскопия, бронхоскопия) и других методов исследования. Женщин обязательно должен осмотреть гинеколог.
446
Обнаружить скрытые (оккультные) кровотечения очень трудно. Если не удалось выявить источник кровотечения, то применяют пробу с введением больному его собственных эритроцитов, предварительно меченных 51Сг, а в последующем определяют радиоактивность кала. Высокая радиоактивность свидетельствует об источнике кровотечения в пищеварительном тракте.
При хронических инфекциях важное значение имеет определение уровня свободного трансферрина сыворотки (латентная железосвязываю-щая способность сыворотки), который в отличие от постгеморрагических анемий остается нормальным.
Дифференциальная диагностика. ЖДА следует отличать от сидеро-ахрестической анемии и талассемии (один из видов наследственной гемолитической анемии). При сидероахрестической анемии вследствие генетического или приобретенного нарушения обмена порфиринов железо не поступает в эритроидные клетки. В результате этого развивается анемия с резким снижением цветового показателя при повышенном содержании железа сыворотки. В костном мозге — раздражение красного ростка, повышенное содержание эритроидных клеток с включением железа. Терапия препаратами железа при сидероахрестической анемии безуспешна.
При талассемии (более подробно см. «Гемолитические анемии») отмечается умеренное снижение гемоглобина при значительном снижении цветового показателя, уровень сывороточного железа повышен. Характерно наличие мишеневидных эритроцитов. Одновременно выявляются все признаки гемолитического синдрома.
Формулировка развернутого клинического диагноза ЖДА учитывает следующие компоненты: 1) определение характера анемии (в данном случае железодефицитная); 2) указание этиологии заболевания; 3) определение стадии процесса (ремиссия — рецидив; рецидив может характеризоваться скрытым дефицитом железа).
Лечение. Воздействуют на этиологические факторы (удаление источника кровотечения, борьба с инфекцией, противоопухолевая терапия, профилактика врожденного дефицита железа) и проводят патогенетическую терапию (ликвидация дефицита железа, при резких расстройствах гемодинамики — борьба с ними).
Диета больных ЖДА должна содержать продукты, богатые железом, однако следует учитывать не только содержание железа в том или ином продукте, но и степень всасывания из него железа. Наибольшее количество железа содержится в мясных продуктах (говядина, телятина). Содержащееся в них так называемое гемовое железо всасывается на 25 — 30 %. Всасывание железа из рыбы ниже (до 10 %), из растительных продуктов — всего 3 — 5 %. Таким образом, ликвидация дефицита железа осуществляется приемом лекарственных препаратов железа внутрь (или парентерально). Необходимо, чтобы суточная доза двухвалентного железа (всасывается только двухвалентное железо) составляет 100 — 300 мг. В связи с этим при выборе препарата железа и определении его суточной дозы необходимо ориентироваться не только на общее содержание в нем железа, но и на количество двухвалентного железа. Естественно, что предпочтительнее назначать препараты с высоким содержанием двухвалентного железа в связи с удобством приема для больных (1—2 раза в сутки). Входящие в состав многих лекарственных форм аскорбиновая и янтарная кислоты, фруктоза, цистеин усиливают всасывание железа. Для лучшей всасываемости препараты железа следует принимать до еды.
447
Основное положение терапии железом - длительное лечение и в достаточных дозах. Только при этом можно получить стойкий результат. Достаточно давно применяется препарат ферроплекс — драже, содержащее двухвалентное железо и аскорбиновую кислоту; применять следует 15-20 драже в сутки. В настоящее время появились препараты железа, содержащие двухвалентное железо в существенно большем количестве, что позволяет обойтись одно-двукратным приемом препарата. Феррогра-думет, сорбифор дурулес принимают по 1—2 таблетки в день, тардифе-рон — по 2 таблетки в день, конферон — по 1 —2 капсулы (3 раза в день), актиферрин — по 1 капсуле 2 — 3 раза в день или в виде сиропа (1 чайная ложка на 12 кг массы тела); сироп нельзя назначать больным сахарным диабетом, так как в сиропе содержится много сахара. Представляет интерес препарат, в котором железо находится в микродиализных капсулах — фенюльс, что обеспечивает постоянство скорости высвобождения железа в течение суток (обеспечивается постоянство плазменной концентрации препарата). Для парентерального лечения используют феррум-лек, ферби-тол, эктофер. Феррум-лек для внутримышечного введения выпускается в ампулах по 2 мл, содержащих 100 мг железа (это соединение окиси трехвалентного железа с полиизомальтозой), а для внутривенного введения — по 5 мл, в которых также содержится 100 мг железа (но это коллоидный раствор, в котором железо связано с натрий-сахаратным комплексом).
При назначении препаратов железа в достаточной дозе на 7 —10-й день после начала терапии наблюдается увеличение количества ретикуло-цитов в периферической крови (ретикулоцитарный криз). Прирост уровня гемоглобина начинается через 3 — 4 нед после начала лечения, однако в ряде случаев это может произойти на 6 —8-й неделе. Лечение следует проводить не менее 3 мес. По достижении ремиссии у больных с продолжающимися кровотечениями (например, при меноррагиях) следует рекомендовать поддерживающую терапию тем же препаратом (ежемесячно по 7 — 10 дней).
У ряда больных приходится применять парентеральные препараты железа; показаниями являются:
• тошнота, рвота (непереносимость препаратов железа при приеме
внутрь, что не позволяет продолжать дальнейшее лечение);
• нарушение всасывания при патологии кишечника (энтериты, резек
ция тонкого кишечника, синдром недостаточного всасывания);
• нежелательность назначения внутрь препаратов железа больным с
патологией желудочно-кишечного тракта (обострение язвенной бо
лезни желудка или двенадцатиперстной кишки, болезнь Крона, не
специфический язвенный колит);
• необходимость более быстрого насыщения организма железом (осо
бенно в ситуациях, когда планируется оперативное вмешательство
по тому или иному поводу).
При аллергических реакциях на парентеральное введение препаратов железа и непереносимости пероральнои терапии следует проводить трансфузии эритроцитной массы. Переливание крови быстро увеличивает содержание гемоглобина, но утилизация при этом значительно ограничена. Кроме того, имеется опасность заражения больных инфекционным мононуклеозом, сывороточным гепатитом и др. В связи с этим гемотрансфузии проводят лишь по жизненным показаниям (при подготов-
448
ке к оперативному вмешательству, выраженных гемодинамических нарушениях, связанных с анемией). В последнем случае следует стремиться не к нормализации уровня гемоглобина путем гемотрансфузий, а к улучшению общего состояния больного.
Прогноз. Ликвидация причины потери крови, а также систематическая ферротерапия приводят к полному выздоровлению. У лиц с обильными маточными кровопотерями необходимо систематически контролировать уровень гемоглобина (таких больных ставят на диспансерный учет).
Профилактика. Лица, подверженные опасности дефицита железа (недоношенные дети, дети от многоплодной беременности, девушки в период полового созревания при быстром росте, женщины с обильными менструациями, беременные) должны употреблять пищу с достаточным содержанием железа (прежде всего говядину). У них следует периодически исследовать кровь для выявления скрытого дефицита железа и анемии.
СИДЕРОАХРЕСТИЧЕСКАЯ АНЕМИЯ
Сидероахрестическая анемия (САА) — железонасыщенная или сидеробластная анемия, при которой эритроциты содержат мало железа (гипохромны) вследствие неиспользования его костным мозгом для синтеза гемоглобина.
Этиология и патогенез. В основе развития сидероахрестических анемий лежит нарушение синтеза гема. Железо, белок, необходимые для синтеза гемоглобина, имеются, однако отсутствует достаточное количество протопорфирина. Вследствие этого не осуществляется синтез гема — основного компонента молекулы гемоглобина. Гем — соединение порфири-новых колец (протопорфирина) с атомом железа. Гем, соединяясь с глобином, образует молекулу гемоглобина.
При САА уменьшается образование порфиринов и возникает избыток железа. Уменьшение образования порфиринов обусловлено врожденным или приобретенным дефицитом ряда ферментов. Накопление железа в организме приводит к отложению его во внутренних органах.
Выделяют две основные наследственные формы САА: пиридоксинза-висимую (имеется дефицит пиридоксаль-фосфата, поэтому назначение пи-ридоксина — витамина Be — дает эффект) и пиридоксинрезистентную (этачформа встречается крайне редко).
Приобретенные формы чаще наблюдаются в пожилом возрасте, заболевание не носит семейного характера. Непосредственный ферментный дефект не всегда ясен. САА чаще возникает при лечении туберкулостатичес-кими препаратами вследствие истощения запасов пиридоксаль-фосфата, при свинцовой интоксикации. Могут быть также идиопатические формы САА.
Клиническая картина. При наследственных формах заболевание начинается уже в раннем детстве. На I этапе диагностического поиска выявляются жалобы, обусловленные гипоксически-циркуляторным синдромом. В анамнезе — указания на бледность, слабость, увеличение печени и селезенки. Дети быстро устают, плохо учатся, у них плохая память; у взрослых — слабость, снижение толерантности к физической нагрузке, возникающие после длительного лечения основного заболевания (туберкулеза), профессиональных вредностей (контакт со свинцом). Можно обна-
449
1
ружить сведения о выявлении низких показателей гемоглобина и неуспешном лечении препаратами железа.
На II этапе диагностического поиска в периоды обострения возможно выявление бледности кожных покровов и видимых слизистых оболочек, у части больных — увеличение печени и селезенки в умеренных пределах. В связи с этим у таких больных предполагают хроническое заболевание печени (чаще всего хронический гепатит).
Отложение железа во внутренних органах может привести к ряду своеобразных симптомов. Так, отложение железа в поджелудочной железе ведет к сахарному диабету, в печени — к циррозу печени, в сердце — к сердечной недостаточности, в половых железах — к евнухоидизму.
Для постановки диагноза основным является III этап диагностического поиска. Лабораторные исследования выявляют снижение гемоглобина в сочетании с низким цветовым показателем, ретикулоцитопе-нию. В сыворотке крови определяют высокое содержание железа, а в пунктате костного мозга — сидеробласты (клетки костного мозга с включениями железа в виде гранул). Дефицит ферментов, участвующих в обмене порфиринов, уточняют путем определения продуктов порфиринов в моче. Повышенное содержание железа в организме доказывается также с помощью десфераловой пробы (после введения десферала с мочой выделяется увеличенное количество железа). При биопсии печени, селезенки можно обнаружить признаки гемосидероза. ОЖСС у таких больных снижена.
Лечение. Назначение препаратов железа неэффективно, но еще больше увеличивает содержание железа в крови и способствует гемосидерозу органов. Точно так же не показаны и гемотрансфузии. Применяется пири-доксин (витамин В6) в дозах 50 — 200 мг/сут внутрь или по 100 мг внутримышечно 2 раза в неделю в течение 2 мес. Наиболее эффективен кофер-мент пиридоксаль-фосфат, так как иногда бывает блокирована возможность перехода пиридоксина в пиридоксаль-фосфат. При наследственных формах лечение витамином Вб надо повторять периодически. В случае ре-зистентности к терапии пиридоксином применяют анаболические и андро-генные гормоны.
Для уменьшения гемосидероза органов и снижения уровня сывороточного железа назначают десферал (внутривенно по 500 — 1000 мг) с перерывами, ориентируясь на уровень железа и присутствие сидероблас-тов в костном мозге.
В12-ДЕФИЦИТНАЯ АНЕМИЯ
Сущность Biz-дефицитной анемии (В12ДА) состоит в нарушении образования дезоксирибонуклеиновой кислоты (ДНК) в связи с нехваткой в организме витамина Bi2 (цианокобаламина), что приводит к нарушению кроветворения, появлению в костном мозге мегалобластов, внутри-костномозговому разрушению эритрокариоцитов, снижению количества эритроцитов и гемоглобина, лейкопении, нейтропении и тромбоцитопении, а также к изменению ряда органов и систем (пищеварительный тракт, ЦНС).
Этиология. В12ДА встречается значительно реже, чем ЖДА, и может быть вызвана следующими причинами:
450
1) нарушением секреции гастромукопротеина («внутренний фактор»)
при наследственно обусловленной атрофии желез желудка (пернициозная
анемия, или болезнь Аддисона — Бирмера), при органических заболева
ниях желудка (полипоз, рак), после гастрэктомии;
2) повышением расхода витамина Bi2 (инвазия широкого лентеца, ак
тивация кишечной микрофлоры при дивертикулезах тонкой кишки);
3) нарушением всасывания витамина Bi2 (органические заболевания
кишечника — спру, илеит, рак, состояние после резекции кишки, наслед
ственное нарушение всасывания — болезнь Имерслунд—Гресбека);
4) нарушением транспорта витамина Вп (дефицит транскобаламина);
5) образованием антител к «внутреннему фактору» или комплексу
«внутренний фактор» + витамин В12-
Сходную с В12ДА гиперхромную анемию вызывает дефицит фолиевой кислоты, который возникает при: 1) повышенном расходе (беременность); 2) вскармливании детей козьим молоком; 3) нарушении всасывания (органические заболевания кишечника, алкоголизм); 4) приеме некоторых лекарственных препаратов (противосудорожные, противотуберкулезные препараты, фенобарбитал, контрацептивы и др.).
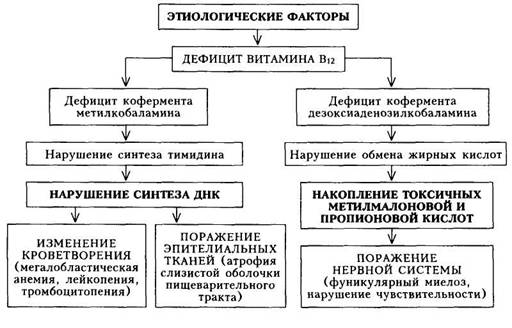
Патогенез. Витамин В(2 состоит из двух коферментов — метилкоба-ламина и дезоксиаденозилкобаламина. Дефицит первого кофермента обусловливает нарушение синтеза ДНК, вследствие чего деление и созревание клеток красного ряда нарушаются, они избыточно растут, не утрачивая ядра. Большие клетки, содержащие ядра, называются мегалобласта-ми, они не созревают до мегалоцитов (гигантские эритроциты без ядер), легко гемолизируются, еще находясь в костном мозге. Дефицит витамина В(2 вызывает нарушение роста клеток лейкоцитарного и тромбоцитарного рядов, но это не так заметно сказывается на морфологии и количестве клеток, как нарушения эритропоэза.
При недостатке второго кофермента нарушается обмен жирных кислот, вследствие чего в организме происходит накопление токсичных продуктов пропионовой и метилмалоновой кислот: развивается поражение заднебоко-вых канатиков спинного мозга — фуникулярный миелоз (схема 26).
Клиническая картина. Проявления В^ДА, как это вытекает из схемы патогенеза, складываются из следующих синдромов: 1) циркуляторно-ги-поксического (при достаточной выраженности анемии и кислородного голодания тканей); 2) гастроэнтерологического; 3) неврологического; 4) гематологического (анемия гиперхромного типа).
Кроме этих синдромов, клиническая картина будет определяться также заболеванием, на основе которого развилась В^ДА.
На I этапе диагностического поиска при достаточно выраженной анемии могут наблюдаться симптомы, обусловленные циркуляторно-ги-поксическим синдромом (слабость, повышенная утомляемость, одышка при физической нагрузке, болевые ощущения в области сердца, сердцебиения). В случае нерезкого кислородного голодания тканей эти жалобы могут отсутствовать. Снижение аппетита, отвращение к мясу, боли в кончике языка и жжение, чувство тяжести в эпигастрии после еды, чередование поносов и запоров обусловлены поражением пищеварительного тракта и, в частности, выраженной секреторной недостаточностью желудка. При поражении ЦНС больные жалуются на головную боль, неустойчивую походку, зябкость, чувство онемения в конечностях, ощущение «ползания
451
|
Схема 26. Патогенез В12-дефицитной анемии |
мурашек». Выраженность этих жалоб не всегда соответствует степени анемии, в период ремиссии заболевания жалобы могут отсутствовать. Весьма существенно, если все перечисленные жалобы предъявляет немолодой человек, в этих случаях вероятность В12ДА повышается.
В семейном анамнезе у больных с предполагаемой В12ДА могут быть больные с данным заболеванием. Злоупотребление алкоголем может быть одной из причин развития анемии.
Данные анамнеза могут помочь в предположении патогенетического варианта анемии. Развитие анемии после пребывания больного возле больших водоемов и употребления в пищу сырой или недостаточно обработанной рыбы заставляет предположить в качестве возможной причины дифилло-ботриоз. Если заболевание возникло у пожилого человека, страдающего хроническим гастритом, и развивается медленно, то можно думать о В12ДА. В случае, если симптомы со стороны пищеварительного тракта сочетаются со снижением массы тела и быстро прогрессируют, следует предположить в качестве причины заболевания злокачественное новообразование.
Наконец, сведения об успешном лечении больного витамином Bf2 позволяют с большой уверенностью рассматривать имеющуюся симптоматику как проявление В^ДА.
На II этапе диагностического поиска симптомы могут быть обусловлены поражением пищеварительного тракта и ЦНС. Кроме того, ряд неспецифических признаков повышает вероятность предположения о наличии у больного В12ДА. Так, бледность кожных покровов в сочетании с небольшой иктеричностью склер и одутловатостью лица наблюдается при В12ДА. Масса тела таких больных, как правило, нормальная или повышенная. Однако снижение массы тела может указывать на злокачествен-
452
ную опухоль как возможную причину ВпДА. Аналогичное значение имеет обнаружение увеличенного плотного лимфатического узла (метастаз опухоли?). Циркуляторно-гипоксический синдром проявляется так же, как и при ЖДА (расширение границ сердца влево, тахикардия, систолический шум, шум «волчка» на яремных венах).
Несомненное диагностическое значение имеет обнаружение при исследовании пищеварительного тракта признаков глоссита: сглаженные сосочки вплоть до полной их атрофии («полированный» язык). Печень несколько увеличена, может прощупываться селезенка. Однако все эти симптомы не являются обязательными для В12ДА. Отмечаются нарушения глубокой чувствительности, нижний спастический парапарез (картина псевдотабеса). Следует заметить, что изменения нервной системы наблюдаются далеко не во всех случаях, так что их отсутствие не исключает диагноза В12ДА.
Таким образом, данные II этапа в сочетании с анамнестическими данными и жалобами больного, хотя и выявляют ряд основных симптомов В12ДА, но дают основание лишь заподозрить эту форму болезни. Окончательный диагноз ставят после проведения серии лабораторных исследований.

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 |