В состав криозашитных растворов, согласно рецепту, были включены также: криопротектор со слабым экзоцеллюлярным действием (, , 1994) – желатин - по своей биологической природе является денатурированным белком, полученным из коллагенсодержащих тканей крупного рогатого скота в результате ступенчатой тепловой и химической обработки (, 1999). Желатин представляет собой линейный высокоасимметричный полипептидный полимер белковой природы (, , 2006). Макромолекулы желатина содержат в среднем 500-600 аминокислотных остатков, что обуславливает их молекулярную массу от 40 000 до 100 000 и более. Каждый третий фрагмент молекулы является остатком глицина, вследствие чего 96% цепи желатина могут быть описаны формулой (-Gly-X-Y-)m. Положение X чаще других занимает остаток пролина, а Y – гидроксипролина. Аминокислоты, образующие главную цепь молекулы условно делят на 2 группы: содержащие углеводородные радикалы (Pro, Leu, Phe, Ile, Ala) и функциональные группы -NH2 (Lys, Hul), -COOH (Asp, Glu), -CONH2 (Asn, Gln).

Растворы желатина наименее реактогенны, обладают буферными свойствами, не нарушают гомеостаз, улучшают реалогические свойства крови, обеспечивают мобилизацию межтканевой жидкости в сосудистое русло. Их применяют в качестве коллоидной основы эритроцитсодержащих сред и как кровезамещающие препараты, инфузии данного препарата снижают уровень ПОЛ ( и др., 1997, 1998). Использовали гемоконсервант для эритроцитов модежель (-Мед» г. С. Петербург) – 8% раствор деионизированного пищевого желатина в 0,9% растворе натрия хлорида со средней молекулярной массой 16000 (, , 2003), содержит ионы натрия, кальция и хлора и плазмозамещающее средство желатиноль (-Мед» г. С. Петербург) – относительная молекулярная масса которого 20000±5000; коллоидный 8 % раствор частично расщепленного пищевого желатина в изотоническом растворе натрия хлорида, содержит ионы натрия, кальция и хлора, а также ряд аминокислот: глицин, пролин, метионин, цистин и др.; триптофан отсутствует. Прозрачный раствор янтарного цвета со специфическим запахом; рН=6,8-7,6;
лемнан, апиогалактуронановый пектиновый полисахарид, выделен из свежесобранного водного растения ряски малой Lemna minor L. отделом молекулярной иммунологии и биотехнологии Института физиологии Коми НЦ УрО РАН г. Сыктывкар. Лемнан характеризуется высокой способностью к образовании вязких водных растворов и к гелеобразованию ( и др., 2000). Как и все пектины, лемнан имеет главную углеводную цепь из α-1,4-связанных остатков D-галактуроновой кислоты, участок апиоглактуронана с боковыми цепями из одиночных и α-1,3-связанных остатков D-апиозы и область рамногалактуронана I (Golovchenko V.V. et al., 2002). Имеет средний молекулярный вес 400 000.
В качестве дополнительных «реставрирующих» компонентов использовали:
гидроксиметилэтилпиридина сукцинат (3-гидрокси-6-метил-2-этилпиридина сукцинат, ОМЭПС; мексидол «Эллара» Владимирская обл.). Противогипоксический эффект ОМЭПС обусловлен наличием в его составе остатка янтарной кислоты, которая, являясь естественным метаболитом, окисляется в дыхательной цепи (, 2001), и связан с его антиоксидантным действием и влиянием на энергетический обмен. ОМЭПС, как водорастворимый антиоксидант обладает наибольшей эффективностью в первой фазе свободно-радикальных реакций (СРР) – гиперпродукции радикалов-инициаторов, в отличие от гидрофобных ингибиторов: a-токоферол, каротиноиды, флавоноиды и др. ( и др., 2001). Известно (, 1991, 1992), что активацию пероксидации липидов клеточных мембран и липопротеинов обуславливает увеличение продукции АФК, появление пула каталитически активных ионов железа (II) Fe2+ и падение активности эндогенной системы ингибиторов СРР. Данное производное 3-гидроксипиридина взаимодействует с водорастворимыми радикалами и с ионами двухвалентного железа, хелатируя или окисляя их в катион железа (III) Fe3+, что уменьшает эффективную концентрацию катализатора СРР. Таким образом, в основе антиоксидантного действия ОМЭПС лежит его способность ингибировать стадию инициации ПОЛ, во многом обусловленную образованием АФК и появлением каталитически активных ионов железа ( и др., 2001). ОМЭПС корригирует нарушения электролитного и микроэлементного состава плазмы, ингибирует ПОЛ, повышает активность супероксидоксидазы, соотношение липид-белок, при этом снижает уровень холестерина и триглицеридов, увеличивает содержание липидов высокой плотности и полярных фракций липидов, уменьшая вязкость мембраны и ее текучесть (, 2000). Также данное вещество модулирует активность мембранносвязанных ферментов, рецепторных комплексов, что усиливает их способность связывания с лигандами и способствует сохранению упорядоченной структурно-функциональной организации биомембран ( и др., 1995). Эффективно применяется ОМЭПС при коррекции иммунных нарушений (, 2006), интенсивной терапии гнойных нейроинфекций (, 2006), ингибировании ПОЛ сыворотки крови (, , 2006). Отмечено также положительное влияние ОМЭПС на систему крови в условиях стресса человека (, 2006);
фумарат натрия ( г. С. Петербург) – антигипоксант биоэнергетической направленности (, 1993) - белый порошок, хорошо растворимый в воде, рН=7,0-7,4, молекулярная масса 160. Используется в качестве кровезаменителя - "Мафусол" (, 1997);
N-метиламмония натрия сукцинат (N-1-дезокси-D-глюцитол-1, реамберин, -техническая фармацевтическая фирма «Полисан» г. С.Петербург). Реамберин – 1,5% раствор для инфузий (, 1997) представляет собой хорошо сбалансированный полиионный раствор с добавлением янтарной кислоты. Содержит N-метиламмония натрия сукцинат (15,0 г), натрия хлорид (6,0 г), калия хлорид (0,3 г), магния хлорид (0,12 г) и воду до 100 мл. Обладает антигипоксическим, антитоксическим и антиоксидантным действием: уменьшает продукцию свободных радикалов, восстанавливает энергетический потенциал клеток. Практически нетоксичен (5 класс); основной его эффект заключается в том, что он способен усиливать компенсаторную активацию аэробного гликолиза, снижать степень угнетения окислительных процессов в цикле Кребса в дыхательной цепи митохондрий клеток с увеличением внутриклеточного фонда макроэнергетических соединений аденозинтрифосфата и кретинфосфата;
холина хлорид (ХХ; Fluka, США), Mr=139,63. Является лекарственным средством (, 2002). Холин - представитель комплекса витаминов группы «В», входит в состав фосфолипида лецитина, предшественник ацетилхолина. Обладает мембранопротекторным, липотропным, антиатеросклеротическим, антидепрессантным и др. действием;
глюкоза (ООО «Агат-Мед» г. Москва) – обладает слабым эндоцеллюлярным криопротекторным действием часто включается в состав криоконсервантов для регуляции осмотических и метаболических процессов в клетках, способствуя эффективной их репарации (, , 1994);
лимонная кислота (Белгородский завод лимонной кислоты) - необходимое звено в системе биохимических реакций клеточного дыхания, реализующее энергетический метаболизм клетки (, 1980), содержится в небольшом количестве в митохондриях всех клеток и, поступая в организм, полностью метаболизируется до воды и углекислого газа (, 1993), хорошо растворима в воде и спирте, кристаллизуется в прозрачных бесцветных призмах ромбической системы, с одной частицей воды. Благодаря своим кислотным свойствам поддерживает в организме кислотно-щелочное равновесие, что используется для доведения рН различных сред до физиологической нормы 7,0-7,2 (, 1980). Образует одно-, двух - и трёхзамещённые соли - цитраты. Хорошо растворимая в воде динатриевая соль лимонной кислоты (цитрат натрия), представляющая собой бесцветные кристаллы или белый кристаллический порошок без запаха, применяется в виде 4% раствора для консервирования крови, обладает противосвертывающим действием - связывает свободные ионы кальция, участвующие в образовании тромбопластина и в переходе протромбина в тромбин (, 2002). Цитрат натрия, как и лимонная кислота, является антикоагулянтом для лейкоцитного концентрата;
гидроксид натрия ( Химпром» г. Самара) использовали 1 м р-р для доведения уровня рН растворов до физиологической нормы (7,0-7,2);
трилон Б (-Мед» г. Москва) - динатриевая соль этилендиаминтетрауксусной кислоты (Na2ЭДТА) является эффективным препаратом для связывания кальция в крови, белый кристаллический порошок хорошо растворимый в воде (при +20°С растворимость составляет 100 г/л, при +80°С – 230 г/л.), плохо растворим в спирте, температура плавления +110°С, температура разложения +255°С, рН 1%-ного водного раствора 4,5.
После смешивания исследуемой биосреды с криоконсервирующим раствором конечная концентрация ингредиентов уменьшалась в 2 раза, однако уровень рН не изменялся и соответствовал физиологической норме 7,0 – 7,4.
2.3 Методы исследования физико-химических свойств криозащитных растворов
Оптическую плотность образцов растворов с ГМБТОЭМ определяли на рефрактометре ИРФ-23, концентрацию водородных ионов в хладоограждающих растворах и испытуемой биосреде измеряли при комнатной температуре на ионометре Эксперт-001 (-эксперт» г. Москва).
Для стерилизации растворов использовали паровой метод согласно XI-ой Государственной Фармакопеи СССР (1990) в стеклянных флаконах 100 мл на станции переливания крови (СПК) ФГБУН КНИИГиПК ФМБА России.
Согласно «Временной инструкцией по проведению работ с целью определения сроков годности лекарственных средств на основе метода ускоренного старения при повышенной температуре (1983)» образцы выдерживали в течение 45 суток при +60°С в стеклянных флаконах по 50 мл, что соответствовало двум годам хранения при +4°С.
2.4 Биологические методы исследования криозащитных растворов
У оптимальных вариантов разработанных криозащитных растворов на лабораторных животных (табл. 2.4.1) изучены токсичность и пирогенность в соответствии с методикой XII-ой Государственной Фармакопеи РФ (2007), а также переносимость экспериментальными животными гемотрансфузий.
При изучении «острой» токсичности тест-дозу криозащитного раствора в конечной концентрации ингредиентов в количестве 0,5 мл вводили однократно в хвостовую вену белых лабораторных мышей массой г со скоростью 0,1 мл/с. Срок наблюдения за животными после введения хладоограждающего раствора составил 5 суток.
Таблица 2.4.1 Виды и число использованных животных
Виды животных | Число животных |
Мыши белые лабораторные Кролики неальбиносы Беспородные собаки | 120 62 12 |
Всего | 194 |
При изучении «хронической» токсичности инъекции делали ежедневно в течение 10 дней внутрибрюшинно белым лабораторным мышам, а также в краевую вену ушной раковины кроликам неальбиносам в тест-дозе 6,6 мл/кг со скоростью 0,05 мл/с. В эти же сроки контрольным группам животных аналогично вводили 0,9% раствор хлорида натрия. После последней инъекции всех животных подвергали эвтаназии эфиром и проводили гистологические исследования. До и после каждой инъекции оценивали внешний вид и поведение животных, у кроликов проводили общий анализ крови и мочи.
Испытание хладоограждающего раствора на пирогенность проводили на кроликах неальбиносах, которым внутривенно вводили тест-дозу 6,6 мл указанного раствора в конечной концентрации на кг массы тела кролика.
Изучение переносимости экспериментальными животными трансфузий концентрата аутологичных лейкоцитов, замороженных с разработанным хладоограждающим раствором проводили (, 1999) на беспородных собаках массой 14,3±4,0 кг. Для этого осуществляли забор крови в количестве равном 1% массы тела животного для получения аутологичного лейкоцитного концентрата путем цитафереза. Центрифугирование проводили на центрифуге ЦР-3 со скоростью 2000 об/мин в течение 7 мин. Полученный лейкоцитный концентрат смешивали со стерильным хладоограждающим раствором в соотношении 1:1 в пластикатном контейнере «Компопласт 300», выдерживали эту смесь при комнатной температуре в течение 20 минут и замораживали по разработанному методу. После размораживания осуществляли внутривенные трансфузии аутологичных лейкоцитных концентратов животным со скоростью 30 капель в минуту. До и после однократной трансфузии оценивали внешний вид и поведение собак, осуществляли термометрию, исследовали общий анализ крови и мочи, изучали реакцию животных на аутолейкотрансфузию.
2.5 Разработка программ замораживания и отогрева лейкоцитов
Перед замораживанием лейкоконцентрат смешивали с комбинированным консервантом в соотношении 1:1 в полимерном контейнере «Компопласт 300» и экспонировали при комнатной температуре в течение 20 минут.
Охлаждение лейкоцитных концентратов, смешанных с растворами №1-3 до температуры переохлаждения (–10°С) проводили 45±1,6 мин по трехступенчатой программе (рис. 2.5.1) в хладоноси% этиловый спирт; –10°С), находящемся в камере электроморозильника Криостат, созданного Институтом проблем криобиологии и криомедицины НАН Украины и Кировским НИИ гематологии и переливания крови. На 1-ом этапе со скоростью 12 °/мин до 0ºС, на 2-ом этапе со скоростью 0,9 °/мин до –7°С, на 3-ем – 0,3°/мин до температуры –10°С. После этого переносили для хранения в охлажденную до –10°С спиртовую ванну морозильной камеры бытового электрического холодильника «ЗИЛ» (Россия), где выдерживали от 1 до 14 суток.
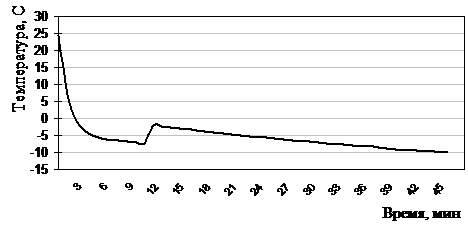
Рисунок 2.5.1 Термограмма охлаждения лейкоцитов до –10°С по трехступенчатой программе в хладоограждающем растворе №2 (Глицерин, ОМЭПС, Модежель)
В растворе №.4 охлаждение лейковзвеси проводили по аналогичной схеме (рис. 2.5.2): со скоростью 15 °/мин до 00С затем 1,4 °/мин до –6,2°С и в последующие 22 минуты до –10°С (0,3 °/мин ). После этого переносили для хранения в охлажденную до –10°С спиртовую ванну морозильной камеры бытового электрического холодильника «ЗИЛ» (Россия), где выдерживали от 1 до 14 суток.
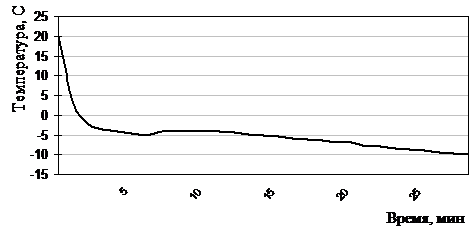
Рисунок 2.5.2 Термограмма охлаждения лейкоцитов до –10°С по трехступенчатой программе в хладоограждающем растворе №4 (Глицерин, ОМЭПС, Желатиноль)
Для замораживания лейкоцитов до –10°С в растворах №5-7 биообъект помещали в охлажденную до –10°С спиртовую ванну морозильной камеры бытового электрического холодильника «ЗИЛ» (Россия), где выдерживали 1 сутки.
Замораживание лейкоцитов до субумеренно-низкой температуры (–20°С) в растворах №8-10 проводили в течение 10±1,8 мин по двухступенчатой нелинейной (экспоненциальной) программе (рис. 2.5.3) в камере электроморозильника «Криостат» (96% этиловый спирт охлажден до –20°С): на 1-ом этапе со скоростью 10 °/мин до точки эвтектики (–2,1°С - температура, при которой весь раствор застывает в сплошную массу, состоящую из тонких прослоек льда из воды и застывшего растворенного вещества), на 2-ом - 2-3 º/мин до температуры –20ºС. Хранили замороженные образцы в электроморозильнике на -20°С «Derby» (Дания) от 1 до 90 суток.
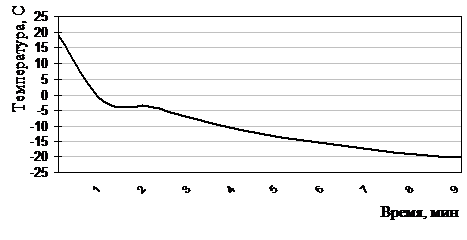
Рисунок 2.5.3 Термограмма замораживания лейкоцитов до –20°С по экспоненциальной программе в хладоограждающем растворе №9 (ГМБТОЭМ, ОМЭПС, вода для инъекций)
Замораживание лейкоцитов до –20°С в растворе №11 проводили по аналогичной методике в течение 19,5±6,5 мин (рис. 2.5.4): на 1-ом этапе со скоростью 1 °/мин до точки эвтектики (–2,1°С), на 2-ом – 1-2 °/мин до температуры –20°С. Хранили замороженные образцы в электроморозильнике на –20°С «Derby» (Дания) 1 сутки.
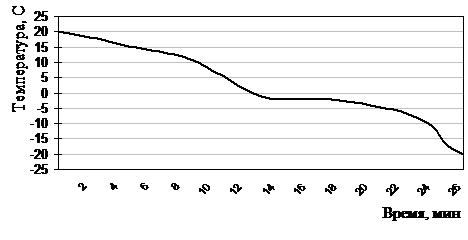
Рисунок 2.5.4 Термограмма замораживания лейкоцитов до –20°С по экспоненциальной программе в хладоограждающем растворе №11 (глицерин, лемнан, ОМЭПС, вода для инъекций)
При замораживании смеси лейкоцитов в хладоограждающих растворах №12-14 до умеренно-низкой температуры (–40°С) общее время составляло 18±0,7 мин. Охлаждение лейкоцитов производили в три этапа (рис. 2.5.5): на 1-ом этапе со скоростью 7-8º/мин до точки эвтектики (–2,6°С), на 2-ом – 1-2º/мин до температуры -28ºС и на 3-ем этапе 3-4º/мин до –40°С. Для первого и второго этапов замораживания биообъекта использовали электроморозильник «Криостат» (хладоноси% этиловый спирт, охлажденный до –28°С), для третьего - электроморозильник на –40°С «Derby» (Дания), в котором срок хранения биообъекта составил от 1 до 60 суток.
Замораживание лейкоцитов до –40°С в растворах №15-17 проводили по аналогичной методике: образцы выдерживали 15 мин в спиртовой охлажденной (–28°С) ванне электроморозильника «Криостат» и переносили для дальнейшего замораживания и хранения (1 стуки) в электроморозильник на –40°С «Derby» (Дания).
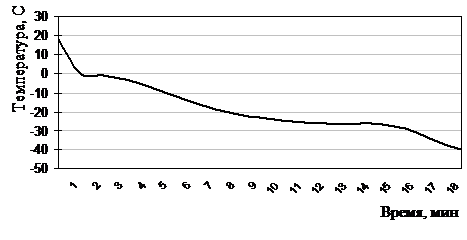
Рисунок 2.5.5 Термограмма замораживания лейкоцитов до –40°С по экспоненциальной программе в хладоограждающем растворе №13 (ГМБТОЭМ, фумарат натрия, лимонная кислота, вода для инъекций)
Замораживание лейкоцитов до –40°С в растворе №18 проводили по аналогичной методике в течение 17±1,0 мин (рис. 2.5.6): на 1-ом этапе со скоростью 10-13°/мин до точки эвтектики (–13,6°С), на 2-ом – 1-2º/мин до температуры –28°С и на 3-ем этапе 3,5º/мин до –40°С. Для первого и второго этапов замораживания биообъекта использовали электроморозильник «Криостат» (–28°С), для третьего - электроморозильник на –40°С «Derby» (Дания), в котором срок хранения биообъекта составил 1 сутки.
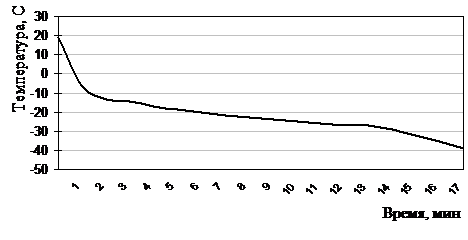
Рисунок 2.5.6 Термограмма замораживания лейкоцитов до –40°С по экспоненциальной программе в хладоограждающем растворе №18 (ПД, ОМЭПС, ХХ, вода для инъекций)
В опытах с низкой температурой (–80°С) общее время замораживания лейкоцитов по экспоненциальной программе составляло 62±0,5 мин. Охлаждение биообъекта в растворах №19-21 производили в три этапа (рис. 2.5.7): на 1-ом этапе со скоростью 6-7º/мин до точки эвтектики (–2,6°С), на 2-ом - 1-2º/мин до температуры –28ºС и на 3-ем этапе - 2-3º/мин до –80°С. Для первого и второго этапов замораживания биообъекта использовали электроморозильник «Криостат» (хладоноси% этиловый спирт, охлажденный до –28°С), для третьего - электроморозильник на –80°С MDF-3086S «Sanyo» (Япония) в котором срок хранения биообъекта составил 1 и 180 суток.
Замораживание лейкоцитов до –80°С в хладоограждающих растворах №22-24 проводили по экспоненциальной программе по аналогичной методике: образцы выдерживали 18 мин в спиртовой охлажденной (-28°С) ванне электроморозильника «Криостат» и переносили для дальнейшего замораживания и хранения (1 стуки) в электроморозильник на –80°С MDF-3086S «Sanyo» (Япония)
Следует отметить, что во всех опытах время и скорость замораживания были идентичны.
В дополнительной серии исследований лейкоциты в криозащитном растворе №20 были заморожены по линейной программе с применением жидкого азота в программном аппарате УОП 00.00.00 (Украина): на 1-м этапе со скоростью 1°C/мин от +22 до –7°C, на 2-м этапе - 10°C/мин от –7 до –40°C, на 3-м этапе - 20°C/мин от –40 до –80°C. Общее время замораживания составило 37 мин. После этого образцы переносили для хранения в электроморозильник на –80ºС MDF-3086S «Sanyo» (Япония) где хранили в течение суток.
 |
Рисунок 2.5.7 Термограммы замораживания лейкоцитов до –80°С по разным режимам в хладоограждающем растворе №20 (ГМБТОЭМ, ДМСО, ОМЭПС, вода для инъекций)
Температуру в каждой экспериментальной серии регистрировали с помощью прибора ГСП-04, датчик ТСМ-3-02 которого был установлен в одном из контейнеров с имитатором - криозащитным раствором с конечной концентрацией его ингредиентов. Скорость движения ленты самописца составляла 240 мм/ч.

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 |



