На правах рукописи
Методика и применение
автоматизированной микроскопии лейкоцитов
с количественной оценкой
цитохимических реакций
03.00.02 — биофизика
Автореферат диссертации на соискание учёной степени
кандидата медицинских наук
Москва — 2007
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Российский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
Научный руководитель:
кандидат физико-математических наук, доцент
Официальные оппоненты:
1. Доктор биологических наук, профессор
2. Доктор медицинских наук, старший научный сотрудник
Ведущая организация:
Федеральное государственное учреждение Федеральный научно-клинический центр детской гематологии, онкологии и иммунологии»
Росздрава
Защита диссертации состоится " 16 " мая 2007 г. в " 10 " часов на заседании диссертационного совета Д 208.057.01 при ФГУ «НИИ физико-химической медицины Росздрава» по адресу: 119992 Москва, ул. М. Пироговская, д. 1а.
С диссертацией можно ознакомиться в библиотеке ФГУ «НИИ физико-химической медицины Росздрава».
Автореферат разослан " 12 " апреля 2007 г.
Ученый секретарь
диссертационного совета,
доктор биологических наук
Общая характеристика работы
Актуальность темы. Цитометрия, то есть техника подсчёта, измерения и сортировки клеточных частиц, занимает одно из важнейших мест в арсенале современных медицины и биологии, в том числе гематологии. Методы цитометрии позволяют описывать клеточную популяцию с помощью объективно измеряемых количественных показателей, чем выгодно отличаются от традиционной визуальной микроскопии, результат которой сильно зависит от квалификации цитолога и его субъективных предпочтений [, 2005].
Наиболее широкое распространение получила проточная цитометрия (flow cytometry) благодаря высокой степени автоматизации, значительной скорости работы и санитарной безопасности для персонала. Между тем, эта методика имеет ряд существенных ограничений, в частности, фиксированный набор измеряемых признаков, отсутствие возможности визуального контроля, высокую стоимость оборудования и расходных материалов [, 2002].
Таким образом, развитие технологии автоматического анализа крови повысило точность и воспроизводимость определения основных гематологических показателей, но не отменило исследований клеток крови методом световой микроскопии. Микроскопические исследования выполняются в лабораториях, обслуживающих гематологические стационары, в большом объеме и сопровождаются значительным напряжением органов зрения и опорно-двигательного аппарата сотрудников. Утомление, развивающееся в результате длительной монотонной работы является потенциальным источником ошибок.
Поэтому метод видеоцитометрии (image cytometry), то есть цитометрии по микроскопическому изображению, всегда находил свою область применения. Разработаны аппаратно-программные комплексы, позволяющие автоматически производить поиск на мазке, измерение и классификацию нормальных клеток крови, например, комплекс МЕКОС-Ц2 [, 2006]. Видеоцитометрия также используется как средство объективной количественной оценки в гистологии и цитологии при различных методах окрашивания [, 2006, Lehr H. A., 1997].
Тем не менее, для цитохимических методов, имеющих большое значение при диагностике острых лейкозов, методика количественной оценки отсутствует. Между тем, сотрудники лабораторий, работающих в клиниках онкогематологического профиля, испытывают дополнительное психо-эмоциональное напряжение, связанное с особой ответственностью врача-лаборанта, устанавливающего диагноз злокачественного заболевания, поскольку его лечение само по себе может вызывать летальные осложнения. Успех терапии острого лейкоза в значительной мере определяется правильной диагностикой формы и варианта заболевания, в основе которой лежат морфология и цитохимия [, 2006]. Выраженная клинико-цитологическая гетерогенность острого лейкоза, использование при классифицировании конкретных случаев преимущественно неспецифических цитологических признаков, значение которых оценивается лишь в контексте всего спектра цитологических характеристик бластных клеток — делают диагностику острого лейкоза наиболее сложным разделом современной лабораторной гематологии. Поэтому задача автоматизации и объективизации оценки цитологических параметров лейкемических клеток представляется актуальной и важной.
Исследование эстераз при остром лейкозе традиционно используется для подтверждения моноцитарной природы бластной популяции и диагностики М4 — М5 вариантов острого миелоидного лейкоза (ОМЛ). Диагностическое использование a-нафтилацетатэстеразы (неспецифической эстеразы, НЭ) базируется на чувствительности этого фермента к ингибированию NaF в клетках моноцитарной линии [Hayhoe F., 1998]. Объективизация результатов этой реакции особенно актуальна, поскольку наличие ингибирования часто весьма трудно определить на глаз. Хотя количественная видеоцитометрическая оценка ряда других цитохимических реакций предпринималась [, 2000], для реакции на НЭ объективная методика предложена не была.
Методика видеоцитометрии, пригодная к широкому практическому применению, должна быть хорошо воспроизводима и максимально автоматизированна. Для обеспечения воспроизводимости необходимо выяснить влияние вариабельности окрашивания и других факторов, от которых зависит измеряемая оптическая плотность клетки, в частности, длины волны, на которой проводится измерение. Автоматизация же методики требует разработки надёжных алгоритмов автофокусировки и выбора места на мазке. Предлагавшиеся ранее алгоритмы автофокусировки, например, [Subbarao M., 1998], непригодны для микроскопии из-за особенностей механики. Алгоритм выбора места на мазке до настоящего времени предложен не был.
Таким образом, разработка автоматизированного метода объективной количественной оценки реакции на НЭ имеет важное значение для современной медицины. В настоящее время разработка методик автоматизированной видеоцитометрии является особенно актуальной, поскольку имеется возможность реализовать их широкое внедрение с применением современных компьютерных технологий и доступного качественного оборудования.
Целью настоящей работы является разработка методики количественной оценки активности неспецифической эстеразы и её ингибирования фторидом натрия в лейкоцитах средствами автоматизированной видеоцитометрии, а также проверка применимости этой методики для исследования клеток костного мозга в норме и при острых лейкозах.
Задачи.
1. Разработать методику количественной оценки активности неспецифической эстеразы и её ингибирования фторидом натрия в лейкоцитах на мазке костного мозга средствами автоматизированной видеоцитометрии.
2. Создать макет прибора для микроспектрофотометрии, с его помощью зарегистрировать спектры поглощения клеток и их частей и подобрать оптимальные спектральные диапазоны для количественной оценки активности неспецифической эстеразы, а также для ряда других цитохимический окрасок: на миелопероксидазу, гликоген (ШИК-реакция), липиды (судан чёрный Б), кислую фосфатазу.
3. Подобрать набор признаков клеток, достаточный для оценки реакции на неспецифическую эстеразу, разработать алгоритмы их автоматического измерения. Разработать алгоритмы выбора места на мазке и автофокусировки для автоматизации сбора выборки клеток.
4. Оценить практическую значимость разработанной методики для исследования костного мозга здоровых пациентов и больных острыми лейкозами.
Научная новизна. Проведён анализ современного состояния видеоцитометрии, что позволило сформулировать и решить ряд задач, существенно важных для создания полноценной автоматизированной системы видеоцитометрии, в частности для количественной оценки цитохимических реакций.
Впервые разработана методика количественной оценки активности неспецифической эстеразы и её ингибирования фторидом натрия: найдены оптимальные условия для измерения оптической плотности, подобран набор признаков клеток характеризующий данную реакцию, предложена нормировка по интегральной оптической плотности эритроцитов, позволяющая учесть вариации окрашивания. Впервые разработан алгоритм автоматического выделения гранул фермента. Найдены спектральные диапазоны для измерения поглощения при ряде других цитохимических окрасок.
Показано, что применение разработанной методики повышает информативность и объективность реакции на неспецифическую эстеразу, позволяет делать заключения в сомнительных случаях.
Впервые разработан алгоритм автоматической фокусировки для микроскопии, позволяющий получать сфокусированные изображения клеток с максимальной эффективностью и надёжностью более 99%.
Впервые разработан алгоритм автоматического выбора траектории на мазке крови, позволяющий собирать выборку клеток в оптимальной зоне, в том числе при неправильной форме мазка. Разработан оригинальный алгоритм оценки качества места на мазке по толщине слоя эритроцитов.
Теоретическое и практическое значение работы. Проведённые работы являются существенным вкладом в процесс создания системы автоматизированной видеоцитометрии. Разработанный метод заметно повышает информативность, объективность и точность оценки активности неспецифической эстеразы и её ингибирования фторидом натрия, что имеет существенное значение для проведения научных и клинико-диагностических исследований.
Реализация результатов исследования.
1. Разработанные алгоритмы с 2004 г. применяются в составе аппаратно-программного комплекса МЕКОС-Ц2, который эксплуатируется в более чем 100 медицинских и научно-исследовательских учреждениях России.
2. Разработанная методика количественной оценки активности неспецифической эстеразы и её ингибирования фторидом натрия применяется в Российской детской клинической больнице в качестве экспериментального метода при диагностике острых лейкозов.
Апробация диссертации. Материалы работы докладывались на заседании кафедры биофизики РГМУ 21.06.2006.
Публикации. По материалам диссертации опубликовано 9 печатных работ.
Объем и структура работы. Диссертация состоит из введения, 4 глав, выводов и списка литературы. Работа изложена на 112 страницах, иллюстрирована 27 рисунками и 4 таблицами. Список литературы включает 87 наименований, из которых 30 работ представлены на русском языке, 57 — на английском.
Работа выполнена на кафедре высшей математики ГОУ ВПО РГМУ Росздрава (заведующий — профессор, доктор физико-математических наук ) и в цитологической клинической лаборатории ГУ РДКБ Росздрава (заведующая — кандидат медицинских наук ).
Материалы и методы
Состав и характеристики аппаратуры. В качестве основной рабочей установки использовался комплекс МЕКОС-Ц2 (микроскоп Leica DM1000 с автоматическим устройством перемещения столика и фокусировки МЕКОС-MS2, видеокамера DeltaPix Infinity-X).
Установка собрана и функционирует в цитологической клинической лаборатории Российской детской клинической больницы. Настройка оборудования и измерение его параметров производились с помощью разработанной нами программы «МЕКОС-Валидатор», содержащей средства для измерения и неравномерности освещённости поля зрения, шума камеры, пространственного разрешения камеры, шага столика с помощью средств автоматического анализа движения, шага микровинта, люфтов столика и микровинта.
Для тестирования алгоритмов фокусировки и перемещения по мазку использовались ещё две установки: в клинико-диагностической лаборатории НИИ неотложной детской хирургии и травматологии (микроскоп Leica DMLA, камера Sony DXC390P) и в цитологической клинической лаборатории Российской детской клинической больницы (микроскоп ЛОМО Микмед-2 с МЕКОС-MS2, камера JVC F32U). Для микроспектрофотометрии (МСФ) использовался объектив 100×1,25, для количественной цитохимии — 50×0,90.
Видеокамера Infinity-X даёт цветное RGB-изображение 1280×1024 пикселя разрядностью 8 бит. Пространственное разрешение камеры составило 4,81 пиксель/мкм (объектив 50×) и 9,62 пиксель/мкм (объектив 100×). Проверка линейности камеры проводилась с помощью набора нейтральных фильтров.
Техника количественной цитохимии. Были использованы мазки костного мозга 28 пациентов Российской детской клинической больницы от 3 до 15 лет (15 мужского пола, 13 женского). Из них 4 с нормальным костным мозгом, 8 с острым лимфолейкозом (ОЛЛ), 7 с острым промиелоцитарным лейкозом (ОМЛ М3), 1 с острым миеломоноцитарным лейкозом (ОМЛ М4) с эозинофилией, 6 с острым моноцитарным лейкозом (ОМЛ М5), 1 с острым мегакариоцитарным лейкозом (ОМЛ М7), 1 с бластным кризом хронического миелолейкоза (ХМЛ) по М5-типу. У пациентов с лейкозами доля бластов в костном мозге составляла 76–92%.
Цитохимическое окрашивание препаратов производилось с помощью наборов марки «ДИАХИМ» производства НПФ «Абрис+» в соответствии с прилагаемой инструкцией. Реакция на НЭ (α-нафтилацетатэстеразу) проводилась на двух параллельных мазках: без ингибитора и с его добавлением.
Для количественной оценки реакции на НЭ производился сбор 200–300 ядросоднржащих клеток в не слишком толстой части мазка. Отдельно в зоне монослоя записывались несколько кадров с 200–300 отдельно лежащими эритроцитами для нормировки. Точно так же производился сбор выборки на препарате НЭ с ингибированием NaF.
На каждом отснятом кадре выполнялась полуавтоматическая сегментация клеток и фона с помощью программы МЕКОС-ДММ. В качестве фона брался участок плазмы, не содержащий клеток или других объектов. Чтобы оценить влияние неспецифического окрашивания плазмы, на 41 препарате в 30 местах была измерена оптическая плотность (ОП) отпечатков смытых эритроцитов, более светлых, чем окружающая плазма.
Для каждого лейкоцита измерялись следующие признаки.
1. Площадь, мкм2.
2. Относительная интегральная оптическая плотность (ИОП) по зелёному каналу (отн. ИОП): безразмерная величина, равная отношению ИОП клетки (средняя ОП, умноженная на площадь клетки) к средней ИОП нормировки (эритроцитов). Отн. ИОП характеризует общую активность фермента в клетке.
3. Коэффициент вариации ОП (КВОП). Рассчитывался как отношение стандартного отклонения (СО) ОП внутри клетки к средней ОП. Характеризует неравномерность распределения активности фермента.
4. Относительная ИОП гранул (отн. ИОП гранул). Измерялась так же, как ИОП, но не для всей клетки, а только для площади, занимаемой гранулами фермента. Последние выделялись автоматически с помощью разработанного нами алгоритма. Тёмные гранулы характерного размера подчёркивались с помощью LoG-фильтра — линейного фильтра с лапласианом функции Гаусса в качестве ядра. Оптимальное значение параметра σ было подобрано экспериментально и оказалось равным 0,25 мкм. После LoG-фильтрации порог сегментации гранул определялся с учётом средней ОП диффузной реакции и отношения отклика фильтра к величине ОП.
Препарат в целом описывался средними значениями каждой из характеристик, измеренных на препарате без добавления NaF. Кроме того, степень ингибирования описывалась показателем ингибирования (ПИ) — отношением средних отн. ИОП клеток без ингибитора и с ним. Также подсчитывался процент гранулярных клеток, то есть клеток с отн. ИОП гранул больше 0,001.
Статистическая обработка и визуализация данных проводилась с помощью пакета «R» версии 2.2.1. Для каждого пациента строились распределения клеток по каждому из признаков с ингибитором и без него, вычислялись средние и стандартные ошибки. Площадь, отн. ИОП и отн. ИОП гранул имели распределение, близкое к логнормальному, поэтому статистические показатели вычислялись для их десятичных логарифмов. При подсчёте среднего логарифма отн. ИОП гранул учитывались только гранулярные клетки.
Достоверность отличий в средних значениях характеристик при разных патологиях оценивалась с помощью критерия Вилкоксона.
Чтобы установить вклад гемоглобина в поглощение эритроцита в зелёном канале, была измерена ОП эритроцитов на 10 неокрашенных препаратах здоровых доноров. Мазки фиксировались 12 мин в парах формалина, на каждом измерялось по 200 клеток.
Техника микроспектрофотометрии (МСФ). Для измерения спектров поглощения микропрепаратов штатный осветитель заменялся системой монохроматического освещения, сконструированной и собранной нами совместно с Физическим институтом им. Лебедева РАН. Система состоит из осветителя на основе лампы накаливания и монохроматора с раздвижной входной щелью до 2 мм и призмой Аббе в качестве диспергирующего элемента. Для подведения света в микроскоп использовался гибкий световод. Для определения спектрального разрешения и калибровки монохроматора использовался спектрометр «Солар S100». Для увеличения апертуры осветителя световод вдвигался в объектив ЛОМО 40×0,65, фронтальная линза которого направлялась на препарат. Съёмка проводилась при длинах волн от 400 до 700 нм с шагом 10 нм.
Алгоритм автофокусировки включает процедуру оценки фокуса и алгоритм управления движением микровинта. Для оценки фокуса на изображении выделялся квадрат со стороной 64 или 128 пикселей, выполнялось двумерное преобразование Фурье, вычислялась сумма всех компонентов спектра мощности кроме нулевого, одного или двух первых и 1/4 старших коэффициентов. Определение достоверности изменения оценки фокуса проводилось с учётом шума камеры и вибрации установки.
Алгоритм перемещения микровинта.
1. Выбрать направление движения случайным образом.
2. Повернуть микровинт на один шаг в выбранном направлении.
3. Если зафиксировано достоверное убывание оценки, но достоверного возрастания не было, изменить направление движения, вернуться к шагу 2. Если возрастание было, перейти к шагу 4, иначе вернуться к шагу 2.
4. Вернуть микровинт к положению максимальной оценки фокуса.
Проверка проводилась на трёх установках в режиме поиска лейкоцитов на мазках, окрашенных по Романовскому-Гимзе. Было просканировано 60 препаратов (всего 5580 фокусировок). Для каждой установки определялись среднее число шагов фокусировки и средний процент сбоев фокусировки.
Алгоритм выбора места на мазке состоит из оценки толщины мазка, отыскания направления движения на её основе и формирования траектории с учётом найденного направления.
Для оценки толщины мазка использовалась величина h = SклN∕S, где Sкл — средняя площадь эритроцита, N — число эритроцитов в кадре, а S — общая площадь кадра. N оценивалось как ИОП кадра, делённая на среднюю ИОП одного эритроцита. Средние площадь и ИОП эритроцита оценивались автоматически при прохождении тонкого слоя мазка. На основании экспертных оценок были выделены 3 пороговых значения для h, так чтобы толщина между первым и вторым порогами была оптимальна для сбора выборки эритроцитов, а между вторым и третьим — для подсчёта лейкоцитов.
Для определения направления все кадры разделялись по толщине на пригодные и непригодные. Перед очередным перемещением столика оценивалась вероятность получить после перемещения непригодный кадр. Если она была больше 0,9, направление движения менялось. Для оценки вероятности использовалась разработанная нами математическая модель границы между благоприятной и неблагоприятной зонами мазка. Положение границы оценивалось по значениям толщины уже пройденных кадров в заданной окрестности на основании предложенной модели с помощью формулы Байеса.
Алгоритм навигации был проверен на трёх установках на 60 мазках нормальной и патологической (анемия, лейкопения) крови различной формы. Из них 20 имели форму, отличную от прямоугольной, и 6 не имели достаточно широкой зоны монослоя. Каждый мазок сканировался 3 раза, для проверки устойчивости алгоритма выбирались как правильные исходные точки, так и смещённые в толстую часть. Оценивались качество и стабильность оценки толщины мазка и качество работы алгоритма выбора направления. Также визуально и с помощью алгоритма оценки толщины мазка определялся средний процент кадров из слишком толстой части мазка.
Результаты исследования
Количественная оценка активности НЭ в лейкоцитах её ингибирования NaF при острых лейкозах.
Из приведённых на рисс. 1–3 данных видно, что по отн. ИОП, ПИ и проценту гранулярных клеток нормальные препараты довольно близки между собой. Бо́льшие различия наблюдаются по площади и КВОП: они хуже воспроизводятся, так как сильно зависят от скорости нанесения мазка. НЭ клеток нормального костного мозга не ингибируется NaF. Действительно, доля клеток моноцитарного ряда в норме не выше 2%.
ОЛЛ характеризуется более низкими значениями всех характеристик, кроме препаратов 3 и 4, где бласты имеют умеренно положительную реакцию. Из 9 случаев ОЛЛ в двух наблюдалось ингибирование NaF (пациенты 3 и 6). Поскольку оно происходило на фоне достаточно слабой реакции, достоверно зафиксировать ингибирование можно было только количественно. В среднем по всем показателям отличия от нормы недостоверны (p > 0,1).
Препараты с ОМЛ М5 характеризуются высокими значениями всех показателей. Отличия от нормы и ОЛЛ достоверны по всем характеристикам (площадь: p < 0,1, отн. ИОП, ПИ: p < 0,01, остальные — p < 0,05), от ОМЛ М3 — по проценту гранулярных клеток и отн. ИОП гранул (p < 0,05). Только пациент 11 с умеренным значением отн. ИОП имел нетипичную преимущественно гранулярную реакцию в небольшом проценте бластов. Все препараты с ОМЛ М5 показывают достоверное ингибирование NaF. Сходный тип реакции наблюдался и у пациента с М5-вариантом бластного криза ХМЛ.
Для препаратов ОМЛ М3 и ОМЛ М4 отн. ИОП выше, чем в норме (p < 0,01). По КВОП они находятся на уровне нормы, а по проценту гранулярных — несколько выше (p < 0,1). От ОЛЛ достоверны отличия по отн. ИОП (p < 0,01), площади (p < 0,05), КВОП и проценту гранулярных (p < 0,1). Особенно интересны результаты оценки ингибирования NaF: из 8 случаев большой ПИ наблюдался в трёх (пациенты 5, 8 и 18), что не позволило выявить статистически значимые различия между ОМЛ М3 и ОМЛ М5 по этому показателю.
а)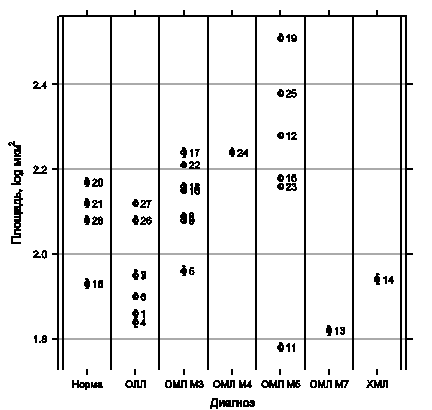
б)
Рис. 1. Результаты количественной оценки активности НЭ: площадь (а) и относительная интегральная оптическая плотность (б). Каждая точка соответствует одному пациенту. Приведены средние и стандартные ошибки. Рядом с точками указаны номера пациентов.
а) б)
б)
Рис. 2. Результаты количественной оценки активности НЭ: показатель ингибирования (а) и коэффициент вариации оптической плотности (б). Обозначения как на рис. 1.
а) б)
б)
Рис. 3. Результаты количественной оценки активности НЭ: относительная интегральная оптическая плотность гранул (а) и процент гранулярных клеток (б). Обозначения как на рис. 1.
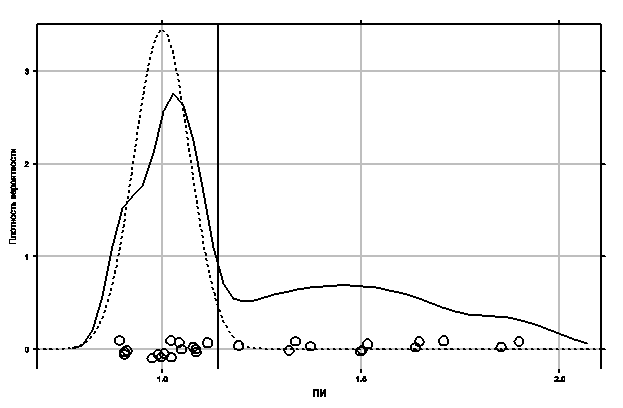
Рис. 4. Распределение ПИ в исследованных образцах. Каждый кружок соответствует одному пациенту. Сплошная кривая — ядерная оценка плотности распределения ПИ. Пунктирная кривая — плотность нормального распределения со средним 1,0 и СО 0,07. Вертикальная прямая проходит через значение 1,14.
ОП пустого стекла относительно плазмы. При измерении ОП отпечатков смытых эритроцитов было получено значение –0,013±0,003. Учитывая, что средняя ОП относительно плазмы эритроцитов, окрашенных на НЭ составляет 0,081±0,007, относительная погрешность может достигать 20%. Тем не менее, мы считаем, что ОП следует измерять относительно плазмы, поскольку участки плазмы можно найти на каждом кадре и минимальная ОП в клетке относительно плазмы часто неотличима от 0, в то время как относительно пустого стекла она всегда достоверно положительна. То есть плазма может играть роль отрицательного контроля, позволяющего учесть неспецифическое окрашивание.
ИОП эритроцитов характеризуется достаточно большим разбросом: от 1,91 до 5,66. При этом достоверные различия наблюдаются и для препаратов с ингибитором и без, которые готовятся и окрашиваются параллельно. Средняя ИОП эритроцитов на препарате с NaF уменьшается в 16 случаях (14 достоверных) и увеличивается в 12 случаях (9 достоверных), различие недостоверно (p > 0,1).
Таким образом, хотя наличие ингибитора, по-видимому, не влияет на окрашивание эритроцитов, их средняя ИОП воспроизводится плохо. Подобным образом ведёт себя и ИОП лейкоцитов: ПИ, вычисленный без нормировки, имеет большой разброс и почти не выявляет различий между ОЛЛ, ОМЛ М3 и ОМЛ М5. Более того, у пациента 22 ИОП бластов на препарате с NaF оказалась достоверно выше! Если же поделить ИОП лейкоцитов на среднюю ИОП эритроцитов того же препарата, сразу выделяется группа точек вокруг значения 1,0, отвечающая случаям неингибируемой НЭ (рис. 4), все пациенты с ОМЛ М5 имеют высокий ПИ в полном соответствии с данными литературы, и достоверные случаи «повышения» активности по действием NaF отсутствуют.
Для значений ПИ, недостоверно отличающихся от 1,0 (16 из 28) среднее ПИ составляет 1,01, а СО — 0,07. ПИ, равный 1,0, означает, что ингибитор не влияет на активность фермента, поэтому в качестве порогового значения при оценке ингибирования можно предложить 1,14 (среднее + 2 СО). Если ПИ превышает этот порог будем считать, что фермент ингибируется.
ИОП фиксированных неокрашенных эритроцитов оказалась равной 0,382±0,030. Это составляет почти 20% от минимальной ИОП эритроцитов, окрашенных на НЭ. Тем не менее, поскольку систематическая погрешность присутствует и в числителе, и в знаменателе, ошибка определения ПИ составляет не более 3,5%, и ей можно пренебречь.
Микроспектрофотометрия при цитохимическом окрашивании.
ОП гематоксилина Майера максимальна в области 580–600 нм и убывает в 2 раза при 500 и 640 нм. Поглощением гематоксилина в синей части спектра нельзя пренебречь, поэтому при измерении активности ферментов на фоне докрашенного ядра следует вносить поправку.
Спектр соли диазония, применявшейся при реакции на НЭ (рис.5), имеет почти постоянную ОП от 480 до 600 нм, что оправдывает использование зелёного канала цветной видеокамеры для количественной оценки этой реакции, поскольку докраска гематоксилином в этом случае не производилась.
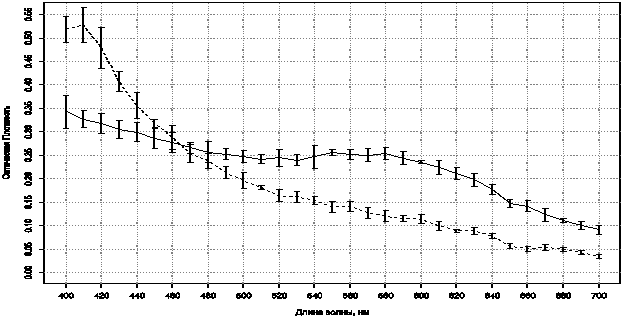
Рис. 5. Усреднённые спектры клеток при окраске на НЭ без докраски гематоксилином. —— – положительная реакция в цитоплазме лейкоцита– эритроцит.
Для остальных красителей, кроме реагента Шиффа (окраска на гликоген), целесообразно использовать длину волны 440 нм, поскольку здесь минимально поглощение гематоксилина и невелико — гемоглобина. Для ШИК-реакции отношения ОП на 440 нм и 600 нм для ядра и цитоплазмы очень близки, поэтому длину волны 440 нм следует заменить на 560 нм.
Проверка работы алгоритмов фокусировки и навигации по мазку
Работа алгоритма фокусировки сильно зависит от качества оборудования. Лучшие результаты показывает Leica DMLA (в среднем, 6,85 ± 0,61 шагов, 0,79% сбоев). Худшие результаты наблюдаются для Микмед-2 + МЕКОС-MS2 (8,05 ± 0,53 шагов, 1,11%). Главными причинами трудностей фокусировки являются погрешности механики микровинта и заметная вибрация столика, приводящая к колебаниям оценки фокуса.
В большинстве случаев траектория своевременно реагировала на выход из оптимальной зоны, также полностью удавалось избегать таких фатальных ошибок, как выход за край мазка. Доля кадров из неблагоприятной зоны составляла от 1,5% до 3,3%. Траектория поиска лейкоцитов на прямоугольных хорошо распределённых мазках, как и следовало ожидать, оказывалась прямоугольной, что доказывает стабильность, прежде всего, оценки толщины. Стабильными оказывались результаты и на скруглённых мазках.
Обсуждение
Для автоматизации цитологических исследований применяются две основные группы приборов: проточные анализаторы и видеоцитометры. Хотя наиболее распространены проточные приборы, они имеют ряд недостатков, например, ограниченные возможности в измерении морфологии клеток, отсутствие визуального контроля. Поэтому альтернативный метод видеоцитометрии всегда находил свою область применения [, 2002, , 2004].
Однако в настоящее время видеоцитометры находятся в основном на уровне научно-исследовательских разработок и пока не получили достаточно широкого распространения. Причинами столь медленного внедрения видеоцитометрии являются недостаток автоматизации, отсутствие стандартных схем проведения исследований и отработанной схемы клинической интерпретации результатов. Полноценная система видеоцитометрии должна обладать способностью автоматически находить клетки на препарате, выполнять сегментацию изображения (то есть выделять фон, ядра, цитоплазмы различных клеток), проводить измерения морфометрических и денситометрических характеристик, осуществлять классификацию типов исследуемых объектов.
Разработка комплекса МЕКОС-Ц2 явилась крупным шагом на пути преодоления перечисленных проблем, однако реализованный набор возможностей всё ещё достаточно ограничен, а уже работающие методики могут быть существенно улучшены. В данной работе ставилась цель разработать и проверить на практике методику количественной оценки активности НЭ и её ингибирования NaF в лейкоцитах для диагностики острых лейкозов, кроме того, были решены две более общие задачи видеоцитометрии, существенно важные для автоматизации как количественной цитохимии, так и других видеоцитометрических техник: автофокусировка и выбор места на мазке.
Прежде всего, для видеоцитометрии важную роль играет качество получаемых изображений клеток. В частности, для получения качественных изображений требуется надёжная автофокусировка. Нами был разработан специально адаптированный для микроскопии алгоритм, который использует максимум одну перемену направления движения. Последнее обстоятельство особенно важно, поскольку изменение направления движения связано с компенсацией люфта, которая не может быть выполнена достаточно точно. Ранее предлагавшиеся алгоритмы [Subbarao M., 1998] адаптированы для макросъёмки, где шаги перемещения примерно в 100 раз крупнее и люфтом можно пренебречь. Наименьшее число шагов описанного нами алгоритма — 4. Как показывают результаты испытаний, при фокусировке в среднем делается лишь 2 дополнительных шага по сравнению с теоретическим минимумом. При этом оптимальная скорость алгоритма сочетается с высокой надёжностью: более чем в 99% случаев находится истинное положение фокуса.
Вторая частая причина получения изображений низкого качества — неправильный выбор места на мазке (слишком толстая или слишком тонкая часть). Ранее предлагались способы оценки толщины мазка [Angulo J., 2003], но собственно алгоритм навигации до настоящего времени разработан не был. Нам удалось разработать оценку толщины мазка, которая позволяет определять оптимальную зону сбора как эритроцитов, так и лейкоцитов, а предложенный алгоритм навигации позволяет находить правильную траекторию движения на мазках сложной формы.
В настоящее время комплекс МЕКОС-Ц2 может применяться лишь для анализа мазков крови, окрашенных по Романовскому-Гимзе, но большое значение в гематологии имеют и другие методы окрашивания. В частности, цитохимические методики являются важнейшим и наиболее широко распространённым методом диагностики острых лейкозов [, 2006].
Создание прибора, позволяющего автоматизировать и объективизировать цитохимическое исследование, имело бы важное значение для улучшения качества диагностики острых лейкозов. Как первый шаг к созданию такого прибора нами была предпринята разработка методики количественной оценки реакции на НЭ. Также были найдены спектральные диапазоны для измерения поглощения при ряде других цитохимических окрасок. α-нафтилацетатэстераза традиционно используется для дифференциальной диагностики между вариантами ОМЛ М3 и М5: считается, что при ОМЛ М3 фермент, как правило, не ингибируется NaF, а при ОМЛ М5 — ингибируется. Правильная диагностика этих двух вариантов имеет первостепенное значение, поскольку при их лечении используются различные схемы терапии.
При выполнении работы мы старались уделять особое внимание методическим аспектам, влияющим на воспроизводимость результатов. Так, из результатов микроспектрофотометрии следует, что для количественной оценки реакции на НЭ без докрашивания ядер можно использовать зелёный канал цветной видеокамеры, так как спектр продукта реакции в этой области почти горизонтален, а поглощением гемоглобина можно пренебречь.
Для обеспечения воспроизводимости нами использовалась нормировка, в качестве которой была выбрана средняя ИОП эритроцитов. Особенно важное значение имеет наличие нормировки при оценке степени ингибирования. Без нормировки средние ИОП с ингибитором иногда оказывались достоверно больше, чем без него. Напротив, средние ИОП относительно эритроцитов всегда имели разумные значения. Таким образом, среди наиболее ярких преимуществ количественной методики можно выделить возможность объективного сравнения характеристик популяции клеток на различных препаратах. В перспективе это можно использовать для прослеживания динамики состояния пациента и для выделения групп сходных случаев.
Для описания реакции нами были предложены четыре характеристики клетки, одна из которых описывает размер клетки (площадь), другая — суммарную активность фермента (отн. ИОП), две оставшиеся — распределение фермента (КВОП и отн. ИОП гранул). Сложнее всего оказалось отличить диффузную реакцию от гранулярной. Дело в том, что наличие более светлой области ядра и более тёмной области цитоплазмы вызывает сильное увеличение КВОП даже при наличии диффузной реакции. Поэтому понадобилось разработать особый алгоритм выделения гранул, который выделял бы неравномерность ОП именно заданного размера (0,7–2 мкм).
Особенно интересна с практической точки зрения оценка ингибирования NaF. Нами предложена количественная характеристика — показатель ингибирования (ПИ) и установлено, что ингибирование можно считать достоверным, если ПИ превышает 1,14. Считается, что моноцитарная НЭ ингибируется NaF, а гранулоцитарная — нет. Действительно, во всех случаях ОМЛ М5 наблюдался достоверно высокий ПИ. Однако в 3 из 8 случаев ОМЛ М3 и ОМЛ М4 также наблюдалось достоверное ингибирование, при этом высокий ПИ, по-видимому, характерен для более интенсивной реакции (высокая отн. ИОП). Тем не менее, результаты не противоречат литературным данным, поскольку известны случаи промиелоцитарного лейкоза, когда бласты содержат моноцитарную НЭ. В то же время, все препараты с ОМЛ М5 имеют достоверно более высокий процент гранулярных клеток или отн. ИОП гранул, чем ОМЛ М5. Таким образом, по нашим данным при оценки реакции на НЭ большое диагностическое значение имеет не только ингибирование NaF, но и характер распределения фермента в клетке.
Также интересно наличие одного случая ОЛЛ с достаточно высокой отн. ИОП. Данный случай, сходный с ОМЛ М5, можно отличить уже на основе реакции на НЭ по отсутствию ингибирования и по низкой степени гранулярности.
Таким образом, представлена методика, позволяющая количественно оценивать активность НЭ и её ингибирование NaF в лейкоцитах. Разработаны все этапы процедуры, начиная от сбора выборки клеток и кончая интерпретацией результатов, показана практическая применимость методики. К числу её преимуществ перед традиционной визуальной оценкой можно отнести объективность, наличие нормировки в явном виде, возможность количественного представления результатов для сопоставления с результатами других исследований, изучения динамики заболеваний, сбора статистики и научной работы. Все измерения выполняются автоматически, поэтому метод существенно менее требователен к наличию у врача большого опыта цитохимической диагностики острых лейкозов, что особенно важно в условиях лечебных учреждений общего профиля.
Выводы
1. Разработана методика количественной оценки активности неспецифической эстеразы (НЭ) и её ингибирования фторидом натрия в лейкоцитах на мазке костного мозга средствами автоматизированной видеоцитометрии, позволяющая объективно оценивать результаты данной цитохимической реакции. Для обеспечения воспроизводимости результатов при количественной оценке активности НЭ в качестве нормировки может быть использована средняя интегральная оптическая плотность эритроцитов. Оптическую плотность следует измерять относительно плазмы. Средствами микроспектрофотометрии установлено, что для реакции на НЭ без докраски количественная оценка может проводиться по зелёному каналу цветной камеры.
2. Подобран набор параметров клеток, описывающих как интенсивность реакции, так и её характер (гранулярность). Получена количественная характеристика, описывающая степень ингибирования НЭ фторидом натрия (показатель ингибирования). Определены значения полученных показателей, характерные для нормального костного мозга, острого лимфолейкоза, острых промиелоцитарного и монобластного лейкозов.
3. По полученным характеристикам наблюдаются выраженные различия между острым промиелоцитарным и острым монобластным лейкозами, что доказывает высокую информативность разработанной методики при дифференциальной диагностике острых лейкозов. Доказано, что в ряде случаев при остром промиелоцитарном лейкозе может наблюдаться ингибирование НЭ фторидом натрия.
4. Получены спектры поглощения клеток при цитохимических окрасках на миелопероксидазу, гликоген (ШИК-реакция), фосфолипиды (судан чёрный B) и кислую фосфатазу с докраской гематоксилином Майера. Установлено, что для реакции на гликоген измерение оптической плотности может производиться на длинах волн 560 и 600 нм, для остальных реакций — на длинах волн 440 и 600 нм.
5. Разработаны эффективные алгоритмы, необходимые для автоматизации сбора выборки лейкоцитов: алгоритм автофокусировки, позволяющий автоматически получать сфокусированное изображение клетки с надёжностью больше 99% и эффективностью, близкой к максимальной; алгоритм оценки толщины мазка, позволяющий автоматически оценивать пригодность данного места на мазке для сбора выборки клеток; алгоритм автоматического перемещения по мазку, позволяющий собирать выборку клеток в оптимальной зоне, в том числе при неправильной форме мазка.
Список опубликованных работ по теме диссертации
1. , , Соколинский эритроцитометрия в роботизированном микроскопе МЕКОС-Ц1. // Клин лаб диагн. – 2003. – №6. – C. 39–42.
2. , , Маркеллов автоматизированного комплекса микроскопии МЕКОС-Ц2 для телемедицины, для испытаний новых методик анализов, для сбора электронного архива препаратов редких форм патологий, для удаленной аттестации и обучения. // Арх патол. – 2006. – №5. – C. 40–43.
3. , , Демьянов методик автоматизированной микроскопии биоматериалов. // Клин лаб диагн. – 2006. – №7. – C. 15–20.
4. , , . Структура системы автоматической микроскопии МЕКОС-Ц2 и методики ее испытаний. // Мед техн. – 2006. – №4. – C. 36–41.
5. , , Парпара микроскопия биоматериалов. // Здравоохр и мед техн. – 2005. – №4. – C. 42–43.
6. , , Демьянов по мазку крови при автоматическом подсчёте лейкоцитарной формулы и эритроцитометрии. // Здравоохр и мед техн. – 2005. – №7. – C. 37–38.
7. , , Николаенко испытания автоматизированных методик микроскопических анализов мазков крови. // Здравоохр и мед техн. – 2006. – №5.
8. , Парпара методов компьютерной микроскопии для количественного изучения движения крови. // Труды восьмой международной научно-технической конференции «Оптические методы исследования потоков» 28.06–01Москва. – 2005.
9. , , . Автоматическая сортировка лейкоцитов мазка крови с использованием методов обучаемых нейронных сетей и watershed. // Здравоохр и мед техн. – 2005. – №4. – C. 35.




