На правах рукописи
БУЕВЕРОВ
Алексей Олегович
Апоптоз гепатоцитов и лейкоцитов периферической крови при хронических гепатитах В и С
Специальность: – гастроэнтерология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук
Москва - 2009
Работа выполнена в ГОУ ВПО Московская медицинская академия
им. Минздравсоцразвития России
Научные консультантыДоктор медицинских наук, академик РАМН, профессор Доктор биологических наук, профессор | ИВАШКИН Владимир Трофимович БЕЛУШКИНА Наталья Николаевна |
Официальные оппоненты | |
Доктор медицинских наук, профессорДоктор медицинских наук, профессор Доктор медицинских наук, профессор | КАЛИНИН Андрей Викторович НИКИТИН Игорь Геннадьевич ПЛЮСНИН Сергей Вениаминович |
Ведущая организация: ГОУ ВПО Московский государственный медико-стоматологический университет Минздравсоцразвития России
Защита состоится «____»_______________ 2009 г. в _______ ч. на заседании
диссертационного совета Д 208.040.10 при ГОУ ВПО Московская медицинская академия им. ( , стр. 2)
С диссертацией можно ознакомиться в Центральной научной медицинской библиотеке ГОУ ВПО Московская медицинская академия им. ( г. Москва, Нахимовский проспект)
Автореферат разослан «____» ____________ 2009 г.
Ученый секретарь диссертационного совета
доктор медицинских наук, профессор
Актуальность проблемы
Хронические гепатиты В и С (ХГ В и С) в последние два десятилетия относятся к числу наиболее интенсивно изучаемых проблем внутренней медицины. Эти болезни характеризуются высокой медицинской и социальной значимостью ввиду широкого распространения, тенденции к росту заболеваемости, особенно среди лиц молодого возраста, нередкого развития тяжелых осложнений – цирроза печени и гепатоцеллюлярной карциномы и недостаточной эффективностью существующих методов лечения [, 2005, 2009, Kuntz E., Kuntz H.-D., 2006, Jacobson I. M., 2007, Maylin S., 2008]. Применение современных методов молекулярной и клеточной биологии позволило значительно расширить имеющиеся представления о биологии вирусов гепатита В и С (HBV, HCV). Так, установление факта репликации HВV и HСV помимо печени в мононуклеарных и полиморфноядерных лейкоцитах периферической крови больных ХГ В и С объяснило природу ряда внепеченочных проявлений HBV - и HCV-инфекции [Muller H. M., 1993, Crovatto M., 2000, Esquivel F., 2002]. Вместе с тем многие вопросы патогенеза вирусных гепатитов остаются не до конца проясненными, в частности, механизмы повреждения гепатоцитов. Открытие высокорегулируемой формы клеточной гибели – апоптоза – J. F. Kerr и соавт. в 1972 г. стимулировало изучение роли этого явления в патологии печени, в результате чего было обнаружено, что апоптоз может играть ведущую роль в развитии острых и хронических вирусных гепатитов [Hiramatsu N., 1994, Mita E., 1994], а также ряда других заболеваний печени, включая алкогольные, аутоиммунные, лекарственные поражения.
Существует, по крайней мере, два механизма, с помощью которых вирусы гепатита В и С теоретически могут активировать апоптоз: 1) непосредственное проапоптотическое действие специфических вирусных белков, образующихся в процессе репликации вируса – Х белка HBV [Zhang S. J., 2005] и core-белка HCV [Saito K., 2006]; 2) повышение экспрессии на клеточной мембране рецепторов, через которые передается сигнал к индукции апоптоза, например, Fas, и увеличение чувствительности клеток к различным проапоптотическим стимулам, в частности, к фактору некроза опухоли α (ФНО-α, TNF-α) [Zhu N., 1998, Ding W. X., 2004, Hatano E., 2007].
Другой, и, по-видимому, наиболее существенный механизм гибели инфицированных гепатоцитов – апоптоз в результате клеточного иммунного ответа, в особенности опосредованного цитотоксическими Т-лимфоцитами. Исследования последних лет подтверждают ведущую роль Т-лимфоцитов не только в клиренсе вируса, но и в патогенезе повреждения печени при вирусных гепатитах [, 2003, Rehermann B., 1996, Koziel M. J., 1997, Chisari F. V., 1997, 2000]. Цитотоксические Т-лимфоциты вызывают апоптоз инфицированных клеток с помощью перфорин-гранзимового комплекса и через систему Fas/FasL в результате взаимодействия растворимого или экспрессированного на поверхности активированных лимфоцитов FasL с Fas-рецептором клеток-мишеней.
В понимании патогенеза вирусных гепатитов крайне важным явилось обнаружение репликации вирусов гепатита В и С в лейкоцитах периферической крови (ЛПК) человека [, 2005, Lascus T., 1999, Gowans E. J., 2000]. Это позволило рассматривать ЛПК как дополнительную мишень действия вирусов и дополнительный резервуар инфекции. Персистенция HВV и HСV в этих клетках может стать причиной их поражения в результате индукции апоптоза, что должно привести к нарушению функций иммунной системы [, 2006, Crovatto M., 2000, Ghavami S., 2005].
Изучение апоптоза при хронических вирусных гепатитах имеет не только фундаментальное, но и прикладное клиническое значение. Во-первых, исследование процессов, ведущих к апоптозу клеток печени, дает возможность понять причины хронизации и прогрессирования воспаления печени и, что не менее важно, механизмы злокачественной трансформации и противоопухолевой защиты. Во-вторых, изучение апоптоза позволяет разрабатывать новые методы терапии, в частности, уменьшающие избыточную гибель гепатоцитов. В-третьих, применение методов экспресс-оценки апоптоза быстро обновляющихся популяций клеток помогает прогнозировать ответ на противовирусное лечение.
Цель настоящей работы
Изучение роли апоптоза гепатоцитов и лейкоцитов периферической крови в патогенезе хронических гепатитов В и С.
Задачи исследования
1. Исследование уровня апоптоза гепатоцитов и клеток воспалительного инфильтрата в биоптатах печени больных ХГ В и ХГ С.
2. Определение уровня экспрессии белков Fas и FasL в гепатоцитов и клеток воспалительного инфильтрата в биоптатах печени больных ХГ В и ХГ С.
3. Изучение взаимосвязи между уровнем апоптоза и уровнем экспрессии белков Fas и FasL в клетках печени больных ХГ В и ХГ С.
4. Исследование уровня апоптоза и степени повреждения ДНК в мононуклеарных и полиморфноядерных ЛПК больных ХГ В и ХГ С.
5. Сравнение интенсивности апоптоза ЛПК у больных ХГ С и хроническим вирусно-алкогольным гепатитом (ХГ С + алкоголь).
6. Сравнение интенсивности апоптоза ЛПК у больных ХГ С и синдромом аутоиммунного перекреста (аутоиммунный гепатит + первичный билиарный цирроз).
7. Оценка корреляционной связи уровня апоптоза ЛПК и ряда провоспалительных и противовоспалительных цитокинов.
8. Сравнительная оценка уровней апоптоза ЛПК до и после проведения комбинированной противовирусной терапии ИФН-α и рибавирином.
Научная новизна
Впервые проведено исследование уровня апоптоза клеток печени и ЛПК больных ХГ В и С как двух независимых мишеней действия вирусов гепатита В и С.
Впервые изучен уровень апоптоза клеток печени (гепатоцитов и клеток лимфогистиоцитарного инфильтрата) в сравнении с уровнем экспрессии мембранных белков, участвующих в индукции апоптоза (Fas, FasL). Выявлена взаимосвязь между уровнем экспрессии FasL лимфоцитов внутрипеченочного инфильтрата и уровнем апоптоза гепатоцитов. Обнаружена защитная роль экспрессии FasL гепатоцитами от апоптоз-индуцирующего действия цитотоксических Т-лимфоцитов.
Впервые проведено одновременное исследование уровня апоптоза и степени повреждения ДНК мононуклеарных и полиморфноядерных ЛПК у больных ХГ В и С. Обнаружено, что у больных ХГ В и С наблюдается достоверно более высокий по сравнению со здоровыми добровольцами уровень апоптоза мононуклеарных и полиморфноядерных ЛПК как при изучении апоптоза свежевыделенных клеток, так и спонтанного апоптоза при культивировании клеток in vitro в течение суток. При этом наиболее высокий уровень апоптоза ЛПК наблюдался у больных с повышенным уровнем сывороточного TNF-a.
Выявлена достоверная корреляционная зависимость степени повреждения ДНК свежевыделенных ЛПК с долей клеток в состоянии апоптоза после их инкубации в культуральной среде в течение 24 часов, что свидетельствует о наличии в периферической крови не только клеток в состоянии апоптоза, но и клеток, коммитированных к нему.
Впервые установлено, что усиление апоптоза мононуклеарных лейкоцитов периферической крови (МЛПК) в ответ на комбинированную противовирусную терапию служит ранним признаком элиминации HCV, выступая в роли дополнительного фактора раннего вирусологического ответа.
Практическая значимость
Обнаруженный высокий уровень апоптоза гепатоцитов при ХГ В, и особенно ХГ С, и появление экспрессии FasL на гепатоцитах могут быть использованы в качестве критериев оценки эффективности новых методов этиотропной и патогенетической терапии.
Обнаружено, что регистрация однонитевых разрывов ДНК может выступать в роли теста для выявления клеток, находящихся на ранних стадиях апоптоза или коммитированных к нему. Показано, что регистрация уровня повреждения ДНК и/или уровня апоптоза ЛПК у больных ХГ В и С относится к числу высокоинформативных показателей повреждения иммунокомпетентных клеток при этих заболеваниях и может быть использована в клинической практике для оценки динамики течения хронического вирусного гепатита и эффективности проводимой терапии.
Определение апоптоза МЛПК в динамике на фоне комбинированной противовирусной терапии ХГ С можно рассматривать в качестве дополнительного прогностического фактора вирусологического ответа, что позволяет своевременно вносить коррективы в схемы лечения. Отсутствие корреляции уменьшения концентрации сывороточной HCV РНК с нарастанием уровня апоптоза МЛПК указывает на необходимость тщательного сбора алкогольного анамнеза перед началом противовирусного лечения.
Внедрение
Результаты диссертации внедрены в практику работы стационара и амбулаторно-поликлинического отделения клиники пропедевтики внутренних болезней, гастроэнтерологии, гепатологии ММА им. ; используются при чтении лекций и проведении практических занятий для слушателей курса функциональной диагностики и фармакотерапии в гастроэнтерологии при кафедре семейной медицины ФППОВ.
Положения, выносимые на защиту
1. Апоптоз служит основным механизмом гибели как гепатоцитов, так и клеток лимфогистиоцитарного инфильтрата у больных ХГ В и С, при этом доля клеток в состоянии апоптоза у больных ХГ С в среднем протекает более интенсивно.
2. Экспрессия Fas-белка в гепатоцитах больных ХГ В и ХГ С отличается от экспрессии у здоровых лиц, наблюдаясь либо в цитоплазме (диффузно или в виде гранул), либо на клеточной мембране. Количественные различия в уровне экспрессии белка Fas в гепатоцитах при ХГ В и ХГ С не обнаружены.
3. В нормальных гепатоцитах отсутствует экспрессия FasL, однако она становится выраженной наблюдается при ХГ В и ХГ С.
4. Уровень апоптоза гепатоцитов при ХГ В и С прямо пропорционален степени экспрессии FasL клетками лимфогистиоцитарного инфильтрата в печени и обратно пропорционален уровню экспрессии FasL гепатоцитами.
5. Уровень апоптоза мононуклеарных и полиморфноядерных ЛПК больных ХГ В и ХГ С достоверно превышает уровень апоптоза этих клеток у здоровых лиц. Значимые различия между интенсивностью апоптоза при ХГ В и ХГ С не выявлены.
6. В периферической крови больных ХГ В и ХГ С присутствуют не только лейкоциты в состоянии апоптоза, но и коммитированные к нему клетки, что проявляется усилением апоптоза мононуклеарных и полиморфноядерных лейкоцитов после 24-часовой инкубации в культуральной среде.
7. У больных ХГ С значимо повышены сывороточные концентрации ИФН-γ и TNF-α. Существует высоко достоверная прямая корреляционная связь уровня апоптоза мононуклеарных и полиморфноядерных ЛПК больных ХГ С и сывороточной концентрации TNF-a.
8. Статистически значимые различия между уровнем апоптоза ЛПК у больных ХГ В и С и синдромом аутоиммунного перекреста (аутоиммунный гепатит + первичный билиарный цирроз) отсутствуют, что указывает на роль апоптоза в качестве унифицированного механизма повреждения клеток.
9. Усиление апоптоза мононуклеарных ЛПК у больных ХГ С через 2 нед комбинированной противовирусной терапии интерфероном-α и рибавирином служит ранним признаком элиминации вируса.
Апробация
Диссертация апробирована на заседании научно-методической конференции кафедры пропедевтики внутренних болезней лечебного факультета Московской Медицинской академии имени 10 июня 2009 года (протокол ).
Результаты исследований доложены на 5-й, 6-й и 10-й Российской конференции «Гепатология сегодня» (март 2000 г., март 2001 г., март 2005 г., Москва), на школе-конференции «Горизонты физико-химической биологии» (Пущино, май-июнь 2000), на III Съезде иммунологов и аллергологов СНГ (Сочи, сентябрь 2000), на Всероссийском совещании «Клеточная биология на пороге XXI века» (октябрь 2000 г., Санкт-Петербург), Межрегиональной научно-практической конференции молодых ученых и студентов (февраль 2001 г., Санкт-Петербург), на II Конференции молодых ученых России с международным участием «Фундаментальные науки и прогресс клинической медицины» (Москва, апрель 2001 г.), Пятой и Шестой научной конференции с международным участием «Дни иммунологии в Санкт-Петербурге » (май 2001 и май 2002 г., Санкт-Петербург), на 21-й Европейской Гастроэнтерологической Неделе (UEGW) (октябрь 2001 г., Амстердам), на Международном симпозиуме «Биология клетки в культуре» (октябрь 2001 г., Санкт-Петербург), на Балтийском гепатологическом форуме (октябрь 2002 г., Рига), на 2-м Всероссийском съезде инфекционистов (октябрь 2003 г., Санкт-Петербург), на 8-й и 10-й Российской гастроэнтерологической неделе (ноябрь 2003 г., октябрь 2005 г.), на 6-й Восточно-Сибирской гастроэнтерологической конференции (май 2006 г., Красноярск), на Российском медицинском форуме (октябрь 2006 г., октябрь 2007 г., Москва), на Российской конференции «Иммунная система и заболевания печени» (май 2009 г., Нахабино).
Структура и объем диссертации
Диссертация изложена на 143 страницах машинописного текста и включает введение; обзор литературы; главу, посвященную характеристике изучавшихся больных и клиническим, лабораторным и инструментальным методам исследования; главу собственных результатов, включающую 2 подраздела (апоптоз гепатоцитов и апоптоз лейкоцитов периферической крови); обсуждение полученных результатов, выводы, практические рекомендации, список литературы (18 отечественных и 171 зарубежный источник). Работа иллюстрирована 31 рисунком и 21 таблицей.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы
Всего обследовано 170 человек, из них 150 с диагнозом «хронический гепатит» (20 человек составили контрольную группу). В основную группу включено 130 больных ХГ В и С (86 мужчин, 44 женщины), находившихся на обследовании и лечении в клинике пропедевтики внутренних болезней, гастроэнтерологии и гепатологии ММА им. (директор – академик РАМН ) в период с 1999 по 2006 г. Средний возраст больных основной группы составил 35 лет (от 17 до 68 лет). ХГ В диагностирован у 24 человек, ХГ С – у 106. У 25 пациентов установлена смешанная (HCV + алкоголь) этиология гепатита (хронический вирусно-алкогольный гепатит – ХВАГ). Диагноз устанавливался на основании эпидемиологических, анамнестических, клинических, лабораторных и инструментальных данных. У 12 пациентов (7 с ХГ В, 5 с ХГ С) имелись лабораторные, инструментальные и гистологические признаки компенсированного цирроза печени (класс А по Чайлд-Пью). Кроме того, в исследованную группу вошли 20 больных САП (синдром аутоиммунного перекреста: аутоиммунный гепатит + первичный билиарный цирроз). Средний возраст больных САП составил 47 лет (27 – 74 г.), среди них были 2 мужчин и 18 женщин. Лабораторные, инструментальные и гистологические признаки компенсированного цирроза присутствовали у 3 пациентов.
У ,7%) исследованных пациентов была проведена чрескожная слепая биопсия печени по методу Menghini (зав. кабинетом биопсии печени – к. м.н. ). Из них у 24 диагностирован ХГ В, у 82 – ХГ С. Гистологическое исследование биоптатов печени осуществлялись на кафедре патологической анатомии ММА им. Сеченова д. м.н. . Гистологическую картину оценивали в баллах по критериям определения индекса гистологической активности (ИГА), предложенным R. G. Knodell. 26 неокрашенных депарафинизированных срезов использовали для иммуногистохимического и иммунофлуоресцентного исследования.
Группу исследования уровня апоптоза и уровня экспрессии белков Fas и FasL в клетках печени составили 26 больных хроническим вирусным гепатитом (22 мужчин, 4 женщины). Средний возраст больных составил 32 года (от 19 до 55 лет). У 12 больных (46%) был диагностирован ХГ В, у всех обнаружена сывороточная HBV ДНК. В исследование были также включены 14 больных ХГ С, положительные по HCV РНК в сыворотке крови.
Группу сравнения при исследовании уровня апоптоза и уровня экспрессии белков Fas и FasL в клетках печени составили 8 биоптатов печени человека с отрицательными результатами анализов на маркеры HBV и HCV-инфекции. В контрольных препаратах признаки дистрофии, воспаления и/или фиброза отсутствовали.
Группу больных для исследования уровня апоптоза и структуры ДНК ЛПК (вторую группу исследования) составили 104 больных хроническим вирусным гепатитом, из них мужчин%), женщин%). У 12 человек был диагностирован ХГ В, у 92 – ХГ С. Неравномерное распределение пациентов по этиологии было обусловлено тем, что на первом этапе исследования проводилось сравнение параметров апоптоза и структуры ДНК при ХГ В и С, тогда как в дальнейшем детально изучались характеристики апоптоза в однородной подгруппе больных ХГ С.
Контрольную группу для исследования уровня апоптоза и структуры ДНК ЛПК составили 20 образцов крови здоровых добровольцев без признаков патологии печени и с отрицательными результатами анализов на маркеры HBV и HCV-инфекции.
С целью определения влияния комбинированной противовирусной терапии ИФН-α и рибавирином на уровень апоптоза мононуклеарных ЛПК были выделены следующие группы пациентов: группа больных ХГ С – 29 человек, ХВАГ (ХГ С и алкоголь) – 25 человек и контрольная группа (здоровые доноры) – 20 человек. Средний возраст пациентов составил 37 лет лет).
Для больных ХГ С применялись стандартные критерии диагностики. В качестве обязательного критерия рассматривалось повышение активности АЛТ и АСТ. У всех пациентов в сыворотке выявлялись анти-HCV иммуноферментным методом и HCV РНК методом полимеразной цепной реакции. Определялись также генотип HCV и количественное содержание HCV РНК в сыворотке – вирусная нагрузка (число копий HCV РНК в 1 мл).
В группу ХВАГ включались пациенты с наличием критериев ХГС и употреблявшими алкоголь в дозе >80 г этанола в день на протяжении не менее 5 лет. Всем больным с ХВАГ проводилось анкетирование с целью оценки алкогольного анамнеза (Мичиганский опросник, опросник ВОЗ). Учитывались также симптомы алкогольного поражения печени: признаки стеатоза печени по данным УЗИ, макроцитоз эритроцитов, повышение активности γ-глутамилтранспептидазы, доминирование активности АСТ над АЛТ.
Все пациенты получали комбинированную противовирусную терапию (интерферон α2a + рибавирин) в стандартных рекомендованных дозах: 3 MU три раза в неделю + мг/день в зависимости от массы тела, соответственно. Общая продолжительность лечения составила 24-48 нед в зависимости от генотипа вируса.
Определение апоптоза МЛПК и сывороточной концентрации цитокинов (см. ниже) проводили до начала лечения, через 2 недели и через 24 недели после начала терапии. Количественное определение сывороточной концентрации HCV РНК методом ПЦР выполнялось исходно, через 2 недели после начала лечения и по окончании курса. У 8 больных выполнено качественное определение HCV РНК в сыворотке через 6 мес после окончания противовирусной терапии (устойчивый вирусологический ответ). Уровень апоптоза МЛПК определялся методом проточной цитофлуориметрии перед и через 2 недели после начала противовирусной терапии.
Для оценки уровня апоптоза клеток в ткани печени серийные срезы исследовали с помощью метода TUNEL (Terminal deoxyribonucleotidyl transferase-mediated dUTP Nick End Labeling) с использованием набора APO-BRDUTM (PharminGen). При этом методе происходит введение метки – бромдезоксиуридинтрифосфата – по свободным 3'-ОН-концам в ДНК с помощью фермента концевой дезоксирибонуклеотидилтрансферазы. Уровень апоптоза (TUNЕL-индекс) в процентах рассчитывали при исследовании не менее 1000 клеток как количество TUNEL-положительных клеток по отношению к общему количеству клеток в исследованном образце, подсчитанных после дополнительного окрашивания красителем Хехст 33258.
Иммуногистохимическое исследование уровня экспрессии Fas и FasL проводили на серийных срезах биоптатов печени больных, фиксированных формалином и залитых в парафин, с помощью непрямого стрептавидин-биотин-пероксидазного метода. Степень экспрессии антигенов оценивали по величине Fas - и FasL-индекса по трехбалльной системе и выражали в условных единицах. Величину индекса определяли в зависимости от количества окрашенных клеток: 0 - отсутствие экспрессии, 1 - низкая экспрессия (не более 30% клеток экспрессируют исследуемый антиген), 2 - умеренная (от 30 до 60% клеток экспрессируют исследуемый антиген) и 3 - высокая степень экспрессии (более 60% клеток экспрессируют исследуемый антиген). Средние индексы для ХГ В и С и контрольной группы определялись как средние значения отдельных случаев.
Выделение мононуклеарных и полиморфноядерных лейкоцитов из периферической крови проводили одноэтапным методом с использованием двуслойного градиента Ficoll-Paque. Выделенные клетки периферической крови в концентрации 1 млн/мл культивировали в среде RPMI 1640 (Sigma), содержащей 10% инактивированной эмбриональной сыворотки крупного рогатого скота и 50 мкг/мл гентамицина, при 37˚С в увлажненной атмосфере, содержащей 5% CO2.

Регистрация апоптоза клеток осуществлялась с помощью проточной цитофлуориметрии после окрашивания ДНК йодистым пропидием в качестве флуорохрома и измерением процента гиподиплоидных клеток на проточном цитофлуориметре-сортировщике клеток EPICS. Процент клеток в состоянии апоптоза (процент гиподиплоидных клеток со сниженной по сравнению с диплоидными флуоресценцией ДНК) подсчитывали по программе STAT PACK, анализируя флуоресценцию не менееклеток в каждом образце.
Оценка степени повреждения ДНК лейкоцитов проводилась прямым флуориметрическим методом по скорости щелочной денатурации ДНК лизатов клеток с бромистым этидием в качестве флуорофора. Интенсивность флуоресценции всех проб измеряли на флуориметре «Jasco FP 550» при длине волны возбуждения 520 нм, эмиссии 590 нм и ширине щелей 10 нм.
Концентрацию цитокинов ИЛ-10, ИЛ-12, TNF-α, ИФН-γ в сыворотке крови больных ХГ С и пациентов контрольной группы определяли методом иммуноферментного анализа. Для исследования концентрации ИЛ-10, ИЛ-12 использовались коммерческие тест-наборы фирмы «Immunotech» (Франция) и «Протеиновый контур» (Санкт-Петербург), для исследования концентрации TNF-α и ИФН-γ – тест-наборы фирмы «R&D Systems Europe» (США) и BioSource (ФРГ). Исследование осуществлялось в лаборатории патологии эритрона клиники химиотерапии лейкозов ГНЦ РАМН вед. н. с., к. б.н. и вед. н. с. ГНЦ РАМН, д. б.н. .
Статистическая обработка данных
Статистическую обработку результатов проводили с помощью компьютерной обработки данных в программе Microcal Origin 5,0. Результаты представлены в виде средних значений ± ошибка среднего. Достоверность различия двух средних оценивали с помощью теста One-Way ANOVA. Уровень значимости менее 0,05 рассматривали как статистически значимый.
РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ
Анализ основных клинико-лабораторных показателей исследованной группы больных
Результаты биохимического анализа крови показали, что активность сывороточных трансаминаз в этой группе была нормальной или почти нормальной (< 1,5 норм) у 12 больных, незначительно повышенной (1,5 -3 нормы) у 9 и умеренно повышенной (3-5 норм) у 5. Мы обнаружили наличие значимой корреляции уровня сывороточных трансаминаз и тяжести гистологических проявлений гепатита у обследованных пациентов (r=0,6, p=0,002 для связи ИГА с АСТ, r=0,4, p=0,03 для связи ИГА с АЛТ).
При гистологическом исследовании биопсийных препаратов печени 106 обследованных больных хроническим вирусным гепатитом (24 пациента с ХГ В и 82 с ХГ С) выявлены признаки, подтверждающие диагноз ХГ: очаговая лимфо-гистиоцитарная инфильтрация склерозированных портальных полей, минимальные или умеренные дистрофические изменения гепатоцитов и некроз гепатоцитов. Активность гепатита была минимальной у,9%) больных, низкой у,8%) больных, умеренной у,5%) и высокой у 7 (6,8%) больных. У 30 из ,3%) пациентов признаки фиброза отсутствовали, у,5%) обнаружен слабый фиброз, у,7%) - умеренный фиброз, и у 9 (8,5%) больных - тяжелый фиброз.
У 3 из%) больных ХГ В и 6 из%) больных ХГ С выявлена жировая дистрофия гепатоцитов, у 18 из%) больных обеих групп – слабо или умеренно выраженный деструктивный холангит.
В зависимости от тяжести патоморфологических изменений обследованные больные были разделены на две группы: в первую вошли лица с минимальной и слабовыраженной активностью процесса (ИГА по R. G. Knodell – 1-8), а во вторую – с ХГ умеренной и высокой активностью (ИГА 9-15). У больных второй группы наблюдались достоверно более высокие уровни сывороточных трансаминаз, а также более тяжелая степень фиброза (табл. 1).
Таблица 1. Характеристика больных хроническим вирусным гепатитом по степени тяжести заболевания
Исследуемый показатель | Группа больных ХГ В и С | |
С минимальной и низкой активностью ХГ (ИГА 1-8), n=73 | Со средней и высокой активностью (ИГА 9-15), n=33 | |
ИГА (исключая фиброз) | 6,4±1,1 | 11,3±2,4* |
Фиброз | 0,9±0,3 | 1,8±0,6* |
АЛТ, ед/л | 80,9±14,5 | 172,0±60,0* |
АСТ, ед/л | 57,0±9,7 | 119,4±29,6* |
* p<0,05
При сравнении тяжести гистологических изменений в печени больных ХГ В и ХГ С обнаружено, что исследованные больные ХГ В имели достоверно более высокий уровень ИГА по сравнению с группой больных ХГ С: 7,8±0,6 и 5,3±1,1 (р=0,03), соответственно, главным образом за счет таких параметров, как внутридольковый некроз и воспаление портальных трактов. Степень фиброза у обследованных больных ХГ В также достоверно превышала таковую у больных ХГ С (табл. 2).
Таблица 2. Сравнительный анализ тяжести гистологических изменений в печени больных при хроническом гепатите В и С по Knodell
Исследуемый показатель | Хронический гепатит В | Хронический гепатит С |
ИГА | 7,8±0,6 | 5,3±1,1* |
Перипортальный некроз | 1,2±0,3 | 1,0±0,1 |
Внутридольковый некроз | 2,5±0,3 | 1,6±0,4* |
Портальное воспаление | 3,8±0,3 | 2,5±0,4* |
Фиброз | 1,5±0,3 | 0,8±0,2* |
* - различия между гепатитом В и С достоверны, р<0,05
По другим параметрам, таким как возраст, уровень сывороточных трансаминаз, наличие жировой дистрофии и деструктивного холангита, среди больных двух исследованных групп достоверных отличий выявлено не было.
Исследование уровня апоптоза и экспрессии белков Fas и FasL в ткани печени больных хроническим гепатитом В и С
Результаты проведения реакции TUNEL на гистологических срезах биоптатов печени больных ХГ В и С неоднозначны. Так, у 9 из%) больных ХГ В не было обнаружено признаков апоптоза гепатоцитов, и лишь незначительное число клеток воспалительного инфильтрата демонстрировало положительное окрашивание с помощью метода TUNEL. На рис. 1В представлен препарат биоптата печени больного ХГ В, у которого отсутствуют апоптотические изменения в гепатоцитах. Кроме того, в препарате отсутствует и слабое окрашивание ядер, наблюдаемое в норме, и они выглядят "пустыми" при исследовании с помощью флуоресцентной микроскопии. У трех больных ХГ В наблюдался достаточно высокий TUNEL-индекс как гепатоцитов, так и клеток инфильтрата (в среднем 30% клеток были TUNEL-положительными). На рис. 1А представлен препарат биоптата печени больного ХГ В с высоким уровнем апоптоза гепатоцитов. Ядра TUNEL-положительных клеток имеют интенсивную зеленую флуоресценцию по периферии ядра и частично - в ядерном матриксе. При докрашивании препарата флуорофором Хехст 33258 в ядрах клеток наблюдались признаки прикраевой конденсации хроматина.
При проведении реакции TUNEL на препаратах печени больных ХГ С наблюдалась иная картина. У большинства больных (9 из 14) TUNEL-индекс колебался от 30 до 65%. Интересно, что значительное количество клеток лимфогистиоцитарного инфильтрата также находилось в состоянии апоптоза (в среднем 52%). Рис. 1Б демонстрирует препарат биоптата печени больного ХГ С с высоким уровнем апоптоза гепатоцитов и клеток воспалительного инфильтрата. У 4 больных с сопутствующей жировой дистрофией гепатоцитов было отмечено отсутствие TUNEL-положительного сигнала (наблюдаемая картина представлена на рис. 1Г). Следует обратить внимание на то, что в этих препаратах, также как и в препаратах биоптатов печени больных ХГ В с отсутствием TUNEL-положительного сигнала также отсутствуют ядра с тонким четким окрашиванием ядерной мембраны, которые наблюдаются в норме.
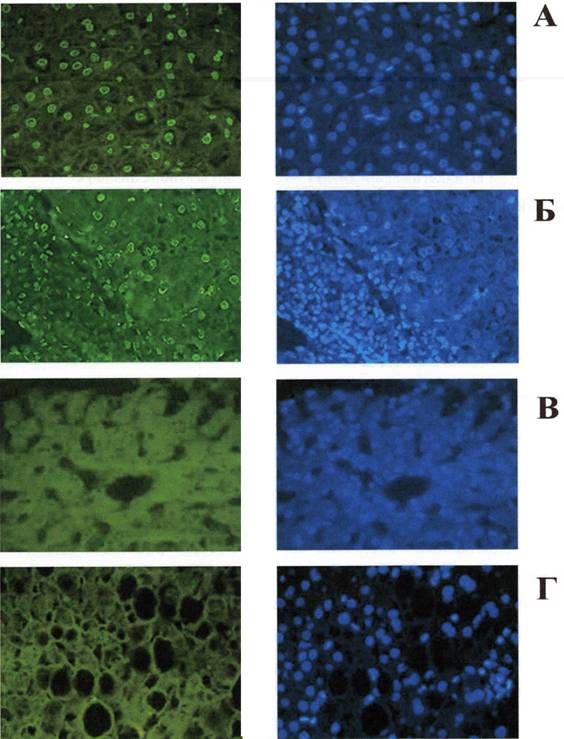
Рисунок 1. Апоптоз гепатоцитов и клеток лимфогистиоцитарного инфильтрата при хронических вирусных гепатитах: апоптоз гепатоцитов при хроническом гепатите В (А); гепатоцитов и клеток лимфогистиоцитарного инфильтрата при хроническом гепатите С (Б); наблюдение отсутствия апоптоза гепатоцитов при хроническом гепатите В (В); жировая дистрофия гепатоцитов при хроническом гепатите С (Г).
При сравнении результатов окрашивания по методу TUNEL образцов печеночной ткани больных ХГ В и С обнаружены значительные различия (табл. 3).
Таблица 3. Уровень апоптоза (количество TUNEL-положительных клеток) гепатоцитов и клеток лимфогистиоцитарного инфильтрата в биоптатах печени при хронических гепатитах В и С
Исследуемая группа | Уровень апоптоза, % | |
Гепатоциты | Клетки инфильтрата | |
Хронический гепатит В | 7,6±4,3 | 11,2±1,8 |
Хронический гепатит С | 32,0±7,1* | 22,2±3,5* |
* различия между гепатитом В и С достоверны, р<0.05
Оказалось, что при ХГ С уровень апоптоза и гепатоцитов, и клеток лимфогистиоцитарного инфильтрата достоверно выше, чем при ХГ В. Вместе с тем при сравнении тяжести гистологических изменений при ХГ В и С по таким показателям, как ИГА, уровень перипортального и особенно внутридолькового некроза, воспаления портального тракта и фиброза при ХГ В в исследованной группе имели место более тяжелые изменения, чем при ХГ С.
При анализе уровня апоптоза гепатоцитов у больных ХГ В и С в зависимости от степени тяжести хронического гепатита было обнаружено, что у больных с умеренной активностью гепатита (ИГА 9-12) наблюдались более высокие значения апоптоза гепатоцитов по сравнению с группой больных с минимальной и легкой степенью активности вирусного гепатита (ИГА 1-8, табл. 4).
Таблица 4. Уровень апоптоза гепатоцитов в зависимости от гистологической активности воспаления при хронических гепатитах В и С
Тяжесть гистологических изменений в печени (ИГА по Knodell) | УровеньTUNEL-положительных гепатоцитов в биоптатах печени, % | |
Больные ХГ В (n=12) | Больные ХГ С (n=14) | |
Низкая степень гистологической активности (ИГА 1-8) | 4,3 ± 4,3 | 27,4 ± 9,6* |
Умеренная степень гистологической активности (ИГА 9-12) | 10,8 ± 7,6 | 43,5 ± 4,6* |
* различия между гепатитом В и С достоверны, p < 0,05
Результаты проведенных исследований свидетельствуют о том, что у пациентов с ХГ В и С значительное количество клеток печени являются TUNEL-положительными, что свидетельствует о наличии в ДНК свободных 3`-ОН-концов и, следовательно, повреждении ДНК, что обычно интерпретируется как состояние апоптоза. При сравнении уровня апоптоза клеток печени у исследованной группы больных обнаружено, что уровень TUNEL положительных гепатоцитов и клеток лимфогистиоцитарного инфильтрата у больных ХГ С достоверно превышает значения такового в печени больных ХГ В. Кроме того, обнаружено, что у больных с умеренной степенью гистологических изменений уровень апоптоза клеток печени значительно превышает уровень TUNEL-положительных гепатоцитов у пациентов с минимальной и низкой активностью гепатита.
Полученные данные о значительном количестве гепатоцитов в состоянии апоптоза (от 12 до 65%) у больных ХГ В и С изменяют сложившееся ранее представление о некрозе как об основной форме гибели клеток печени при этих заболеваниях и подчеркивают важную роль апоптоза в патогенезе хронических вирусных гепатитов. Обнаруженное нами значительное количество клеток печени в состоянии апоптоза, как уже отмечалось, скорее всего представляет собой следствие не цитопатического действия вирусов, а результат повреждения гепатоцитов при взаимодействии Fas-антигена клетки-мишени и Fas-лиганда активированного Т-лимфоцита. Чтобы оценить возможную роль этой системы в поражении клеток печени при хронических вирусных гепатитах, мы исследовали уровень экспрессии белков Fas и FasL на гепатоцитах и клетках лимфогистиоцитарного инфильтрата.
При оценке результатов иммуногистохимического окрашивания мы выделяли, как и ранее, два типа клеток в ткани: гепатоциты и клетки лимфогистиоцитарного инфильтрата. При этом отдельно оценивали уровень экспрессии белков Fas и FasL гепатоцитами вблизи портального тракта и вблизи центральной вены. Необходимо отметить, что достоверных отличий в степени экспрессии Fas и FasL перицентральными и перипортальными гепатоцитами выявлено не было, в связи с чем мы приводим усредненный показатель экспрессии исследуемых белков гепатоцитами. Для количественной оценки уровня экспрессии белков Fas и FasL были введены такие показатели как Fas-индекс и FasL-индекс, отражающие долю окрашенных и, следовательно, экспрессирующих антиген клеток.
В результате проведенных исследований во всех контрольных биоптатах печени (n=8) была обнаружена экспрессия Fas-антигена. На рис. 2А, слева представлен участок паренхимы печени пациента, оперированного по поводу стеноза портальной вены. Как видно, более 60% гепатоцитов экспрессирует Fas (Fas-индекс = 3) в цитоплазме. Кроме того, наблюдается ярко выраженная экспрессия Fas в виде зерен (гранул) в цитоплазме гепатоцитов, окружающих центральную вену. Аналогичную картину наблюдали в других исследованных контрольных образцах. Средний Fas-индекс составил 2,3±0,1.
При исследовании образцов ткани печени из группы сравнения экспрессии FasL практически не обнаружено (рис. 2А справа).
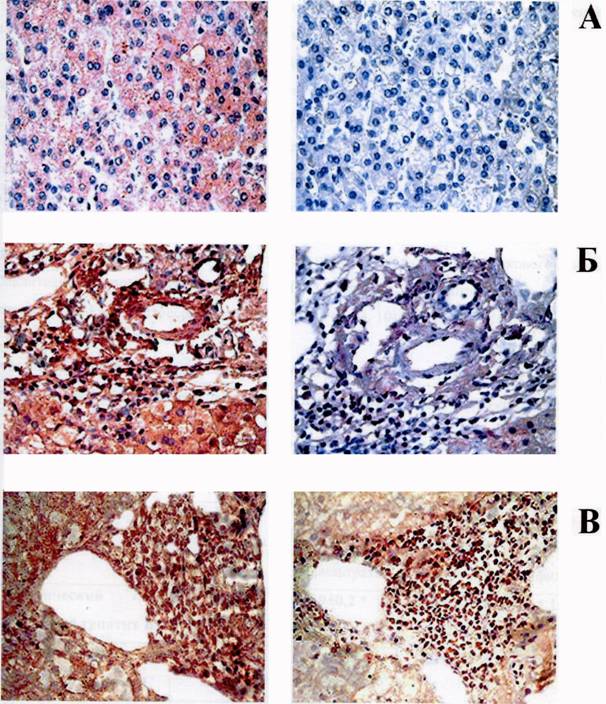
Рисунок 2. Экспрессия Fas и FasL гепатоцитами и клетками лимфоцитарного инфильтрата при хронических гепатитах В и С: нормальная печень (А); лимфогистиоцитарный инфильтрат при хроническом гепатите В (Б); лимфогистиоцитарный инфильтрат при хроническом гепатите С (В). Слева – окрашивание антителами к Fas, справа - к FasL, увеличение х 400.
Так же как и при исследовании контрольных образцов, на всех препаратах биоптатов печени больных ХГ В и С была обнаружена выраженная экспрессия Fas (рис. 2 Б, В слева). Гепатоциты больных экспрессируют Fas главным образом в цитоплазме, иногда в виде зерен, и частично на мембране, причем примерно в равной степени как в перипортальной области, так и внутри дольки, вблизи центральной вены. Выраженная экспрессия Fas обнаружена среди клеток воспалительного инфильтрата (рис. 2 Б, В слева).
При подсчете Fas-положительных клеток показано, что уровень экспрессии Fas на гепатоцитах больных ХГ В и С достоверно не различался, в отличие от такового для клеток воспалительного инфильтрата: при ХГ С клетки воспалительного инфильтрата экспрессируют Fas в достоверно большей степени (табл. 5.).
Таблица 5. Уровень экспрессии белков Fas и FasL на гепатоцитах и клетках лимфогистиоцитарного инфильтрата в биоптатах печени при хронических гепатитах В и С
N | Исследуемая группа | Уровень экспрессии, усл. ед. | |||
Fas | FasL | ||||
(А) Гепатоциты | (В) Клетки инфильтрата | (А) Гепатоциты | (В) Клетки инфильтрата | ||
1 | Хронический гепатит В | 2,3±0,2 | 0,9±0,2 * | 0,8±0,1 *** | 1,1±0,3 |
2 | Хронический гепатит С | 2,1±0,2 | 2,3±0,2 ** | 1,0±0,2 *** | 2,5±0,2 *; ** |
3 | Контрольная группа (группа сравнения) | 2,3±0,1 | инфильтрат отсутствует | 0,2±0,1 | инфильтрат отсутствует |
* - отличие в экспрессии антигена на гепатоцитах и клетках воспалительного инфильтрата внутри одной исследуемой группы, р А-В < 0.05
** - отличие в экспрессии антигена на клетках одного типа между группами больных с ХГ В и С, р 1-2 < 0.05
*** - отличие в экспрессии антигена при ХВГ от нормы, р 1-3, 2-3 < 0.05
Экспрессия FasL обнаружена на гепатоцитах (примерно в равной степени на гепатоцитах больных ХГ В и С) и на клетках воспалительного инфильтрата. Уровень экспрессии FasL на клетках инфильтрата при ХГ В был очень низким, а при ХГ С - высоким (рис. 2 Б, В справа, табл. 5.). При сравнении степени экспрессии Fas и FasL на клетках печени больных хроническим вирусным гепатитом и контрольных образцах показано, что гепатоциты больных и здоровых людей в равной степени экспрессируют Fas, однако в здоровой печени экспрессия Fas часто обнаруживается в виде цитоплазматических гранул. В то же время гепатоциты больных в незначительной степени экспрессируют FasL, в отличие от нормальной печени, где исследованный маркер, как правило, не обнаруживался (рис. 2 А справа, табл. 5). Экспрессия FasL наблюдалась также на клетках воспалительного внутрипеченочного инфильтрата.
При сопоставлении уровня апоптоза гепатоцитов с результатами иммуногистохимического исследования уровня экспрессии FasL клетками печени обнаружены следующие взаимосвязи:
1) прямая, статистически значимая корреляция уровня апоптоза гепатоцитов больных ХГ В и С с уровнем экспрессии FasL клетками лимфогистиоцитарного инфильтрата (r= 0.5, p=0.04);
2) обратная корреляция уровня апоптоза гепатоцитов с уровнем экспрессии FasL гепатоцитами (r= - 0.5, p=0.01).
Эти данные подтверждают роль белка FasL лимфоцитов инфильтрата в индукции апоптоза гепатоцитов, а также указывают на защитную роль экспрессии FasL гепатоцитов от индукции апоптоза, индуцированного лимфоцитами инфильтрата.
Необходимо отметить, что значимой корреляции уровня апоптоза гепатоцитов и уровня экспрессии Fas и FasL ни с ИГА, ни со степенью фиброза у исследованной группы больных выявлено не было. В то же время при сопоставлении результатов исследования уровня апоптоза клеток печени и уровня экспрессии в них Fas и FasL с наличием жировой дистрофии гепатоцитов обнаружены:
1) обратная корреляция уровня апоптоза гепатоцитов больных ХГ В и С с наличием жировой дистрофии гепатоцитов (p=0,03, рис. 3А), особенно в группе больных с ХГ С (p=0.002);
2) прямая корреляция уровня экспрессии FasL на гепатоцитах и наличием жировой дистрофии гепатоцитов (p=0,045; рис. 3Б).
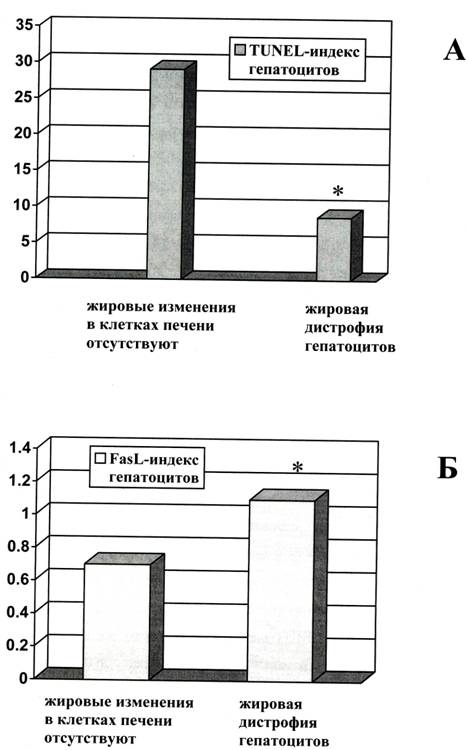
Рисунок 3. Связь уровня апоптоза гепатоцитов (TUNEL-индекс,%, А) и уровня экспрессии FasL на гепатоцитах (FasL-индекс, усл. ед., Б) больных хроническими гепатитами В и С с наличием жировой дистрофии гепатоцитов.
* - различия достоверны, p<0,05
Исследование уровня апоптоза в сравнении со степенью повреждения ДНК в мононуклеарных и полиморфноядерных лейкоцитах периферической крови больных хроническими гепатитами В и С
Результаты исследования уровня апоптоза мононуклеарных и полиморфноядерных ЛПК 58 больных ХГ В и С и 15 здоровых добровольцев в качестве группы сравнения представлены на рисунках 4-5. Обнаружено, что количество клеток обоих типов в состоянии апоптоза у больных ХГ достоверно превышает значения такового в контрольной группе как непосредственно после выделения, так и после инкубации в течение суток. При этом доля свежевыделенных лимфоцитов в состоянии апоптоза составила 1,2 ± 0,2% у здоровых доноров и 7,7 ± 1,3% у больных хроническим вирусным гепатитом (р < 0,05), а гранулоцитов - 9,2 ± 1,6% и 15,3 ± 1,8% (р < 0,05), соответственно. Доля клеток в состоянии апоптоза после инкубации в течение 24 часов in vitro в питательной среде составила 3,6 ± 0,7% и 15,4 ± 2,4% (р < 0,05) для лимфоцитов здоровых и больных, соответственно и 22,0±3,0% и 36,2±3,2% (р < 0,05) для гранулоцитов здоровых и больных, соответственно.
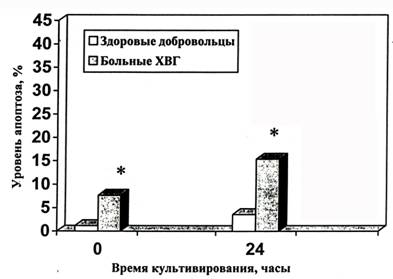
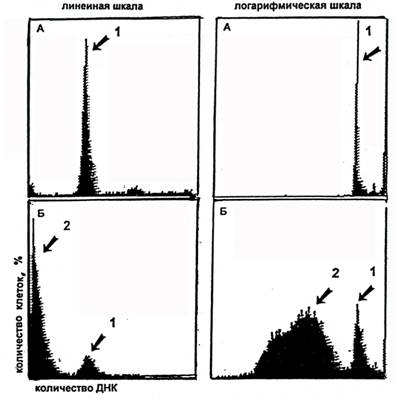
Рисунок 4. Динамика апоптоза лимфоцитов периферической крови здоровых добровольцев и больных хроническим вирусным гепатитом непосредственно после выделения и через 24 ч инкубации в культуральной среде
* - отличия от контроля, p<0,05
Рисунок 5. Анализ апоптоза методом проточной цитофлуориметрии в гранулоцитах периферической крови здорового добровольца (А) и больного хроническим гепатитом С (Б) через 24 ч инкубации клеток в культуральной среде. Гистограмма, отражающая клеточный цикл гранулоцитов. По оси абсцисс – интенсивность флуоресценции, по оси ординат – количество клеток. 1 – пик диплоидной ДНК, соответствует фазе G0/G1 клеточного цикла, 2 – пик гиподиплоидной ДНК, соответствует клеткам в состоянии апоптоза.
Для исследования структуры ДНК лейкоцитов периферической крови использовался метод определения скорости щелочной денатурации ДНК лизатов клеток. Измеряемый показатель D обратно пропорционален количеству однонитевых разрывов и/или щелочелабильных сайтов в ДНК клеток, и таким образом позволяет судить о целостности нативной ДНК. Величина D тем выше, чем меньше повреждений содержит ДНК клеток. Как видно из таблицы 6, скорость щелочной денатурации ДНК лимфоцитов и гранулоцитов периферической крови общей группы исследованных больных увеличена в сравнении с нормой, что свидетельствует о наличии значительного уровня повреждений ДНК этих клеток.
Таблица 6. Скорость щелочной денатурации ДНК, D, лейкоцитов периферической крови здоровых доноров и больных хроническими гепатитами В и С
Исследуемая группа | Скорость щелочной денатурации ДНК, D, усл. ед. | |
Лимфоциты | Гранулоциты | |
Здоровые доноры, n=15 | 85,5 ± 2,3 | 85,8 ± 1,8 |
Больные ХГ, n=34 | 80,9 ± 3,2 | 72,7 ± 4,6* |
А: ХГ В, n=12 ХГ С, n=22 | 80,2±2,2 81,3±4,9 | 72,8±6,6* 72,7±5,9 |
Б: цирроз, n=12 ХГ, n=22 | 79,7±6,4 81,5±3,7 | 78,1±8,7 70,3±5,5* |
* - отличия от контроля достоверны, р < 0,05
Обнаружено, что доля свежевыделенных ЛПК в состоянии апоптоза пропорциональна увеличению степени повреждения ДНК этих клеток, но эта зависимость была статистически малозначимой (r= - 0,2, р=0,33 для лимфоцитов и r= - 0,02, р=0,88 для гранулоцитов). В то же время доля ЛПК в состоянии апоптоза после инкубации в питательной среде в течение 24 часов с высокой значимостью коррелировала со степенью повреждения ДНК свежевыделенных лимфоцитов и гранулоцитов (r= - 0,3, р=0,03 для лимфоцитов и r= - 0,4, р=0,004 для гранулоцитов). Полученные нами результаты свидетельствуют о том, что регистрация однонитевых разрывов ДНК является тестом для выявления клеток на ранних стадиях апоптоза. Регистрируемое по увеличению скорости щелочной денатурации ДНК накопление повреждений ДНК в значительной мере определяется не столько появлением в периферическом русле клеток в состоянии апоптоза, сколько клеток, коммитированных к апоптозу, находящихся на самых ранних стадиях этого процесса.
При проведении экспериментов по определению уровня апоптоза ЛПК больных хроническим вирусным гепатитом у части больных из исследованной нами группы (88 из 130) совместно с докторантом кафедры пропедевтики внутренних болезней ММА им. и аспирантами кафедры и были исследованы уровни сывороточных цитокинов (ИЛ-10, ИЛ-12, TNF-α, ИФН-γ) с помощью иммуноферментного метода. Из исследованной группы пациентов ХГ В диагностирован только у 4, поэтому они не были включены в обработку полученных результатов. Таким образом, приведенные ниже результаты относятся только к больным ХГ С.
Анализ уровня апоптоза ЛПК в сравнении с уровнем сывороточных цитокинов у больных ХГ С. При определении концентрации цитокинов в сыворотке крови достоверное отличие от группы контроля (p<0,05) было получено для TNF-α и ИФН-γ (рис. 6). Различие между группами ХГ С и ХВАГ было недостоверным. Не было получено достоверных отличий по сравнению с группой контроля сывороточных концентраций ИЛ-10 и ИЛ-12.
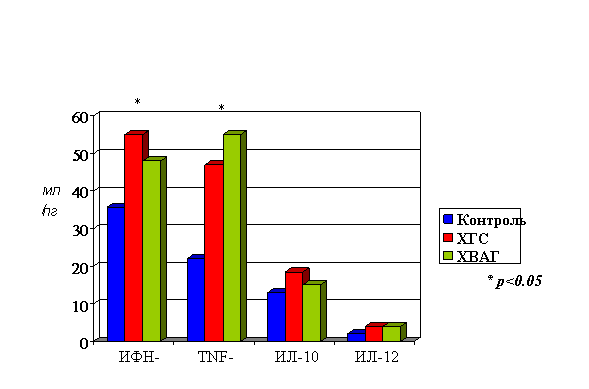

Рисунок 6. Концентрация сывороточных цитокинов у больных хроническим гепатитом С, хроническим вирусно-алкогольным гепатитом и группы контроля до лечения
Сопоставление уровня апоптоза ЛПК с сывороточной концентрацией TNF-α представляет особый интерес в связи с провоспалительной и проапоптотической функцией последнего. При проведении корреляционного анализа взаимосвязи уровня сывороточного TNF-α и уровня апоптоза ЛПК у исследованных больных было обнаружено, что уровень апоптоза свежевыделенных клеток пропорционален концентрации TNF-α, но эта зависимость была статистически малозначимой (r=0,04, р=0,89 для лимфоцитов и r=0,3, р=0,27 для гранулоцитов, рис. 7А и 8А). В то же время уровень апоптоза ЛПК больных ХВГ после 24 часов инкубации в полной питательной среде in vitro с высокой значимостью коррелирует с уровнем сывороточного TNF-α у таких больных (r=0,9, р=0,0001 для лимфоцитов и r=0,7, р=0,004 для гранулоцитов, рис. 7Б и 8Б).
Рисунок 7. Корреляция уровня апоптоза свежевыделенных лимфоцитов (А) и лимфоцитов через 24 ч инкубации в культуральной среде (Б) с уровнем TNF-α в сыворотке крови.
Рисунок. 8. Корреляция уровня апоптоза свежевыделенных гранулоцитов (А) и гранулоцитов через 24 ч инкубации в культуральной среде (Б) с уровнем TNF-α в сыворотке крови.
Достоверной связи уровня апоптоза с концентрацией других исследованных цитокинов не выявлено.
Сравнительная характеристика апоптоза лейкоцитов периферической крови у больных хроническим вирусным гепатитом и синдромом аутоиммунного перекреста
С целью установления различий в интенсивности апоптоза у больных хроническими вирусными и аутоиммунными заболеваниями печени нами выполнено сравнительный анализ апоптоза периферических лейкоцитов у больных ХГ В и С и САП (аутоиммунный гепатит + первичный билиарный цирроз). Число лейкоцитов периферической крови в состоянии спонтанного апоптоза в группе больных САП также было достоверно выше в сравнении с показателями контрольной группы (таблица 7).
Таблица 7. Уровень спонтанного апоптоза лейкоцитов периферической крови здоровых доноров и больных синдромом аутоиммунного перекреста
Больные САП, n=20 | Контроль, n=20 | |
Уровень спонтанного апоптоза,% | 9,9 ± 0,83* | 4,2 ± 0,1 |
* - отличия от контроля достоверны, р < 0,05
Сравнение средних уровней спонтанного апоптоза общей фракции лейкоцитов в группах хронического вирусного гепатита и САП продемонстрировало отсутствие достоверных различий между группами ХГ В и САП и ХГ С и САП, что указывает на общность механизмов апоптоза при вирусных и аутоиммунных поражениях печени.
Сравнительная характеристика больных хроническим гепатитом С и хроническим вирусно-алкогольным гепатитом (HCV + алкоголь)
Достоверных различий по показателям физикального исследования пациентов, клинического анализа крови, по уровням активности АЛТ и АСТ между группами больных ХГ С и ХВАГ не выявлено. В группе больных ХВАГ отмечались несколько более высокие показатели γ-глутамилтранспептидазы по сравнению с группой ХГ С (69,8±26,3 ед/л и 50,1±19,9 ед/л), не достигавшие, однако, статистически значимых различий. Также между группами отсутствовали достоверные различия по ИГА (8,2±3,1 и 8,6±4,3 балла соответственно) и индексу фиброза (1,9±0,8 и 2,1±1,1 балла соответственно, P > 0,05).
До начала лечения уровень апоптоза МЛПК был достоверно выше у больных ХГ С по сравнению с таковым в контрольной группе: 4,7±1,5 vs. 0,81+0,5%, р<0,05. Аналогичный результат получен в группе ХВАГ: уровень апоптоза мононуклеарных ЛПК составил 2,9+1,9% (рис. 9) Достоверных различий между группами ХГ С и ХВАГ не выявлено, однако имела место тенденция к несколько меньшему уровню апоптоза в группе вирусно-алкогольного гепатита. При определении концентрации цитокинов в сыворотке крови достоверное отличие от группы контроля (p<0,05) было получено для ИФН-γ и TNF-α в обеих группах пациентов (рис. 6).
Результаты комбинированной противовирусной терапии и апоптоз мононуклеаров периферической крови
54 пациентам с хронической HCV-инфекцией – ХГ С и ХВАГ – проведена комбинированная терапия ИФН-α и рибавирином (см. «Материалы и методы»). Для удобства обработки и интерпретации результатов в качестве точки оценки эффективности лечения принят срок 24 нед. Вместе с тем в соответствии с общепринятыми принципами ведения пациентов с хронической HCV-инфекцией у больных, инфицированных 1-м генотипом HCV, при снижении вирусной нагрузки на 12 нед лечения более чем в 100 раз ПВТ продлевалась до 48 нед.
У 29 пациентов (53,7%) 24-недельная комбинированная ПВТ привела к элиминации HCV РНК. Из них доля больных ХГ С составила 19 человек (65,5%), ХВАГ – 10 человек (34,5%). В группе ответивших на ПВТ наблюдалось раннее – через 2 недели после начала ПВТ – усиление апоптоза МЛПК, достоверно более выраженное в группе ХГ С по сравнению с больными ХВАГ (8,9% vs. 3,6%, p<0,05) (рис. 10). В группе пациентов с ХГ С, ответивших на ПВТ, отмечена корреляция снижения уровня вирусной нагрузки с усилением апоптоза через 2 недели комбинированной терапии (рис. 11). В группе ХВАГ подобной корреляции выявлено не было. В группе пациентов, не ответивших на комбинированную терапию, достоверного усиления апоптоза в ответ на лечение зафиксировать не удалось. Следует отметить, что первичный биохимический ответ на ПВТ отмечен у всех пациентов вне зависимости от достижения вирусологического ответа.
На фоне 24-недельной комбинированной ПВТ зафиксировано достоверное снижение сывороточной концентрации TNF-α (рис. 12). Значимой динамики уровней других определявшихся цитокинов (ИЛ-10, ИЛ-12, ИФН-γ) не отмечено.
Из общего числа больных, которым проводилась ПВТ, у 13 пациентов (24%) удалось проследить развитие устойчивого вирусологического ответа, который фиксируется через 6 мес после окончания курса ПВТ. Из них 3 больных (23%) были исходно инфицированы 2a генотипом вируса, 8 (62%) - 3a и 2 (15%) - 1b. Из числа пациентов с устойчивым вирусологическим ответом больные ХВАГ составили 4 человека (31%). У 10 пациентов (77%), ответивших на ПВТ стойкой элиминацией HCV, наблюдалось усиление апоптоза МЛПК через 2 недели лечения.
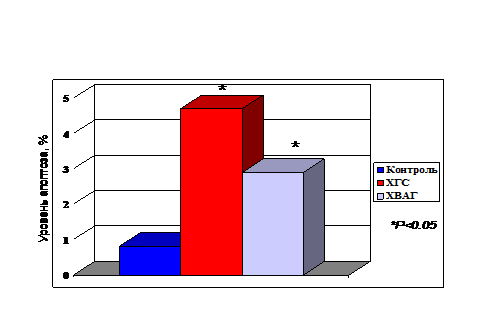
Рисунок 9. Апоптоз мононуклеарных лейкоцитов периферической крови у больных хроническим гепатитом С, хроническим вирусно-алкогольным гепатитом и группы контроля до лечения

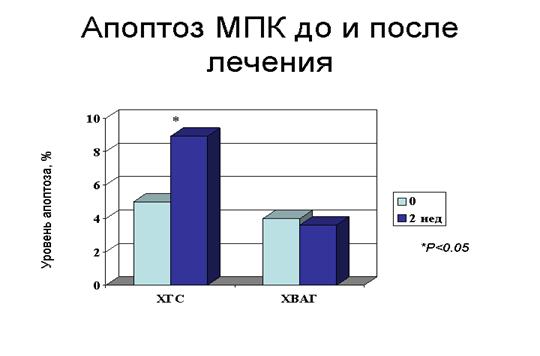
Рисунок 10. Апоптоз мононуклеарных лейкоцитов периферической крови у больных хроническим гепатитом С и хроническим вирусно-алкогольным гепатитом до лечения и через 2 нед противовирусной терапии
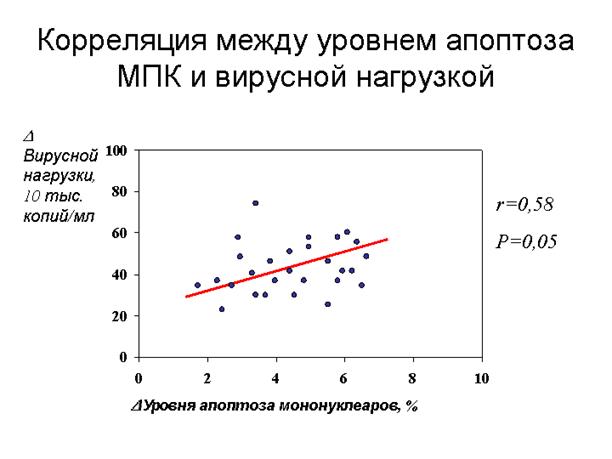
Рисунок 11. Корреляция уровня апоптоза мононуклеарных лейкоцитов периферической крови больных хроническим гепатитом С с уменьшением вирусной нагрузки через 2 нед противовирусной терапии.
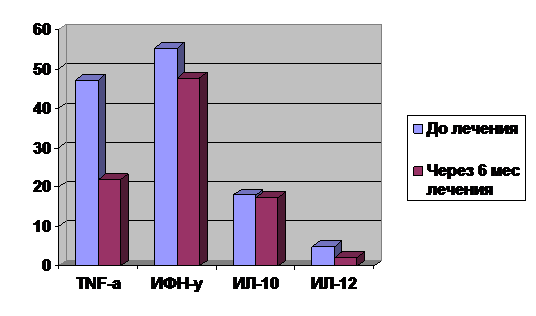
Рисунок 12. Динамика сывороточной концентрации цитокинов на фоне 24-недельной комбинированной противовирусной терапии; различия достоверны для TNF-α, p <0,05
ВЫВОДЫ
1. Апоптоз служит основным механизмом гибели как гепатоцитов, так и клеток лимфогистиоцитарного инфильтрата у больных хроническим гепатитом (ХГ) В и С, при этом доля клеток в состоянии апоптоза у больных ХГ С достоверно больше, чем у больных ХГ В.
2. Гепатоциты больных ХГ В и ХГ С, также как и гепатоциты лиц контрольной группы экспрессируют белок Fas либо в цитоплазме (диффузно или в виде гранул), либо на клеточной мембране. Количественных различий в уровне экспрессии белка Fas в гепатоцитах при ХГ В, ХГ С и в группе контроля не обнаружено.
3. В норме гепатоциты практически не экспрессируют FasL, однако его экспрессия наблюдается при ХГ В (0,8±0,1) и ХГ С (0,9±0,2). Индуцируемая вирусами экспрессия FasL приводит к появлению гепатоцитов с цитотоксическим фенотипом и служит одним из механизмов элиминации цитотоксических лимфоцитов инфицированными вирусом гепатоцитами.
4. Обнаружено, что уровень апоптоза гепатоцитов при ХГ В и С прямо пропорционален степени экспрессии FasL клетками лимфогистиоцитарного инфильтрата в печени (r=0,5, p=0,04) и обратно пропорционален уровню экспрессии FasL гепатоцитами (r=-0,5, p=0,01), что указывает на взаимодействие Fas – FasL как на ведущий механизм патогенеза хронических вирусных гепатитов.
5. Уровень апоптоза мононуклеарных и полиморфноядерных лейкоцитов периферической крови больных ХГ В и ХГ С достоверно превышает уровень апоптоза этих клеток у здоровых лиц: 7,7±1,3 и 1,2±0,2; 15,3±1,8 и 9,2±1,6, соответственно (p < 0,05). Достоверных различий между интенсивностью апоптоза при ХГ В и ХГ С не выявлено.
6. В периферической крови больных ХГ В и ХГ С присутствуют не только лейкоциты в состоянии апоптоза, но и коммитированные к нему клетки, что проявляется усилением апоптоза мононуклеарных и полиморфноядерных лейкоцитов после 24-часовой инкубации в культуральной среде.
7. У больных ХГ С достоверно повышены сывороточные концентрации ИФН-γ и TNF-α. Выявлена прямая корреляционная связь уровня апоптоза мононуклеарных и полиморфноядерных лейкоцитов периферической крови больных ХГ С и сывороточной концентрации TNF-a (r=0,9, p=0,0001; r=0,7, p=0,004, соответственно).
8. Статистически значимые различия между уровнем апоптоза лейкоцитов периферической крови у больных ХГ В и С и синдромом аутоиммунного перекреста (аутоиммунный гепатит + первичный билиарный цирроз) отсутствуют, что свидетельствует о роли апоптоза в качестве унифицированного механизма повреждения клеток.
9. Усиление апоптоза мононуклеарных лейкоцитов периферической крови у больных ХГ С через 2 нед комбинированной противовирусной терапии интерфероном-α и рибавирином служит ранним признаком элиминации вируса (корреляция с уменьшением виремии r=0,58; p=0,045).
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. Исследование апоптоза МЛПК при ХВГ представляет собой недорогую методику, позволяющую быстро и эффективно оценивать динамику течения заболевания, в том числе на фоне применения различных лекарственных препаратов.
2. Определение апоптоза МЛПК в процессе комбинированной противовирусной терапии ХГ С интерфероном-α и рибавирином дает возможность прогнозировать достижение быстрого и, соответственно, устойчивого вирусологического ответа.
3. Применение методики определения апоптоза МЛПК в процессе противовирусной терапии ХГ С нецелесообразно у пациентов с сочетанным алкогольным поражением печени.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
1. , , Ю, , Северин и повреждение ДНК лейкоцитов периферической крови у больных хроническим гепатитом // Росс. журн. гастроэнтерол. гепатол. колопроктол. – 2000. - №1 (прил. 9). - С. 25.
2. , , Северин периферических лейкоцитов при хронических HBV - и HCV-инфекциях // Росс. журн. гастроэнтерол. гепатол. колопроктол. – 2000. - № 6. - С. 33-36.
3. , , Караулов ДНК и вторичные иммунодефицитные состояния при различных заболеваниях // В сб.: «Успехи клинической иммунологии и аллергологии». Под ред. . - Т.1 - М. – 2000. - С. 38-71.
4. , , Ивашкин Fas/FasL при хронических вирусных гепатитах // Росс. журн. гастроэнтерол. гепатол. колопроктол. – 2001. - № 5 (прил.15). - С. 71.
5. , , Северин хронических вирусных гепатитов // Росс. журн. гастроэнтерол. гепатол. колопроктол. – 2001. - №5 (прил.15). - С. 76.
6. , Маммаев лимфоцитов крови у больных хроническим гепатитом С // Росс. журн. гастроэнтерол. гепатол. колопроктол. -2001. - №5 (прил.15). - С. 82.
7. , , Ивашкин механизмы повреждения печени при хроническом вирусном гепатите С (ХВГ С) // Росс. журн. гастроэнтерол. гепатол. колопроктол. – 2002. - №1 (прил.16). - С. 29.
8. , , Ивашкин активность системы мононуклеарных фагоцитов у больнных хроническими диффузными заболеваниями печени // Росс. журн. гастроэнтерол. гепатол. колопроктол. – 2002. - №1 (прил.16). - С. 29.
9. , .Л., , Креветный апоптоза и пролиферации при патологии желудочно-кишечного тракта и печени // Росс. журн. гастроэнтерол. гепатол. колопроктол. – 2002. - №6. - С.38-43.
10. , ,
, , Пальцев системы Fas/Fas-лиганд в индукции апоптоза гепатоцитов при хронических вирусных гепатитах // Арх. патол. – 2003. - Т. 65. - №6. - С. 13-16.
11. , , Ивашкин лимфоцитов периферической крови при хронических вирусных и вирусно-алкогольных гепатитах // Росс. журн. гастроэнтерол. гепатол. колопроктол. – 2005. - №1 (прил.24). – С. 10.
12. , , Ивашкин лимфоцитов периферической крови при хроническом вирусном гепатите и противовирусная терапия // Росс. журн. гастроэнтерол. гепатол. колопроктол. – 2005. - №1 (прил.24). – С. 10.
13. , , Ивашкин лейкоцитов периферической крови и цитокиновый профиль у больных хроническим гепатитом // Клинико-эпидемиологические и этно-экологические проблемы заболеваний органов пищеварения. Материалы 5-й Восточно-сибирской гастроэнтерологической конференции с международным участием. – Красноярск. – 2005. - С.183.
14. Буеверов при хронических вирусных гепатитах: от лабораторных исследований к клинической практике // Клинико-эпидемиологические и этно-экологические проблемы заболеваний органов пищеварения. Материалы 6-й Восточно-сибирской гастроэнтерологической конференции с международным участием. – Красноярск. – 2006. - С.314-325.
15. , ,
Апоптоз мононуклеаров периферической крови при хроническом гепатите С и хроническом вирусно-алкогольном гепатите // Росс. журн. гастроэнтерол. гепатол. колопроктол. – 2005. - №4. - С. 35-41.
16. , , Ивашкин моноцитов периферической крови при хроническом вирусном гепатите до и после противовирусного лечения // Росс. журн. гастроэнтерол. гепатол. колопроктол. – 2005. - №5 (прил. 25). - С. 71.
17. , Грязин аспекты изучения апоптоза при хронических вирусных гепатитах // Росс. журн. гастроэнтерол. гепатол. колопроктол. – 2006. - №2. - С. 4-10.
18. , , Шептулин мононуклеаров периферической крови и оценка эффективности противовирусной терапии хронического гепатита С // Клин. медицина. – 2006. - № 9. - С. 39-44.
19. Буеверов аспекты изучения апоптоза при хронических вирусных гепатитах // Клин. перспект. гастроэнтерол. гепатол. – 2009. - № 2. - С. 11-17.
20. , , Маевская характеристика апоптоза периферических лейкоцитов при вирусных и аутоиммунных заболеваниях печени // Росс. журн. гастроэнтерол. гепатол. колопроктол. – 2009. - №4. – С. 41-47.



