оглавление
ХРОНИЧЕСКИЕ ГЕПАТИТЫ
Вопросы классификации хронических гепатитов
Глава 2. Учение о вирусном генезе хронических диффузных заболеваний печени
Хронический гепатит вирусной этиологии
Хронический персистирующий гепатит
Хронический активный гепатит
Роль иммунных факторов в патогенезе хронических заболеваний печени
Хронический активный (аутоиммунный) гепатит
Алкогольное поражение печени
Лекарственные гепатиты
Неспецифический реактивный гепатит
Гранулематозные гепатиты
Диагноз и дифференциальный диагноз при хронических заболеваниях печени
Биохимические, функциональные и инструментальные методы исследования
Дифференциальный диагноз желтух
Пункционная биопсия печени
ЦИРРОЗЫ ПЕЧЕНИ
Морфогенез и классификация циррозов печени
Диагноз, течение и осложнения цирроза печени. Сопутствующие заболевания
Портальная гипертензия
Спленомегалия и синдром гиперспленизма
Отечно-асцитический синдром
Острое кровотечение из варикозно расширенных вен пищевода и желудка
Печеночная энцефалопатия и кома
Общие принципы терапии цирроза печени
Особенности клинической картины и лечения отдельных этиологических форм цирроза печени
Цирроз печени вирусной этиологии
Алкогольный цирроз печени
Первичный билиарный цирроз печени
Вторичный билиарный цирроз печени
Поражение печени при болезни Вильсона—Коновалова
Гемохроматоз
Недостаточность альфа1-антитрипсина
Цирроз печени при саркоидозе
Поражение печени при болезни Ослера—Рандю
Печень при острой и хронической недостаточности кровообращения
Цирроз-рак печени
ЗАКЛЮЧЕНИЕ
ЧАСТЬ 1
ХРОНИЧЕСКИЕ ГЕПАТИТЫ
Глава 1
Вопросы классификации хронических гепатитов
Период современной научной систематизации хронических гепатитов составляет немногим более 15 лет. Начало ему было положено схемой, предложенной в 1967 г. группой европейских и американских гепатологов [Groote D. et al., 1968], предельно краткой, но охватывавшей наиболее важные морфологические проявления гепатита. Согласно этой классификации, все хронические гепатиты безотносительно к этиологии подразделялись по морфологическому и вместе с тем прогностическому признаку отсутствия или наличия прогредиентности (т. е. тенденции прогрессирования в цирроз печени) на хронический персистирующий гепатит (ХПГ) и хронический активный (морфологический термин—«агрессивный») гепатит (ХАГ). В группе ХАГ были выделены подгруппы А и В — ХАГ с умеренной и ХАГ с выраженной активностью воспалительного процесса, а позднее неблагоприятно протекающая форма некро тизирующего ХАГ.
Данная классификация основывалась на наиболее достоверных морфологических критериях диагноза в связи с частым несоответствием клинико-биохимических данных морфологической картине. Недостаток ее состоял в том, что почти полностью был игнорирован этиологический фактор, который в значительной степени определяет течение заболевания и особенности его терапии. Так, например, при ХАГ вирусной этиологии лечение кортикостероидами в большинстве случаев не показано; при ХАГ аутоиммунной этиологии оно является средством выбора; при ХАГ, обусловленной болезнью Вильсона — Коновалова, таким средством служит D-пеницилламин, а при алкогольном ХАГ основой терапии является полное воздержание от употребления алкоголя. Классификация была также недостаточно полной: она не включала хронический холестатический гепатит, гранулематозные поражения печени и обширную группу хронических неспецифических реактивных гепатитов. Наконец, в классификации ХПГ и ХАГ рассматривались как самодовлеющие, взаимоисключающие варианты хронического гепатита. Между тем позднее выяснилось, что у одного и того же больного хронический гепатит определенной этиологии на разных этапах его эволюции — спонтанной или индуцированной терапией может протекать в морфологической форме ХАГ с различной степенью активности, ХПГ или даже неспецифического реактивного гепатита.
Основные этиологические формы хронических гепатитов
|
Этиологические формы |
Клинико-морфологические эволютивные формы |
|
1. Хронический гепатит вирусной этиологии |
Активный (ХАГ вирусной этиологии); |
|
ХАГ с резко выраженной активностью; некротизирующая форма ХАГ; ХАГ с внутрипеченочным холестазом (холангиолитическая форма); | |
|
ХАГ с умеренной активностью; | |
|
ХАГ на стадии ремиссии (с морфологической картиной ХПГ или НРГ); | |
|
персистирующий (ХПГ); | |
|
неспецифически-реактивный (НРГ) (при бессимптомном вирусоносительстве) | |
|
2. Хронический активный (ау- |
Стадия обострения; стадия ремиссии |
|
тоиммунный) гепатит | |
|
3. Хронический алкогольный гепатит |
На фоне жировой печени или без нее; с морфологической картиной НРГ, ХПГ, ХАГ; в сочетании с фиброзом печени, внутрипеченочным холестазом или острым алкогольным гепатитом |
|
4. Хронический холестатический гепатит |
Предстадия ПБЦ |
|
5. Хронический лекарственный гепатит |
С морфологической картиной НРГ, жировой печени, ХПГ или ХАГ |
|
6. Хронический гепатит при болезни Вильсона — Коновалова |
С морфологической картиной НРГ, жировой печени, ХПГ или ХАГ |
|
7. Хронический гепатит при недостаточности a1-анти-трипсина |
ХАГ; ХАГ с внутрипеченочным холестазом |
|
8. Хронические гепатиты реактивного характера |
Неспецифический реактивный гепатит (НРГ); хронический гранулематозный ге патит |
В новом варианте классификации болезней печени и желчных путей, принятом в 1974 г. в г. Акапулько (Мексика), Международным обществом по изучению заболеваний печени [Логинов А. С., 1977; Levy С., Tygstrup N., 1976] выделяются и наиболее распространенные, и сравнительно редкие этиологические формы острого гепатита. В отношении хронических гепатитов классификация сохраняет подразделение на ХПГ и ХАГ с определением, где это возможно, этиологического фактора.
С нашей точки зрения, наиболее целесообразно для клинической практики является классификация, построенная по этиологическому принципу с учетом внутри каждой этиологической единицы всех возможных эволютивных форм гепатита, определяемых степенью активности патологического процесса.
Хронические гепатиты, во всех случаях являющиеся пред-
стадией цирроза печени (хронический холестатический гепатит, хронические гепатиты при болезни Вильсона — Коновалова и при недостаточности сц-антитрипсина), рассматриваются нами в разделе «Циррозы печени».
Глава 2. Учение о вирусном генезе хронических диффузных заболеваний печени
Наиболее распространенной формой хронического гепатита является хронический гепатит вирусной этиологии [, 1965]. Он составляет до 67% всех форм хронических гепатитов [Eriinger S., Degott С., 1979]; около 5% населения земного шара инфицированы возбудителем гепатита В [Hoofnagle J., 1983]. Ежегодно во всем мире острым вирусным гепатитом (ОВГ) заболевают более 2 млн. человек, причем у 1/10 части из них болезнь становится хронической, сопровождаясь развитием ХПГ, ХАГ, цирроза печени или в ряде случаев гепато целлюлярного рака печени [Deinhardt F., 1982]. Вирусный (постгепатитный) цирроз печени также является одной из наиболее распространенных форм цирроза, уступая по частоте развития в некоторых промышленно развитых странах только алкогольному циррозу печени [, 1976].
Высокая частота хронических гепатитов и циррозов печени вирусной этиологии обусловлена чрезвычайной распространенностью гепатотропной вирусной инфекции, особенно в тропических и субтропических регионах, где до 20—30% населения инфицированы вирусом гепатита В [, 1984; Prince А. М., 1982]. Число носителей во всем мире только поверхностного антигена вируса гепатита В составляет около 200 млн. человек [Aach R., 1982]. Однако в Европе и Северной Америке частота вирусоносительства не превышает 0,1—1% [цит. по и др., 1983].
Хроническое течение могут приобретать гепатиты, вызываемые вирусами В и ни А ни В. Острые гепатиты, возбудителями которых являются вирусы А, Коксаки, вирусы цитомегалии, мононуклеоза (вирус Эпстайна—Барра), желтой и других гемморагических лихорадок, простого герпеса, эпидемического паротита, краснухи, кори, а также гепатиты, обусловленные бактериальной и грибковой инфекциями, риккетсиями и простейшими, в хроническую форму не переходят, хотя в редких случаях могут протекать тяжело с развитием массивных не крозов печени, печеночной недостаточности и комы.
Клинические проявления хронических активных гепатитов любой этиологии на стадии обострения сходны с клинической картиной ОВГ, поэтому такие больные часто госпитализируются в инфекционный стационар с предположительным диагнозом: болезнь Боткина. Как при острых, так и при обострении хронических гепатитов наблюдаются общая слабость, сонливость, лихорадка, диспепсические явления (снижение аппетита, тошнота, метеоризм, нарушения стула), боли в животе, особенно в области правого подреберья, зуд кожи, гриппопо добные симптомы, разнообразная кожная сыпь, потемнение мочи и осветление стула, желтушное окрашивание слизистых оболочек и кожи. Общими могут быть и некоторые лабораторные данные: умеренная анемия и гранулоцитопения, лимфоци тоз, билирубинурия и уробилинурия, билирубинемия с преимущественным повышением конъюгированной (прямой) фракции, признаки внутрипеченочного холестаза с подъемом активности щелочной фосфатазы крови; при тяжелых (фульминантных) формах острого гепатита и при распространенных некрозах печени у больных ХАГ — снижение протромбинового индекса и развитие печеночной энцефалопатии.
Общие черты обусловлены развивающимися и при ОВГ, и при обострении хронического гепатита некрозами гепатоцитов. Наиболее существенным отличием является цикличное, ограниченное во времени течение ОВГ с фазами инкубации, генерализации, органных проявлений (собственно поражения печени) и реконвалесценции, а также прогредиентное течение хронического гепатита. Типичная форма ОВГ отличается от хронического гепатита значительно более высоким подъемом активности аминотрансфераз, отражающим нерезко выраженное, но тотальное поражение паренхимы печени. Высокий уровень активности ферментов при ОВГ отражает эффективность иммунной реакции организма, направленной на элиминацию инфицированных вирусом клеток печени, и у подавляющего большинства больных свидетельствует о благоприятном прогнозе. При хроническом гепатите, напротив, высокая активность аминотрансфераз крови всегда является неблагоприятным показателем прогрессирования патологического процесса.
Важной особенностью ОВГ является также отсутствие у большинства больных гипоальбуминемии, диспротеинемии, спленомегалии и значительного уплотнения печени, исчезновение лихорадки, часто улучшение самочувствия в желтушном периоде (что, очевидно, связано с элиминацией возбудителя), и, что особенно важно, закономерное появление в крови при ОВГ типа А или В антигенных детерминант (маркеров) возбудителя гепатита и исчезновение их в период реконвалесценции.
Клинические наблюдения и ранее свидетельствовали о наличии двух типов гепатитов с морфологически идентичными изменениями в печени: первого типа — с коротким инкубационным периодом, высокой контагиозностью и фекально-ораль ной передачей инфекции (гепатит А по современной терминологии) и второго типа — с более длительной инкубацией и меньшей контагиозностью и преимущественно парентеральной передачей инфекции (гепатит В). В 1963 г. В. S. Blumberg и соавт. обнаружили в крови австралийского аборигена антигенную субстанцию, ассоциированную, как выяснилось в дальнейшем, с возбудителем гепатита В, т. е. гепатита с длительным инкубационным периодом. Доказательством послужило наличие антигена у больных с высоким уровнем активности аминотрансфераз и с безжелтушными формами гепатитов. Далее была показана значительная распространенность австралийского антигена у больных лейкемией и у больных с синдромом Дауна, живущих в больших пансионатах. Это открытие положило начало детальной идентификации структуры и свойств вируса — возбудителя ОВГ-В, полный вирион которого (частица Дане) был описан D. Dane и соавт. в 1970 г. Далее было показано, что третий тип ОВГ— гепатит ни А ни В (гепатит С), серологические маркеры которого еще не идентифицированы, имеет не менее двух возбудителей и является наиболее частой формой посттрансфузионно го гепатита. В 1973 г. были открыты возбудитель гепатита А и специфические антитела, обеспечивающие надежную серологическую диагностику этого типа ОВГ.
Возбудитель гепатита А (эпидемического гепатита) —РНК содержащий вирус. Это частица диаметром 27 нм; относится к пикорнавирусам семейства энтеровирусов, локализуется в цитоплазме гепатоцитов, оказывая прямой цитопатогенный эффект, распространяется фекально-оральным путем, в наибольших количествах экскретируется с фекалиями за 2 нед до и в течение 1—2 нед после начала ОВГ с максимумом до первых симптомов болезни. Инкубационный период ОВГ-А составляет 2—4, максимум 5—6 нед, аминотрансферазная активность крови характеризуется двумя пиками. Вирус ОВГ-А циркулирует в крови в течение непродолжительного периода и в низком титре, поэтому парентеральная передача инфекции очень редка. В остром периоде заболевания у всех больных образуются специфичные к вирусу А антитела класса IgM, являющиеся основным диагностическим маркером ОВГ-А. Затем их титр постепенно падает и в крови в течение длительного времени циркулируют только противовирусные антитела класса IgG. Выявление этих антител указывает на перенесенный ОВГ-А и иммунитет только к этому виду ОВГ. Адекватностью защитной иммунной реакции объясняется сравнительно легкое течение ОВГ-А, редкость злокачественных, молниеносных форм с исходом в печеночную кому (0,1%, по Baumgarten R., 1983) и полное отсутствие перехода ОВГ-А в хронический гепатит или хроническое вирусоносительство, несмотря на довольно большую частоту субклинических и удлиненных (до полугода и более) вариантов течения [, Савинс кая С. С., 1984; Renger F., 1983].
Наибольшее клиническое значение имеют ОВГ типа В и ни А ни В, которые могут переходить в хроническую форму.
Возбудитель ОВГ-В (сывороточный гепатит, поствакцинальная желтуха) не обладает цитопатогенным эффектом, относится к группе крупных оболочечных ДНК-содержащих вирусов, обладает тремя антигенными системами, принадлежит к новому семейству Hepadna (НЕРА) — ДНК-содержащих вирусов. Заболевания, вызываемые этой группой вирусов, имеют наклонность к хроническому течению или к вирусоносительству. В электронном микроскопе частица Дане идентифицируется в виде шара диаметром 42—45 нм с наружной и внутренней оболочками (рис. 1). В крови инфицированных лиц обычно лишь менее 1% циркулирующих вирусных частиц представляют зрелый вирион. В наружной липопротеиновой оболочке вируса, локализующегося в цитоплазме инфицированного гепатоцита, содержит ся поверхностный антиген (HBsAg). Фрагменты HBsAg или весь HBsAg могут инкорпорироваться в мембрану печеночной клетки, вызывая развитие соответствующей клеточной иммунной реакции, направленной против клеточной мембраны. Комплексы HBsAg с иммуноглобулинами (иммунные комплексы) обнаруживаются в пораженных органах вне печени — почках, сосудах и др.
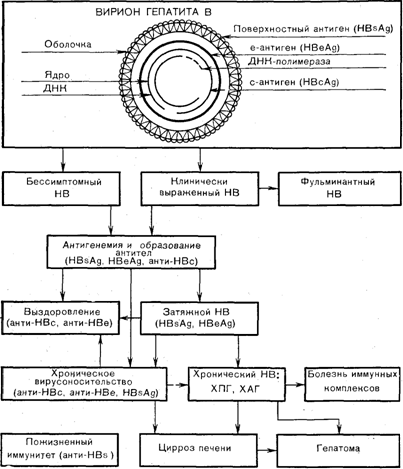
Рис. 1. Структура вируса и клинические формы гепатита В(НВ) [по Blum Н., Vyas G., 1984].
HBsAg реплицируется всегда в значительном избытке в эндоплазматическом ретикулуме инфицированных клеток. Титры HBsAg в крови наиболее велики при здоровом носительст ве, менее велики при ХПГ и наиболее низки при ХАГ, т. е. они не коррелируют с активностью хронического гепатита и с формой поражения печени. У носителей HBsAg с нормальным уровнем АлАТ при гистологическом исследовании печени отклонений от нормы не находят или они минимальны [Perillo R et al., 1982].
Наиболее чувствительный радиоиммунный метод обеспечивает выявление HBsAg в крови в концентрации не менее 108—109 частиц в 1 мл (0,2—0,5 нг/мл) [Dienstag J. L., 1983]. Этот метод, однако, не улавливает HBsAg в очень низких титрах (при разведении до Ю-4) и поэтому не обеспечивает выявления всех носителей HBsAg среди доноров крови [Brodersen М., 1980]. Клинические проявления ОВГ прямо зависят от величи ны инокулята: при низкой концентрации его развиваются субклинические или бессимптомные формы ОВГ. Заражение возможно при случайном переносе возбудителя, особенно с кровью и со слюной, через мелкие дефекты кожи, а также, по-видимому, через интактные слизистые оболочки.
Внутренняя оболочка вируса, проникшего в ядро гепатоцита, содержит внутренний (core—центральный, сердцевинный) антиген (HBcAg) — антиген нуклеокапсида, выделяемый из вириона при обработке детергентами. Этот антиген не попадает в ток крови: в крови выявляются только антитела к HBcAg (анти-НВс).
С внутренней оболочкой частицы Дане ассоциирован также третий антиген — е-антиген (HBeAg), растворимый, выявляемый только в сыворотке крови, содержащей HBsAg. Он, так же как HBsAg, локализуется в цитоплазме гепатоцита. HBeAg связан с репликацией (воспроизведением) вируса. Наличие HBeAg достоверно коррелирует с повышенной активностью ДНК-полимеразьг вируса, с количеством частиц Дане в крови и повышением активности АлАТ сыворотки крови и характеризует высокую контагиозность больного. У здоровых носителей HBsAg имеются антитела к HBeAs (анти-НВе), а большая часть носителей с прогрессирующим хроническим гепатитом имеют положительную реакцию на HBeAg в крови.
Кнутри от внутренней оболочки расположены двуспиральная ДНК и ДНК-полимераза — фермент, обеспечивающий воспроизведение генома вирусной частицы.
В острой фазе ОВГ-В в крови обнаруживаются три типа частиц: наиболее многочисленные — сферические диаметром около 20 нм и нитевидные, трубчатые шириной 22 нм — представляют избыточно образуемый инфицированной клеткой в периоде синтеза полного вириона дефектный и не обладающий контагиозностью HBsAg; в значительно меньшем количестве выявляются более крупные частицы Дане. Мелкие сферические частицы HBsAg, отличающиеся выраженной иммуногенностью, т. е. способностью вызывать образование нейтрализующих антител, после очистки и инактивации послужили исходным материалом для выработки эффективной специфической вакцины против гепатита В. Вирус гепатита В не экскретируется с калом или с мочой, инфекционны только кровь и, в значительно меньшей степени, другие жидкости тела больных — носителей вируса, поэтому инфицирование возможно лишь при тесном контакте. При соблюдении гигиенических мероприятий изоляция больных и вирусоносителей необязательна.
Инфицирование возбудителем ОВГ-В наиболее часто происходит через кожу или слизистые оболочки при случайной инокуляции, трансфузии инфицированной крови или использовании недостаточно простерилязованных игл. К группам наибольшего риска относятся лабораторный и врачебный персонал больниц, контактирующий с кровью, врачи-стоматологи. Гепатит В распространяется также половым путем при наличии инфекции у одного из супругов. Одна из причин значительного распространения этого вида гепатита в странах юго-восточной Азии — частая передача вируса от инфицированной матери ребенку. У большинства детей, инфицированных в возрасте до 1 года, инфекция становится хронической, по-видимому, в результате незрелости иммунной системы ребенка; у 3 из 4 детей, перенесших ОВГ в возрасте до 1 года, впоследствии развивается хронический гепатит В [Aach R. D., 1982]. У взрослых эта вероятность составляет лишь 7—10%.
На каждую 1000 доноров крови у 1—5 доноров, чаще отрицающих ОВГ в анамнезе, т. е. перенесших бессимптомную его форму, выявляется бессимптомная антигенемия. В биопта тах печени у них находят нормальную картину или изменения, свойственные ХАГ либо циррозу печени [Javitt N. et al., 1973].
Инкубационный период ОВГ-В варьирует от 40—60 до 180 дней, составляя в среднем 4 мес. После парентеральной передачи вируса (25% посттрансфузионных гепатитов обусловлены возбудителем ОВГ-В) интервал составляет 29—43 дня, после пероральной—61—81 день [Zhkarinsky Е., Rubin E., 1982; Baumgarten R., 1983]. Инкубационный период переходит в продромальную фазу, которая напоминает сывороточную болезнь и проявляется лихорадкой, болями в суставах, миалгия ми, транзиторными экзантемами, уртикариями в сочетании с разнообразными диспепсическими явлениями и монофазным подъемом аминотрансферазной активности крови. В пределах 10 дней после этих начальных симптомов развивается желтуха, когда билирубин сыворотки достигает 42,5—51 мкмоль/л, моча становится темно-коричневой вследствие экскреции больших количеств билирубина, кал — обесцвеченным и часто жирным в связи со сниженным поступлением желчи в кишечник. На этой стадии больные обычно обращаются к врачу, который в 70% случаев находит увеличенную, слегка болезненную печень и в редких случаях спленомегалию.
Желтуха нарастает в течение нескольких дней, после чего начинает уменьшаться, полностью исчезая через 2—8 нед. В крови находят незначительную транзиторную анемию, гра нулоцитопению, лимфоцитоз, нередко признаки умеренного ге молиза с увеличением числа ретикулоцитов. Уровень общего билирубина крови, по которому судят о степени тяжести гепатита, редко превышает 170 мкмоль/л; уровень более 510 мкмоль/л — почти всегда результат осложняющего заболевание гемолиза [Mezey Е., 1982]. Активность аминотрансфераз крови может достигать нескольких тысяч единиц, что не имеет существенного прогностического значения. Тяжелые формы сопровождаются удлинением протромбинового времени, которое не изменяется после введения витамина К; тяжелейшие (молниеносные) формы, наблюдаемые при ОВГ-В в 1—2% случаев, характеризуются внезапным резким снижением аминотрансферазной активности и протромбинового индекса.
50—60% лиц, инфицированных вирусом гепатита В, переносят инфекцию в бессимптомной форме, при которой единственное проявление заболевания — подъем активности АлАТ и реже АсАТ сыворотки крови [, 1978].
Легкая безжелтушная форма ОВГ может проявляться только неспецифическими симптомами генерализованной инфекции: умеренной лихорадкой, общей слабостью, утомляемостью, ар тралгиями, анорексией, тошнотой и рвотой, часто первым симптомом являются летучие кожные уртикарии, у детей возможен папулезный акродерматит (мелкие красные высыпания на коже головы, затылка, рук и бедер).
В ходе ОВГ-В наблюдается закономерное появление в крови и исчезновение из крови маркеров вируса — его антигенов (HBsAg, HBeAg, вирусной ДНК и ДНК-полимеразы) и вырабатываемых иммунной системой организма антител к соответствующим антигенам: анти-HBs, анти-НВе и анти-НВс (рис. 2; табл. 1), причем только анти-HBs обладает защитными, обеспечивающими иммунитет к вирусу свойствами. Выделение реп лицируемого в печени возбудителя в кровь и другие жидкости организма начинается в среднем за 14 дней до появления первых клинических симптомов и биохимических изменений, т. е. до подъема трансаминазной активности. HBsAg может выявляться в крови на всем протяжении заболевания, но обычно он исчезает в течение 4—6 нед после начальных симптомов, от 1 до 12 нед после пика аминотрансферазной активности. Сохранение HBs-ангигенемии на протяжении более 13 нед свидетельствует о переходе заболевания в хроническую форму или о вирусоносительстве [Nielsen J. et al., 1971; Schmid M., 1980]. Трансформация ОВГ-В в хронический составляет 10% [ Ф„ 1978].
Таблица 1. Интерпретация серологических данных при инфицировании вирусом гепатита В (по Waterson A., 1982)
|
Антигены или антитела в сыворотке крови |
Клиническая интерпретация | ||||
|
HBs-Ag |
Анти-HBs |
анти-НВс |
HBeAg |
анти-НВе | |
|
+ |
+ |
ОВГ-В (ранний или инкубационный период) | |||
|
+ |
— |
+ |
+ |
— |
ОВГ-В, более поздние стадии или хроническое вирусоносительство |
|
— |
+ |
+ |
— |
+ |
Стадия реконвалесценции ОВГ-В |
|
+ |
— |
+ |
— |
+ |
Хроническое вирусоносительство |
|
+ |
— |
+ |
— |
— |
» » |
|
— |
+ |
+ |
— |
— |
Инфицирование вирусом ОВГ-В в прошлом |
|
— |
— |
+ |
— |
— |
Потенциальная контагиозность (продолжающаяся репликация вируса) |
|
— |
+ |
— |
— |
— |
Иммунизация против вируса ОВГ-В и отсутствие инфицирования или повторные случайные контакты с вирусом |
У 80% больных после исчезновения HBsAg появляются антитела к нему, отражающие ликвидацию инфекции, неконта гиозность больного и состояние иммунитета. Период между исчезновением HBsAg и появлением анти-HBS—серологический пробел — соответствует раннему реконвалесцентному периоду, но не означает потери контагиозности; в этом периоде выявляются анти-НВс и анти-НВе. У вирусоносителей и у больных хроническим вирусным гепатитом отмечаются высокие титры HBsAg при отсутствии продукции анти-HBs.
Наряду с HBsAg в ранней фазе ОВГ-В в крови находят индикаторы активной репликации вируса: HBeAg, ДНК-поли меразу и несколько позже анти-НВс (рис. 3). HBeAg появляется во время инкубационного периода, приблизительно через неделю после появления HBsAg, и элиминируется за 2 нед до исчезновения HBsAg. Антитела к HBeAg находят у 50% больных после появления анти-НВс, но не анти-HBs. Длительная циркуляция HBeAg (более 2 мес от начала ОВГ) является неблагоприятным прогностическим признаком, указывающим на переход болезни в хроническую форму с продолжающейся репликацией вируса или на бессимптомное вирусоносительство [ и др., 1983]. У этих больных при пункции печени нередко выявляется ХАГ. У 6—9% бессимптомных вирусоносителей HBsAg встречается HBeAg. ДНК-полимераза обычно выявляется в крови при ОВГ-В в течение короткого срока после пика HBs-антигенемии. Сохранение активности ДНК-полимеразы — наиболее чувствительного показателя продолжающейся репликации вируса, как и наличие HBeAg, означает контагиозность и персистенцию гепатита. Анти-НВс появляются во время HBs-антигенемии, через 10—20 дней после инфицирования или через 4—10 дней после появления HBsAg. Появление анти-НВс обычно совпадает с началом клинических симптомов. Высокие титры анти-НВс, относящихся к классу IgM, часто являются предвестником развития хронического гепатита или вирусоносительства [Neimar К., Rogers A., 1982]. Изолированное выявление анти-НВс в сыворотке крови всегда совпадает с наличием HBeAg в ядрах гепатоцитов, т. е. репликацией вируса в печени; наличие и анти-НВс, и анти-HBS сопровождается положительной реакцией на HBeAg в ткани печени менее чем в половине случаев, указывая на промежуточную ситуацию. Присутствие анти-НВс класса IgG в сочетании с анти-HBs обычно указывает на выздоровление. Одновременное наличие HBsAg, анти-HBs и анти-НВс наблюдается при фульминантном и хроническом гепатите.
В начальной фазе инфекции вирусом ОВГ-В частица Дане проникает через мембрану печеночной клетки, вирусная ДНК освобождается от оболочки и транспортируется к ядру. Здесь вирусная ДНК-полимераза реплицирует ДНК вируса, после чего все вирусные субкомпоненты (HBsAg, HBcAg, HBeAg, ДНК-полимераза) кодируются и синтезируются в большом количестве — вирусная репликация является на этой стадии полной с образованием полной частицы Дане. Во время этой фазы, типичной для острой инфекции или для ранних стадий хронической инфекции, ДНК вируса не интегрируется в клеточный геном, поэтому на данной стадии возможна полная элиминация вируса благодаря иммунным реакциям, при которых наступает некроз и гибель инфицированных клеток печени и образуются антитела, блокирующие проникновение вируса в неинфицированные клетки.
На ранних стадиях развития хронического процесса можно добиться элиминации вируса путем применения специфических химиотерапевтических противовирусных средств (интерферон, аденинарабинозид или его более растворимый аналог аденин арабинозидмонофосфат), тормозящих репликацию вируса. Для этой стадии характерно наличие в крови HBeAg и специфической ДНК-полимеразы вируса гепатита В. В дальнейшем, на более поздних стадиях инфекции, происходит включение (интеграция) фрагмента вирусного генома (ДНК) в геном клетки-хозяина: с этого момента генетический аппарат печеночной клетки начинает кодировать и производить в большом количестве HBsAg с участием ДНК-полимеразы гепатоцита. Остальные части генома вируса, по-видимому, утрачиваются и полная его репликация прекращается [Hoofnagle J. H., 1983].
У таких больных, в сыворотке крови которых выявляются только HBsAg и часто анти-НВе, контагиозность низка и лечение противовирусными средствами неэффективно, так как они не влияют на фрагменты вирусной ДНК, инкорпорированные в ДНК печеночной клетки. Вместе с тем клетка печени на данной стадии приобретает онкогенный потенциал. Интегрированные фрагменты вирусного генома были обнаружены в большинстве клеток первичного рака печени у больных с положительной реакцией на HBsAg или на анти-НВс. У больных с HBs-антигенемией и остановившейся репликацией вируса риск развития первичного рака печени невелик при отсутствии цирроза печени, однако у больных со сформированным циррозом риск развития этой опухоли в 250 раз больше, чем в здоровой популяции [Craxi A., Craxi R., 1983; Thomas H„ 1983].
При хроническом вирусном гепатите исчезновение из сыворотки HBeAg и сероконверсия на анти-НВе сопровождает спонтанную, часто стойкую клиническую и гистологическую ремиссию, т. е. значительное снижение воспалительно-некротической активности с нормализацией уровня аминотрансфераз крови. Такая сероконверсия ежегодно развивается у 10—20% больных [Hoofnagle J. H., 1983] и часто означает переход от фазы хронического гепатита к фазе бессимптомного вирусоно сительства. Более чем у половины больных сероконверсии предшествует обострение хронического вирусного гепатита с подъемом аминотрансферазной активности, отражающее, по-видимому, реакцию иммунной системы организма, направленную на уничтожение печеночных клеток, в которых реплициру ется интактный вирус гепатита В.
Вместе с тем у больных с происшедшей сероконверсией HBeAg, в том числе и у бессимптомных носителей HBsAg и анти-НВе, возможна спонтанная реактивация хронического гепатита с нарастанием аминотрансферазной активности и повторным появлением в сыворотке вирусной ДНК и ДНК-полимеразы. Такую иногда резчайшую реактивацию можно особенно часто наблюдать у хронических носителей HBsAg, получавших ранее химиотерапию по поводу онкологических заболеваний или иммунодепрессивные препараты, а также у претерпевших сероконверсию больных вирусным циррозом печени. Возможность реактивации указывает на сохранение в минимальной степени репликации вируса даже после сероконверсии. Иммунодепрессанты, как правило, приводят к нарастанию репликации вируса: высокие дозы преднизолона увеличивают концентрацию HBsAg, HBeAg и активность ДНК-полимеразы и могут препятствовать исчезновению маркеров вирусной репликации и сероконверсии HBeAg в анти-НВе [Scullard G. et al., 1981]. Часто сероконверсия наблюдается после отмены глюко кортикостероидов, поэтому короткий курс высоких доз гормонов коры надпочечников с последующей их внезапной отменой может индуцировать сероконверсию HBeAg в анти-НВе с последующей клинической ремиссией [Hoofnagle J., Seeff L., 1982].
Появление в сыворотке анти-НВе знаменует переход к бес симптомному носительству в крови HBsAg, при котором не определяются ДНК-полимераза, вирусная ДНК, частицы Дейна и отмечаются нормальные функциональные пробы печени и в основном нормальный печеночный пунктат, за исключением очаговых скоплений гепатоцитов с матово-стекловидной цитоплазмой, содержащей HBsAg (при хроническом гепатите и циррозе печени эти клетки распределяются неравномерно; они крупнее, чем нормальные, имеют гладкую, гомогенную, слабо эозинофильную цитоплазму и ядра, часто смещенные к периферии). Для носительства характерно наличие в сыворотке крови HBsAg, в начальной стадии в сочетании с HBeAg и анти-НВс (антитела к центральному антигену вируса). HBeAg в ядрах гепатоцитов чаще выявляется у больных с ХАГ или ХПГ. Таким образом, носителям HBsAg с положительным HBeAg (начальная стадия носительства) свойственна значительная контагиозность, тенденция к высокой аминотрансфераземии и к развитию ХАГ; у носителей с анти-НВе обычно отмечают нормальные функциональные печеночные пробы и неактивное заболевание печени.
Еще одна вирусная антигенная частица — дельта-антиген (d-Ag) — была описана в 1977 г. сначала в Италии, а затем и в других странах. d-Ag является высокопатогенным, по-видимому, гепатотоксичным агентом. Эта частица — дефектный РНК-содержащий вирус («вирус гепатита D»)—локализуется в ядре гепатоцита и способен реплицироваться только в присутствии HBsAg, который окружает его в виде оболочки. Дополнительное инфицирование б-антигеном бессимптомных носителей вируса гепатита В практически всегда сопровождается развитием острого поражения печени и хронического активного гепатита. На хроническую d-инфекцию указывают повышающиеся в крови титры анти-d-антител класса IgG [Farci P. et al., 1983]. Таким образом, суперинфекция d-антигеном может быть важным фактором, способствующим утяжелению патологического процесса в печени и ведущим к развитию ХАГ и цирроза печени. М. Colombo и соавт. (1983) выявили d-Ag в срезах печени у 26,2% хронических носителей HBsAg, среди которых преобладали больные активным циррозом печени; ХАГ и активный цирроз печени были обнаружены у 94% носителей d-Ag, чаще у больных с высокой воспалительной активностью, и только у 61% d-Ag-отрицательных носителей HBsAg. У носителей HBsAg с нормальной гистологией печени внутрипеченочный d-Ag всегда отсутствовал.
Важным аспектом генерализованной вирусной инфекции является способность HBsAg и HBeAg образовывать с соответствующими антителами (иммуноглобулинами) циркулирующие в крови иммунные комплексы антиген—антитело. Циркулирующие иммунные комплексы (ЦИК) наиболее часто оседают в стенках кровеносных сосудов и в клубочках почек, вызывая поражение соответствующих тканей. Эти процессы, по-видимому, ответственны за клинические проявления продромального периода ОВГ (артралгии, миалгии, кожная сыпь). Данный механизм лежит в основе ряда системных проявлений, наблюдаемых у некоторых больных при хронических вирусных поражениях печени: хронических полиартралгий или артритов, ревматической полимиалгии, васкулитов, смешанной эссенциальной криоглобулинемии, гангренозной пиодермии, гломеруло нефрита, узелкового периартериита и идиопатической тромбо пенической пурпуры. Синдром узелкового периартериита у таких больных сопровождается лейкоцитозом, резко ускоренной СОЭ, гипергаммаглобулинемией, гиперфибриногенемией, лихорадкой, полиартралгией, кожными высыпаниями, периферической нейропатией, умеренной артериальной гепертонией, поражением почек с терминальной гиперазотемией и наличием ЦИК, содержащих комплекс HBsAg — анти-HBs и комплемент в стенке пораженных сосудов с явлениями фибриноидного некроза и периваскулярного воспаления [Ohme W. D. et al., 1982]. При гломерулонефрите обычно мембранозно-пролифера тивного или мембранозного типа [Mihas A., Conrad М., 1978] аналогичные комплексы откладываются в клубочках почек. В сыворотке крови больных обнаруживают высокие титры HBsAg, ЦИК и низкий уровень комплемента. При эссенциаль ной смешанной криоглобулинемии комплекс откладывающихся в тканях криоглобулинов состоит из IgM и IgG, причем IgM является антителом по отношению к IgG, a IgG, по-видимому, направлен против включенного в комплекс криопреципитата HBsAg [Clive L. et al., 1979]. У больных наблюдаются слабость, боль в суставах, пурпура и развивается диффузный пролиферативный гломерулонефрит. Описан также синдром Гийена — Барре — полирадикулоневропатия с парестезиями и моторными нарушениями в области конечностей вплоть до квадриплегии, он развивается вследствие реакции ЦИК, содержащих HBsAg, с миелиновыми белками периферических нервов [, 1984; Walle A., Lehmann H., 1981]. Системные поражения, обусловленные ЦИК, у инфицированных вирусом В больных обычно сочетаются с хроническим поражением печени, но с нерезко выраженной активностью, т. е. не коррелируют со степенью тяжести поражения печени [Wright R., 1982].
У 90% больных ОВГ-В заканчивается полным выздоровлением без каких-либо последствий. Хронический гепатит развивается у 8—10% больных, из них у 70% при пункции печени выявляется прогностически благоприятный ХПГ, а у 30% развивается более серьезная клинико-морфологическая форма — хронический активный (агрессивный) гепатит (ХАГ), нередко эволюционирующий в цирроз печени. Период хронического гепатита может продолжаться от нескольких месяцев до 20 лег и более.
Течение и исход ОВГ обусловлены не патогенными свойствами инфицирующего агента, а реакцией иммунной системы организма на внедрившийся в клетки печени вирус. В результате клеточной иммунной реакции, направленной на нейтрализацию вирусных антигенов, вместе с возбудителем погибает и инфицированная клетка: оптимальная реакция приводит к полной элиминации возбудителя и выздоровлению, чрезмерная — к развитию острого некроза печени и молниеносной форме ОВГ или ОВГ с острой печеночной недостаточностью [ и др., 1984]. Отсутствие иммунной реакции на возбудитель сопровождается хроническим бессимптомным ви русоносительством. Один из неблагоприятных исходов — ХАГ характеризуется недостаточной иммунной реакцией, точнее — недостаточностью функциональной способности цитотоксичес ких Т-лимфоцитов, разрушающих пораженные вирусом гепато циты [Thomas Н., 1983]. При этом не происходит полной элиминации вируса из печени путем некроза содержащих вирус клеток: инфицирование новых групп клеток приводит к повторным некрозам, которые могут сопровождаться цирротической перестройкой органа.
Цитоплазма гепатоцита
Ядро гепатоцита
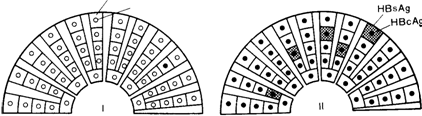
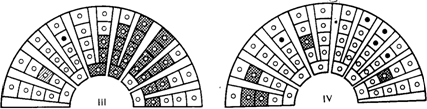
Рис. 4. Типы иммунной реакции организма при инфицировании вирусом гепатита В (иммунофлюоресцентная микроскопия пунктатов печени). Схема [по Bianchi L., Gudat F., 1976].
I — элиминационный тип — соответствует классической очагово-некротизирующей форме ОВГ: II—иммуносупрессивный тип, или тип с доминированием HBcAg: вариант I—при световой микроскопии не выявляется — «здоровый» носитель с нормальным уровнем ами нотрансфераз сыворотки крови и нормальной гистологической картиной пунктата печени; вариант 2 — картина хронического персистирующего гепатита; III—тип с преобладанием HBsAg: вариант 1 — «здоровый» носитель с нормальным уровнем аминотрансфераз сыворотки; при световой микроскопии выявляется на основании наличия гепатоцитов с матово-стекловидной цитоплазмой; вариант 2 — картина хронического персистирующего гепатита — аналог хронического персистирующего гепатита при преобладании HBcAg; IV — иммуноагресивный тип — соответствует гистологической картине хронического агрес сивного гепатита.
При обработке срезов печени соответствующими флюоресцирующими иммунными сыворотками, содержащими антитела к HBsAg и HBcAg, можно видеть, что различным типам иммунного ответа (рис. 4) соответствует специфическая локализация вирусных маркеров в клетках печени [Bianchi L., Gudat F., 1976; Storch W., 1983]. Генерализованное распределение в цитоплазме всех гепатоцитов HBsAg при отсутствии в ядрах HBcAg наблюдается у практически здоровых вирусоносителей при «минимальном» гепатите, т. е. изменениях печени, напоминающих неспецифический реактивный гепатит. Очаговое распределение HBsAg находят при ХАГ, генерализованное распределение HBcAg в ядрах клеток—при ХПГ и эффективной иммунодепрессивной терапии; очаговая локализация HBsAg и HBcAg—при ХАГ с резко выраженной активностью и на стадии выздоровления от ОВГ. Флюоресценция единичных клеток, содержащих HBsAg или HBcAg, бывает в начальной или ко неч^й стадии ОВГ и при ХАГ с резко выраженной активностью. Таким образом, для здоровых вирусоносителей характерен генерализованный цитоплазматический HBsAg-тип им мунофлюоресценции печеночных срезов, для больных носителей—различные очаговые HBsAg и (или) генерализованный HBcAg-тип.
Иммуносупрессорный тип ОВГ-В с переходом в хроническое вирусоносительство наиболее часто развивается у больных с врожденным или приобретенным иммунодефицитом: у больных синдромом Дауна, гемобластозами, хроническими заболеваниями почек, лепрой, у больных, получающих длительное лечение гемодиализом, иммунодепрессантами или перенесших трансплантацию почек. Частота таких носителей в промышленно развитых странах составляет около 0,1—0,5%, в некоторых развивающихся странах—до 20%. и Л. Г. Дорошенко (1983) при обследовании 214 больных острыми и хроническими гемобластозами у 17,1% из них выявили большей частью бессимптомное носительство HBsAg.
По данным и соавт. (1983), наблюдавших на протяжении до 1 года 474 больных ОВГ-В, наиболее достоверным критерием перехода в хронические формы служила стойкая HBs-антигенемия часто в сочетании с клиническими или биохимическими симптомами неполного выздоровления. ХПГ развился у 5,8% больных, ХАГ—у 0,5%, цирроз печени— у 0,2%, бессимптомное носительство HBsAg—у 1%. Переход легкой формы ОВГ-В в хронический процесс к концу года наблюдался у 11,5% больных, среднетяжелой и тяжелой— соответственно у 5 и 7,8%; фульминантная форма ОВГ-В не переходила в хронический гепатит.
Наличие второй формы ОВГ, имеющей наклонность к хроническому течению в большей степени, чем гепатит В (см. табл. 3), было убедительно доказано в опытах с введением людям-добровольцам или обезьянам крови больных ОВГ или хроническим гепатитом, не содержавшей маркеров гепатитов А, В или других известных вирусных гепатитов, а также при введении крови бессимптомных носителей, перенесших пост трансфузионный (не В) гепатит. У подопытных лиц и животных развивался ОВГ, клинически напоминавший ОВГ-В, но с инкубационным периодом около 7 нед, т. е. промежуточным между инкубационными периодами ОВГ-А и ОВГ-В.
Поскольку идентифицировать возбудителей этой формы ОВГ и разработать методы его серологической идентификации пока не удалось, диагноз данной разновидности ОВГ возможен только на основании исключения ОВГ-А и ОВГ-В. Отсюда название этого гепатита: ОВГ - ни А ни В.
О возможности двух или более возбудителей этой формы ОВГ свидетельствуют развитие множественных атак ОВГ у одного и того же лица или подопытного животного и наличие двух клинико-биохимических форм ОВГ - ни А ни В: с коротким периодом инкубации, быстрым монофазным подъемом и снижением АлАТ и с более длительным инкубационным периодом и медленным снижением АлАТ, которая обнаруживает двухфазную динамику [Plasencia С. et al., 1983]. Этим клинико биохимическим различиям соответствуют два типа вирусных частиц, наблюдаемых в электронном микроскопе у шимпанзе с ОВГ - ни А ни В.
Гепатит ни А ни В, составляющий 10—20% всех форм ОВГ [Berg P., 1980], характеризуется малосимптомным и затяжным течением с переходом в хронические формы почти в половине случаев, особенно высокой частотой бессимптомного вирусоно сительства (в 5—10 раз чаще, чем при ОВГ-В).
Наиболее часто ОВГ - ни А ни В является посттрансфузи онным. Он развивается у 7% больных, получающих гемотранс фузии. В США и других западных странах 85—95% посттранс фузионных гепатитов—это ОВГ - ни А ни В. Возможна также парентеральная передача ОВГ - ни А ни В при внутривенных вливаниях, подкожных и внутримышечных инъекциях недостаточно простерилизованными иглами. В центрах гемодиализа частота ОВГ - ни А ни В среди больных и персонала составляет соответственно 5,8 и 0,8% [Dienstag J., 1983]. Особенно подвержены ОВГ-ни А ни В с переходом в хроническое течение (до 93%) больные с трансплантированной почкой. К другим группам повышенного риска относятся больные, получающие по жизненным показаниям многократные переливания компонентов и препаратов крови (при талассемии, гемофилии, различных коагулопатиях). Наиболее типичным для таких больных является стойкое умеренное повышение активности амино трансфераз сыворотки крови, выявляемое, например, почти у половины больных гемофилией с острой или хронической формой ОВГ-ни А ни В. Повышенная активность АлАТ сыворотки крови (более 1,3 мкмоль/л) у доноров крови является достоверным показателем высокого риска переноса гепатита реципиенту: инфицирования не наступает в 97% случаев, если активность АлАТ донорской крови нормальная. В то же время умеренное повышение активности ферментов может наблюдаться при хроническом алкоголизме, лечении медикаментами (гипотензивные препараты) или нередко при жировой дистрофии печени [Sampliner R. et al., 1983].
Наконец, нередко, в среднем в 50% случаев ОВГ-ни А ни В, наблюдаются спорадические (нетрансфузионные) его формы, точный путь передачи которых еще не установлен [Berg P., 1980]. Доказана возможность передачи возбудителя ОВГ-ни А ни В половым путем и через плаценту. В Индии и других азиатских странах описаны вспышки ОВГ-ни А ни В эпидемического типа, распространяющегося через инфицированную воду. Болезнь протекает с тяжелым внутрипеченочным холеста зом, особенно у беременных. Перехода в хронические формы не бывает.
Клинически выраженная форма ОВГ-ни А ни В не отличается от других ОВГ: наблюдается слабость, боль в животе, тошнота и лихорадка (продромальные симптомы), возможны (в 3%) внепеченочные проявления, артралгия и макулопапу лезный дерматит, монофазный или двухфазный подъем активности аминотрансфераз крови. При гипераминотрансферазе-мии, длящейся свыше 6—12 мес, в пунктатах печени находят признаки ХПГ, ХАГ или лобулярного гепатита. Описаны единичные случаи ОВГ-ни А ни В с острой печеночной недостаточностью (фульминантные формы) в основном у больных с иммунным дефицитом и спорадические формы ОВГ-ни А ни В, осложнявшиеся апластической анемией [Camel A. et al., 1983].
Однако большей частью ОВГ-ни А ни В течет мягче, чем ОВГ-В, обычно без продромальных явлений. У 80—90% больных инкубационный период составляет 5—12 нед [Фаво ров М. О. и др., 1985]. Число бессимптомных и безжелтушных случаев достигает 75%. Характерны значительные колебания активности аминотрансфераз, которая в течение короткого периода времени может нормализоваться и вновь повышаться, обусловливая бифазные и полифазные кривые активности, что затрудняет оценку полного выздоровления. Переход ;в хронический гепатит после ОВГ-ни А ни В при парентеральном пути заражения наблюдается значительно чаще (в 40—60% случаев), чем при спорадических формах (не более 10% случаев). Бессимптомное вирусоносительство после ОВГ-ни А ни В с нормальной активностью АлАТ выявлялось в США у 3—7% здоровых доноров, т. е. в общей популяции частота вирусоно сительства ни А ни В в 15—70 раз выше, чем вируса В (0,1— 0,2%) [Dienstag J., 1983].
У большинства больных хроническим гепатитом ни А ни В развивается морфологическая картина ХАГ, но течет он более благоприятно, чем ХАГ после ОВГ-В, часто с хорошим прогнозом. Тем не менее у 10—20% больных этой формой развивается цирроз печени, иногда уже через несколько месяцев после ОВГ (при ХАГ после ОВГ-В у 40—60%). Прогрессиро вание в цирроз печени может протекать незаметно на протяжении от 6 мес до 11 лет после острой стадии. Гепатит ни А ни В, несомненно, является причиной части ХАГ и циррозов печени, при которых не находят маркеры вируса В и аутоан титела, свойственные аутоиммунному гепатиту. Гепатоцеллю лярный рак развивается у 5—28% таких больных в среднем на 8—10 лет позже, чем рак печени, ассоциированный с вирусом гепатита В. Иногда при остром и хроническом спорадическом гепатите ни А ни В, текущем с периодическими обострениями и гипергаммаглобулинемией, в сыворотке крови появляются аутоантитела к компонентам ядер и волокон гладкой мускулатуры, титр которых в отличие от аутоиммунного (люпоидного) хронического гепатита низок и не превышает 1 : 20 [Berg P., 1980].
Мерами профилактики острых, а следовательно, и хронических вирусных гепатитов являются тщательное соблюдение правил личной гигиены, повсеместный переход на централизованную стерилизацию игл и шприцев сухим жаром, минимальное применение крови, ее компонентов и препаратов и парентеральных вмешательств. Профилактическое введение иммунного глобулина (т. е. концентрированного в 15—20 раз сывороточного у-глобулина) или добавление его к переливаемой крови (по 250 мг к каждой дозе крови за 1 ч до трансфузии) снижает частоту посттрансфузионного гепатита более чем на 60%. Наиболее эффективен для профилактики ОВГ-В гипер иммунный глобулин, который содержит анти-НВз-антитела в высоком титре. Его получают от доноров, которым проводили многократные гемотрансфузии (например, больных гемофилией), и вводят как можно быстрее после предполагаемого заражения (не позднее чем через 7 сут) в дозе 0,06 мл/кг и вторично в той же дозе через 25—30 дней. При инфицировании плода в течение III триместра беременности новорожденному вводят 0,5 мл в первые 25 ч после родов и повторно ту же дозу через 3 и 6 мес [Aach R., 1982]. Эффективную вакцину против возбудителя ОВГ-В готовят на основе непатогенного, но иммунологически активного термостабильного HBsAg (частицы размером 22 нм), получаемого от здоровых носителей.

|
Из за большого объема эта статья размещена на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 11 |



