Гиперферремия наблюдается при идиопатическом гемохро матозе и гемохроматозе вследствие злоупотребления алкоголем [Chapman R. et al., 1982, 1983], посттрансфузионном гемосиде розе, остром и хроническом гемолизе, а также при ОВГ, некротических обострениях ХАГ и цирроза печени с желтухой. При постпеченочной (механической) желтухе уровень железа сыворотки обычно нормален.
В основе печеночной гиперазотемии, наблюдаемой на поздних стадиях цирроза печени, а также у больных тяжелыми не кротизирующими формами острого гепатита, синдромом Рейе, острой жировой печенью беременных и при тяжелых токсических поражениях печени лежит недостаточность функции печени по метаболизму аминокислот крови, аммиака и других кишечных токсинов, образуемых в кишечнике бактериями из белков пищи и из мочевины. При снижении метаболической способности печени или шунтировании портальной крови черезвнутри или внепеченочные портокавальные анастомозы в кровь в значительных количествах поступают токсичные для ЦНС соединения: аммиак, свободные фенолы, индикан, производные индола, скатолы и меркаптаны, в норме инактивируемые печенью.
У больных компенсированным циррозом печени с нормальным базальным уровнем аммиака крови степень портокаваль ного шунтирования и наклонность к развитию портокавальной энцефалопатии можно выяснить с помощью пробы с перораль ной нагрузкой хлоридом аммония из расчета по 50 мг на 1 кг массы тела, но не более 3 г на прием. В пробах крови, взятых на протяжении 60—80 мин после нагрузки, отмечается резкое нарастание концентрации аммония с максимумом через 40— 60 мин; у здоровых лиц после нагрузки она не превышает нормальные показатели [, 1981]. У большинства больных декомпенсированным циррозом печени обычно отмечается ба зальная гипераммониемия и значительное увеличение концентрации свободного аминного азота крови еще до развития клинически выраженных симптомов печеночной энцефалопатии [, , 1983].
Широкое применение получила проба на поглотительно экскреторную способность печени путем определения процента задержки краски в крови на протяжении 45 мин после быстрого внутривенного введения бромсульфалеина (БСФ) в дозе 5 мг на 1 кг массы тела. Полупериод (Ti/з) выведения краски в норме составляет менее 7 мин.
Кривая выведения БСФ из крови на полулогарифмической шкале носит двухфазный характер. Скорость исчезновения краски из крови (в процентах за 1 мин) на протяжении начальной фазы (первые 30 мин)—показатель Ki—тесно коррелирует с величиной печеночного кровотока и отражает поглотительную способность печени. Поэтому Ti/зудлиняется и Ki уменьшается при поражениях печени со сниженным печеночным кровотоком, например, при шоке и циррозе печени. Показатель К2—скорость исчезновения краски на протяжении последующей фазы, между 30-й и 45-й минутой, достоверно коррелирует с Тт (максимальный транспорт, или максимальная скорость экскреции краски в желчь), т. е. отражает экскреторную способность печени, особенно нарушенную при холестатических ее поражениях [Allgen L. G., 1970; Hacki W. et al., 1976].
При механическом препятствии току желчи во внепеченоч-ных желчных путях возможно транзиторное повышение концентрации краски в крови через 20 мин после введения, отражающее обратный пассаж (рефлюкс) красителя из желчных путей в кровь.
Проба с бромсульфалеином является наиболее чувствительным тестом для выявления минимальных функциональных нарушений печени независимо от вызвавшей их причины. При многих заболеваниях печени—жировой дистрофии, неактивном компенсированном циррозе печени, в начальной стадии перехода острого гепатита в хронический, при метастазах в печень, застойной печени, а также нередко при внепеченочных лихо

Рис. 10. Синдром Бадда—Киари: преимущественное накопление радионуклида в хвостатой доле печени. Сканограмма.
радочных или системных заболеваниях с минимальными изменениями печени (реактивный гепатит)—отклонения пробы БСФ могут быть единственным признаком гепатопатии. Проба применяется также для суждения о степени тяжести и динамике хронического гепатита и цирроза печени: при ХПГ отклонения обычно отсутствуют или минимальны, при ХАГ и циррозе печени они тесно коррелируют со степенью воспалительной активности патологического процесса: в неактивной стадии задержка составляет 8—12%, в активной—24—28%. При тяжелых поражениях печени задержка может превышать 50%. При дифференциальной диагностике ХАГ и компенсированного цирроза печени резко патологическая задержка БСФ (Ki равен или менее 6,5) наряду с тромбоцитопенией (ЮО-Ю^л и менее) и гипопротромбинемией (протромбиновая активность 60% и менее) относилась к наиболее достоверным признакам цирроза и превосходила по дифференциально-диагностическому значению такие симптомы, как спленомегалия, желтуха, гипохолестерине мия и другие биохимические показатели [Cozzolino G. et al., 1983]. Результаты пробы БСФ обычно нормальны при предпе ченочной (гемолитической) желтухе и при печеночных микро сомальных желтухах с неконъюгированной гипербилирубине мией (синдромы Жильбера и Криглера—Найяра), они могут быть нормальны у некоторых больных гемохроматозом, поли

Рис. 11. Амилоидоз печени: Видны дефекты накопления изотопа, имитирующие очаговое поражение печени. Сканограмма.
кистозной болезнью печени и неактивным макронодулярным циррозом [Zimmerman H., 1979].
Проба с вофавердином (индоцианиновый зеленый) дает значительно меньше побочных аллергических явлений, чем проба с БСФ, но она менее чувствительна и менее пригодна для выявления нерезко выраженных отклонений функциональной способности печени: через 20 мин после быстрого внутривенного введения красителя в дозе 0,3—0,5 мг/кг в крови у здоровых лиц определяется менее 5% от начальной концентрации краски, полупериод циркуляции вофавердина составляет в среднем 3,18 мин.
Информативным и безопасным методом радионуклидной диагностики диффузных и очаговых заболеваний печени, позволяющим получать изображение органа, является сканирование печени после внутривенного введения следовых количеств гамма-излучателей—радиоактивных коллоидов золота (198Аи) или технеция (""Те), частички которых захватываются ратикуло эндотелиальными клетками печени, селезенки и других органов. Точный диагноз метастазов на сканограмме возможен в 80% случаев [Frenkel M., Wilson J., 1981]. Ложноположительные сканограммы, т. е. сканограммы с изображением очаговых де
Рис. 12. Ранняя стадия цирроза печени. Сканограмма.
фектов накопления, симулирующих опухолевое поражение, возможны при очаговой жировой дистрофии [Pariente E. A. et al., 1983], при макронодулярном циррозе печени с обширными руб цовыми полями, при ишемических поражениях (инфаркт печени).
Так называемый псевдотумор можно наблюдать при вирусном гепатите, синдроме Бадда — Киари с преимущественным захватом радионуклида в каудальной зоне печени (рис. 10) и ири обструкции желчного протока в области ворот печени [Dien stag J., Gang D., 1982].
Мы наблюдали больного 38 лет с жировой печенью алкогольной этиологии, перенесшего лапаротомию в связи с выявлением у него дефекта на скано грамме печени в области верхнезадней поверхности правой доли диаметром около 2 см. У больного 41 года с подтвержденным на вскрытии первичным амилоидозом печени на сканограмме выявлялись множественные крупные «очаговые поражения:», обусловленные обширными не накапливающими коллоид пространствами, заполненными амилоидом (рис. 11).
Ложноотрицательные сканограммы часто наблюдаются при диффузной злокачественной инфильтрации печени—у больных лимфогранулематозом, лимфомой или лейкемией. Мелкие (ин трасинусоидальные) метастазы мелкоклеточного рака бронха и рака молочной железы также обычно не выявляются [Ног G.,
Рис. 13. Поздняя гтадия цирроза печени. Сканограмма
1983]. Более точно очаговые поражения печени диагностируют при сочетании сканирования с ультразвуковым исследованием и компьютерной томографией, которая хорошо идентифицирует на основании изменений плотности печеночной ткани также диффузные поражения печени—жировую дистрофию и гемохрома» тоз.
При хроническом гепатите и жировой дистрофии на сканограмме обычно видно равномерное увеличение печени. Накопление радиоактивного коллоида в селезенке нормальное (т. е. не превышает 7% от введенной дозы радиоактивности) или повышено незначительно. Размеры ее не увеличены или увеличены нерезко.
В начальной стадии цирроза печени сканографическая картина может быть исходной с изображениями, получаемыми при хроническом гепатите: распределение радионуклида в ткани печени гомогенное, накопление радионуклида в селезенке незначительное (рис. 12). По мере прогрессирования заболевания радионуклид накапливается преимущественно в центральных отделах правой доли, окружающих ворота печени, и определяется умеренное увеличение селезенки. Далее в ходе характерной для развернутых фаз цирроза атрофии правой доли печени размеры этой доли уменьшаются, и коллоид накапливается преимущественно в компенсаторно гипертрофированной левой доле. Изображение печени становится нечетким вследствие снижения накопления в ней радионуклида и неравномерным (пестрым) в различных областях (рис. 13). Нередко одновременно четко видны не только селезенка, но и костный мозг позвоночника, активированный ретикулоэндотелий которого также начинает фиксировать радионуклид. Для далеко зашедших стадий цирроза печени характерно слабое и неравномерное изображение уменьшенной в размерах печени, в основном за счет атрофии правой доли, и перемещение основной массы радионуклида в резко увеличенную селезенку. При наличии большого асцита наблюдается смещение печени кнутри от правого края реберной дуги.
Основной причиной аномалий сканограммы печени при циррозе является снижение способности ретикулоэндотелиальных клеток печени захватывать радиоактивный колоид из крови, вследствие чего значительное количество не экстрагированного печенью радионуклида поглощается ретикулоэндотелием вне печеночной локализации. Плохое включение радионуклида в значительной степени обусловлено внутрипеченочными портока вальными шунтами, по которым он «ускользает» в общий кро воток. Отсюда пониженная интенсивность и негомогенность изображения печени при циррозе и повышенный захват радионуклида в селезенке и костном мозге. Исследования с введением радиоактивного вещества в верхнюю брыжеечную или селезеночную артерию и в печеночную артерию и определением степени его разведения в крови печеночной вены показали, что у больных циррозом печени шунтирование крови через предпе ченочные портокавальные коллатерали составляет в среднем соответственно 60 и 80% в системах мезентериальных и селезеночных сосудов [Ring-Larsen H., 1983].
Дифференциальный диагноз желтух
Интенсивная желтушная окраска кожи и видимых слизистых оболочек всегда является серьезным симптомом, требующим срочной госпитализации больного для выяснения причины желтухи. Нерезко выраженная желтушность—иктеричность склер без изменения цвета кожи или с небольшим ее желтушным оттенком — может наблюдаться при острых и хронических поражениях печени различной этиологии, неполной обструкции жел чевыводящих путей, гемолитических (предпеченочных) желтухах и при широко распространенной наследственной аномалии метаболизма билирубина с абсолютно благоприятным прогнозом — синдроме Жильбера.
Необходимость точного этиологического диагноза желтухи объясняется широким диапазоном взаимоисключающих терапевтических мероприятий при желтухах различного происхождения. Ошибка в диагнозе может привести к ненужному и опасному оперативному вмешательству у больного с тяжелой гепа-тоцеллюлярной недостаточностью или с внутрипеченочным хо лестазом, принятыми за механическую желтуху, или, наоборот, к невыполнению необходимой по жизненным показаниям декомпрессии желчных путей при внепеченочной обструктивной желтухе. Нерациональна также массивная медикаментозная терапия (иногда стероидными гормонами!) больным синдромом Жильбера, принятым за «обострение хронического гепатита» или даже «цирроза печени». Лекарственное лечение при этой аномалии обмена не показано.
Основными диагностическими проблемами, решаемыми у больного желтухой, являются: 1) дифференциальный диагноз, предпеченочных (гемолитической и шунтовой гипербилирубине мии), печеночных транспортно-микросомальных (функциональных) гипербилирубинемий и гепатоцеллюлярной желтухи, обусловленной органическим поражением печеночных клеток 2) дифференциальный диагноз гепатоцеллюлярной и механической (обструктивной), постпеченочной желтухи; 3) дифференциальный диагноз внутрипеченочного (терапевтического) и вне печеночного (хирургического) холестаза (табл. 5).
Дифференциальный диагноз желтух включает 3 последовательных этапа, из которых первые два обязательны при любой желтухе, а третий используется только при необходимости исключения постпеченочной желтухи. Первый этап — анализ общеклинических данных: анамнеза, изменений, найденных при объективном исследовании; второй этап—анализ лабораторных показателей; третий—методы инструментальной диагностики, позволяющие изучить состояние внутрипеченочных и внепече ночных желчных путей визуально: а) неинвазивные методы:
ультразвуковое исследование гепатобилиарной системы и под желодучной железы, компьютерная томография; б) инвазивные методы: эндоскопическая ретроградная холангиопанкреатико графия (ЭРХП) (проводится только после предварительной эзофагогастродуоденоскопии с осмотром дуоденального сосочка); лапароскопия; чрескожная транспеченочная холангиогра фия (проводится только в условиях специализированного хирургического отделения).
Для гемолитической желтухи без вторичного поражения печени характерны лимонный оттенок желтухи, умеренная не конъюгированная гипербилирубинемия, уробилинурия при отсутствии билирубинурии (ахолурическая желтуха), темно-коричневый цвет кала в связи с увеличением содержания в нем сгеркобилина, признаки регенераторной реакции костного мозга (периферический ретикулоцитоз, гиперплазия эритропоэтиче ского ростка костного мозга) и умеренная нормохромная нор моцитарная анемия, иногда с небольшим лейкоцитозом и тром боцитозом вследствие сопутствующего раздражения соответствующих ростков костного мозга (при компенсированном гемо лизе анемия отсутствует), возможны спленомегалия (в связи с
Таблица 5. Дифференциальный диагноз желтух
|
Характер гипербилирубивемии |
|
Патогенез |
|
Диагностические критерии |
|
Примеры нозологических форм |
Предпеченочная желтуха
|
Непрямая ная) |
|
(неконъгогирован- |
Избыточное разрушение эритроцитов периферической крови (гемолиз); повышенный распад клеток эритроядного ряда в костном мозге (шунт-гиперби лирубинемия); обширные гема твмы
Умеренная непрямая гипер билирубинемия, умеренная нормохромная анемия, рети кулоцитоз (отсутствует при шунт-гипербилирубинемии); ги погаптоглобинемия; уробилин урия без билирубинурии (ахо лурическая желтуха), повышение уровня стеркобилина в суточном стуле; гиперферремия;
изменения морфологии, биохимических и функциональных параметров эритроцитов или клеток эритроидного ряда;
спленомегалия (при гемолизе), гемосидероз печени и других органов, билирубиновые желчные камни, гиперплазия или аномалии красного ростка костного мозга, нормальные или субнормальные показатели функциональных проб печени
Врожденный микросфероци гоз, другие врожденные формы гемолитической желтухи; диз-эритропоэз при талассемии, других гемоглобинопатиях и при заболеваниях системы крови
|
Молекулярная |
Печеночная желтуха
(ультраструктурная) желтуха
|
Непрямая ная) или ванная) |
(неконъюгирован - Генетически обусловленное или Изолированный характер ги - Синдромы Жильбера, Кригле-прямая (конъюгиро-приобретенное нарушение за-пербилирубинемии (отсутствие ра—Наджара (II типа), не^-хвата и транспорта (предмик - признаков органического по - которые виды лекарственной
росомные формы) непрямого билирубина или экскреции в желчь прямого билирубина (постмикросомные формы)
ражения паренхимы печени),
возможно сочетание с умеренным гемолизом
желтухи с некон-ьюгированной гипербялирубинемией; синдромы Дабина — Джонсона и Ротора (конъюгированная гипер-билирубинемия)
|
Гепатоцеллюлярная |
|
Смешанная (прямая и непрямая) |
(паренхиматозная) желтуха
Органическое поражение ге - Клинические и лабораторные
патоцита приводящее к не - признаки некротического пора - гепатиты, циррозы печени,
способности Печеночных кле - жения н функциональной недо
гок захватывать, метаболизи - статочности печени (синдромы обращения ^
|
ровать рубин |
и экскретировать били - цитолиза или снижения сннте - статочность правого сердца
тической способности)
Х ол ест а т и ч ее к а я желтуха
|
Прямая (конъюгированная) |
Уменьшение или прекращение тока желчи, сопровождающееся регургитацией ее составных частей (неконъюгирован ный билирубин, холестерин, желчные кислоты) в ток крови вследствие нарушения экс креторной способности гепато цита (гепатоцеллюлярный хо лестаз) или поражения внут_ рипеченочных желчных путей на уровне холангиол (дукту лярный холестаз) или более крупных протоков (дукталь ный холестаз)
Клинико-биохимический синдром холестаза при отсутствии механического препятствия во внепеченочных желчных путях по данным радионуклид ных и инструментальных исследований
Острые лекарственные гепатиты (анаболические стероиды, пероральные противозачаточные средства); доброкачественный идиопатический реци дивирующий холестаз; холестаз беременных; доброкаче^ ственный послеоперационный холестаз, желчный перитонит
реакцией ретикулоэндотелия селезенки) и гепатомегалия (гемо сидероз печени). Гиперферремия при хронических формах нередко отсутствует, но всегда бывает снижение продолжительности жизни эритроцитов периферической крови при пробе с "Сг (норма 120 дней). Пр всех гемолитических состояниях чувствительным показателем является снижение концентрации в сыворотке крови гаптоглобина в связи с потреблением его на связывание гемоглобина из распадающихся эритроцитов или их предшественников. Активность аминотрансфераз и ЩФ крови при гемолизе нормальна, отсутствует диспротеинемия, если ге молиз не является вторичным феноменом при хронических заболеваниях печени или системных заболеваниях.
Иллюстрацией служит следующее клиническое наблюдение.
У больного М., 34 лет, постоянная умеренная желтуха, повышенная утомляемость и небольшая гепатомегалия наблюдались на протяжении 18 лет Далее была обнаружена спленомегалия и диагностирован «цирроз печени: Через 2 года появились частые приступообразные боли в области правого подреберья, сопровождавшиеся нарастанием желтухи (билирубин крови до 306 мкмоль/л). На операции обнаружен флегмонозно измененный желчный пузырь, содержавший большое количество билирубиновых конкрементов с обширным спаечным процессом вокруг. Послеоперационный период осложнился развитием холедоходуоденального свища, закрывшегося самостоятельно, после чего уровень билирубина крови снвизился до 170 мкмоль/л. Больной поступил в нашу клинику, где была выявлена интенсивная желтушность, гепато спленомегалия, умеренная анемия при наличии в крови единичных нормо бластов, бе? тромбоцитопении и лейкопении, значительный ретикулоцитоэ (120—110°/оо), снижение среднего диаметра эритроцитов до 6,28 мкм; в пунк-тате костного мозга — резко выраженная гиперплазия эритроидного ростка. Вскоре билирубин крови снизился до 98,6 мкмоль/л (прямой 11,9 мкмоль/л), отмечалась также умеренная транзиторная гиперфосфатаземия (156—ЮОед/л при норме до 100 ед.), гиперферремия (35,8 мкмоль/л при норме до-26 мкмоль/л) и незначительная гипераминотрансфераземия, при отсутствии диспротеинемии. Таким образом, у больного врожденной микросфероцитарной гемолитической анемией, ошибочно принятой за цирроз печени, заболевание осложнилось желчнокаменной болезнью и флегмонозным холециститом, который привел к развитию механической желтухи (очевидно, по механизму синдрома Мирицци — воспалительного стеноза общего желчного протока) и вторичному поражению паренхимы печени.
Умеренный периферический гемолиз, как правило, наблюдается у больных на далеко зашедших стадиях цирроза печени,. обусловливая неконъюгированную гипербилирубинемию и рети кулоцитоз.
Редкими причинами предпеченочной желтухи могут быть инфаркт легких с застоем в печени, абсорбция излившейся в полости тела крови после травмы, травматизация эритроцитов в полостях сердца у больных с протезами сердечных клапанов.
При исключении гемолиза как причины неконъюгированной гипербилирубинемии у больных без клинических и лабораторных признаков органического поражения печени наиболее вероятной причиной небольшой хронической желтухи является синдром Жильбера.
Синдром Жильбера, наблюдающийся у 1—5% населения,. наследуется по аутосомно-доминантному типу, обусловлен де
фектом транспорта и конъюгации билирубина в печеночной клетке, диагностируется чаще у юношей и молодых мужчин (соотношение мужчин и женщин 10:1). Больные часто не предъявляют никаких жалоб, но отмечают периодическое появление желтушной окраски склер и реже кожи. Возможны жалобы астенического (быстрая утомляемость), диспепсического, неврастенического и алгического (длительные тупые боли или чувство тяжести в области правого подреберья) характера. Эти жалобы, как правило, не имеют органической основы и носят, по-видимому, ятрогенный, функциональный характер. Больные часто невротизированы, родители их, как правило, весьма обеспокоены наличием у ребенка стойкой желтушно сти—отсюда распространенное обозначение молекулярных транспортных или энзимопенических доброкачественных наследственных гипербилирубинемий—«функциональные гипербили рубинемии».
Для синдрома Жильбера характерен изолированный характер непрямой гипербилирубинемий, которая лишь у единичных больных превышает 50—70 мкмоль/л, составляя в среднем, по нашим данным, 32,3±4,35 мкмоль/л [, , 1977]. Все остальные функциональные печеночные пробы, включая пробу на задержку бромсульфалеина, антипириновую пробу, пробы с нагрузкой галактозой и на клиренс желчных кислот, а также серологические показатели нормальны. У больных отсутствует гепато - и спленомегалия, но неуплотненный нижний
•край правой доли печени может пальпироваться у края реберной дуги. У некоторых больных несколько увеличена селезенка в связи с нередко сопутствующим синдрому Жильбера гемоли тическим компонентом. Анемия не характерна, часто бывает низкая СОЭ (3—5 мм/ч). Транзиторные субнормальные показатели отдельных печеночных проб (нестойкое умеренное повышение активности аминотрансфераз или небольшая гиперфосфа таземия, преходящая умеренная диспротеинемия) не имеют существенного диагностического значения и не противоречат диагнозу синдрома Жильбера. Для этого синдрома особенно характерно нарастание билирубинемии и желтухи в условиях эмоционального или физического стресса (экзаменационный период, психическая травма, чрезмерные физические нагрузки), при интеркуррентных острых инфекциях, операциях, после употребления алкоголя, при голодании или низкокалорийной диете с низким (33% общих калорий и менее) содержанием липидов (безлипидная диета, например, при питании сырыми фруктовыми и овощными соками, резко снижает клиренс билирубина), а также после приема никотиновой кислоты или рифа мицина.
Одной из наиболее убедительных диагностических проб при синдроме Жильбера является проба с введением индукторов транспортных белков и глюкуронилтрансферазы гепатоцита — фенобарбитала или зиксорина: через 10 дней после начала перорального введения фенобарбитала в суточной дозе 0,1— 0,15 г (по 0,05 г 2—3 раза в день) или при лечении зиксорином в течение 5—7 дней) (по 200мг Зраза в день после еды) у больных было отмечено значительное снижение или нормализация уровня билирубина крови. Этот феномен имеет также большое психотерапевтическое значение, наглядно демонстрируя больному и его родственникам функциональный характер аномалии. В связи с благоприятным во всех отношениях прогнозом лица с синдромом Жильбера нуждаются только в постановке точного диагноза и в интенсивной психотерапии, которая, как правило, приводит к облегчению субъективных жалоб [Логинов А. С. и др., 1978].
Синдром Жильбера, впервые выявленный вскоре после перенесенного ОВГ, получил название «постгепатитная гипербили рубинемия». Она наблюдается у 4—6% больных, перенесших ОВГ, и может сочетаться с хроническим вирусоносительством с ХПГ и ХАГ вирусной этиологии и поэтому нередко требует подтверждения пункционной биопсией печени. Наличие у больного синдрома Жильбера не должно заслонять от врача возможности другой, гораздо более серьезной патологии.
У юноши 17 лет, поступившего в нашу клинику с диагнозом? «доброкачественная гипербилирубинемия», был выявлен наряду с синдромом Жильбера тяжелый врожденный порок сердца, обусловивший развитие внезапной сердечной декомпенсации, из которой больного с трудом удалось вывести. Важно иметь виду, что умеренная неконъюгированная гипербилирубинемия, не связанная с явным гемолизом, является частой клинической находкой и всегда, особенно у лиц среднего возраста, требует обследования больного для исключения органического заболевания гепатобилиарной сферы, сердечно-сосудистой или эндокринной системы, полицитемии, инфекционных, почечных и онкологических заболеваний и лекарственной интоксикации.
Интенсивная желтуха (билирубин крови 85—170 мкмоль/л) за редкими исключениями обусловлена конъюгированной гипер билирубинемией и указывает на органическое поражение печени или механическое препятствие току желчи.
Для гепатоцеллюлярной желтухи, как правило, свойственны другие лабораторные признаки поражения гепатоцитов: гипер аминотрансфераземия, гиперферремия, диспротеинемия (при ХАГ и циррозах печени). Стойкая гепатоцеллюлярная желтуха, не уменьшающаяся в течение 2 нед пребывания больного в. стационаре, является тревожным симптомом, указывающим на быстрое прогрессирование хронической гепатопатии.
При хронических гепатитах гепатоцеллюлярная желтуха наблюдается у 16% больных, при циррозах печени—у 50% [Groote J„ 1968].
При острых поражениях печени (ОВГ, острые токсические гепатиты, острый алкогольный гепатит, сепсис, тяжелая пневмония, брюшной тиф и другие инфекционные заболевания, ожоговая болезнь) и при тяжелых обострениях хронических гепатитов и циррозов печени часто отмечается сочетание гепатоцел люлярной желтухи с внутрипеченочным холестазом. Нередко картина холестаза является доминирующей: отмечается зуд кожи, выраженная желтуха, при большой длительности приобретающая зеленоватый оттенок, больше свойственный обту рационной желтухе (окисление билирубина в биливердин). Болевой синдром не имеет абсолютного диагностического значения. Быстрое развитие желтухи после интенсивного болевого приступа в верхней половине живота обычно наблюдается при закупорке желчевыводящих путей камнем или воспалительно увеличенной головкой поджелудочной железы при панкреатите. Тем не менее многие больные с желтухой паренхиматозного типа также отмечают наличие перемежающихся или даже приступообразных болей в области правого подреберья, иногда предшествующих появлению или нарастанию желтухи. Эти боли, по-видимому, связаны с воспалительно-некротическими процессами в печени.
В таких случаях крайне важно избежать ненужного и опасного для больного оперативного вмешательства. Ch. W-ittich,(1968) сообщает о гибели от острой печеночной недостаточности с печеночной комой 7 (25%) из 28 больных гепатитом с внутри печеночным холестазом, которым была проведена диагностическая лапаротомия. Необходимо помнить о возможности внутри печеночного холестаза при любом остром и хроническом заболевании печени. Тенденция «на всякий случай» провести больному пробную лапаротомию «для уточнения диагноза» при современном уровне диагностических возможностей не должна иметь места. У больных с резко выраженной гипераминотранс фераземией (более чем в 5 раз по сравнению с нормой) необходимо тщательно проверить проходимость внепеченочных желчный путей инструментальными методами.
У больной Н„ 63 лет, заболевание началось с интенсивного зуда кожи, потемнения мочи, тошноты и слабости. При обследовании в районой больнице Москвы выявили смешанную (с преобладанием прямого) гипербилирубине мню (170 мкмоль/л, прямой билирубин—114,7 мкмоль/л), умеренное повышение активности АсАТ и АлАТ и гиперпротеинемию (85,4 г/л), в анализах крови—лейкопению и низкую СОЭ (3 мм/ч), при лапароскопии — ограниченный местный перитонит в области желчного пузыря, печень коричнево-красного цвета, край заострен. При лапаротомии, проведенной через 2 мес после начала заболевания, был заподозрен рак головки поджелудочной железы («уплотнение» 2Х1 см) и наложен холецистоэнтероанастомоз с брауновским соустьем. Однако при проведенных через Г/а мес после операции ретроградной холангио панкреатографии и компьютерной томографии диагноз опухоли не подтвердился. Вскоре после операции у больной развился отечно-асцитический синдром, правосторонний плевральный выпот; в биохимических анализах крови определялись резко выраженная диспротеинемия, гипертрансаминаземия (АлАТ 2 мкмоль/л, АсАТ 1,35 мкмоль/л), сохранялись симптомы внутрипе ченочного холестаза: конъюгированная гипербилирубинемия, гиперфосфатазе мия (364—255 ел/л). У больной пальпировались уплотненная печень и край селезенки, на сканограмме печени отмечалось повышенное накопление радиоактивного коллоида в ткани селезенки. Под влиянием консервативной терапии •состояние больной улучшилось, значительно уменьшилась желтуха, исчезли асцит и плевральный выпот. Таким образом, операция, проведенная после весьма поверхностного обследования (больной не провели даже электрофоре тического исследования белков сыворотки крови), не способствовала уточнению диагноза, но привела к декомпенсации цирроза печени, протекавшего с внутрипеченочным холестазом.
G. Roschlau и соавт. (1983) сообщили о больном 30 лет с тяжелым алкогольным гепатитом, скончавшемся после второй операции по поводу предполагавшейся «механической желтухи».
К редким формам внутрипеченочного холестаза относятся холестаз беременных, холестаз при сепсисе и тяжелых острых бактериальных инфекциях, альвеококкозе и амилоидозе печени, первичный склерозирующий холангит, идиопатический доброкачественный рецидивирующий внутрипеченочный холестаз (синдром Саммерскилла), холестатические поражения печени при врожденных метаболических дефектах (дефицит антитрипси на, галактоземия, врожденная непереносимость фруктозы, тирозина, болезнь Нимана—Пика), холестазы при болезни Кароли {врожденное расширение внутрипеченочных желчных протоков), лимфогранулематозе, холестаз при саркоидозе, нередко принимаемый за первичный билиарный цирроз печени, при муковис цидозе (кистозный фиброз поджелудочной железы), при полном парентеральном питании и после массивного гемолиза (синдром сгущенной желчи), послеоперационные желтухи с внутрипеченочным холестазом. Холестатическая желтуха вследствие массивной инфильтрации печени пролиферирующими и сдавливающими мелкие желчные протоки бластными клетками при макро фагальных гемобластозах сопровождается лихорадкой, лимфа денопатией, гепатоспленомегалией и панцитопенией [Воробьев А. И., , 1983; Gupta Sh. et al., 1980].
Холестаз беременных является доброкачественным заболеванием, рецидивирующим в течение последних 4 мес беременности и полностью исчезающим после родов. Прогноз менее благоприятен для плода в связи с большой частотой преждевременных родов и мертворождений.
27 лет, имела на протяжении 5 лет 3 беременности, во время каждой из которых с III—V месяца возникал интенсивный зуд и вскоре—желтуха с повышением концентрации общего билирубина крови до 77 мкмоль/л, прямого до 39 моль/л, ЩФ — до 297 ЕД/л, СОЭ до 37 мм/ч. Все беремен яости закончились преждевременными родами мертвым плодом, после родов желтуха и зуд полностью исчезали, состояние больной быстро нормализовалось. В пунктате печени, полученном на фоне нормального самочувствия, при. знаки гепатита и холестаза отсутствовали.
Первичный склерозирующий холангит—неясной этиологии медленно прогрессирующее воспалительно-склерозирующее поражение внутри - и внепеченочных желчных протоков с их постепенной облитерацией. Он развивается у больных, не переносивших ранее операций на желчных путях. В отличие от первичного билиарного цирроза печени чаще наблюдается у мужчин в возрасте до 50 лет. Заболевание проявляется нарастающей желтухой холестатического типа с умеренной гепатомегалией без спленомегалии, зудом, гиперфосфатаземией, умеренной гипер аминотрансфераземией, часто с эозинофилией, повышением СОЭ до 30—60 мм/ч. В противоположность первичному билиарному циррозу антитела к компонентам митохондрий не определяются и значительного нарастания концентрации IgM крови не бывает Нередко отмечаются боли в области правого подреберья и эпизоды острого холангита с интермиттирующей лихорадкой и ознобом. Первичный склерозирующий холангит развивается у 4% больных язвенным колитом, обычно нетяжелого течения [Schrumpf Е., Gjone Е., 1982], реже у больных ретроперитоне альньш фиброзом, тиреоидитом Риделя, болезнью Крона и им мунодефицитными состояниями. На внутривенных холангио граммах отмечают резкое диффузное сужение и очаговые расширения крупных внутрипеченочных и внепеченочных желчных путей [Bass N., 1983].
Средняя продолжительность жизни больных около 7 лет В поздних стадиях развивается цирроз печени с явлениям портальной гипертензии. Дифференциальный диагноз проводят со вторичным склерозирующим холангитом, развивающимся на почве бактериальной инфекции, при котором, как правило, имеется механическое препятствие оттоку желчи (камень, стриктура). Для него характерно расширение желчного протока проксимальнее препятствия или кистевидное расширение внутрипеченочных желчных ходов в связи с закупоркой их паразитарными гранулемами [, , 1981]»
У больных рецидивирующим доброкачественным внутрипе ченочным холестазом периоды интенсивного холестаза длительностью от 2—3 нед до 7—8 мес и более сменяются полной кли нико-биохимической ремиссией.
25 лет, с 7-летнего возраста перенесла 4 эпизода холестаза продолжительностью около 10 мес каждый. Интервалы с хорошим самочувствием, нормальными размерами печени и биохимическими пробами продолжались в течение ЗУа—5 лет. Во время холестатических атак отмечались интенсивная желтуха, резкий зуд кожи, умеренная гепатомегалия, повышение СОЭ, гипербилирубинемия (до 240 мкмоль/л, прямая фракция — 120 мкмоль/л),. гиперфосфатаземия без значительной гаперхолестеринемии и без диспро теинемии, умеренное (менее чем в 2 раза) нарастание активности сывороточных аминотрансфераз. В пунктате печени, полученном на высоте холестаза, отмечено резкое расширение желчных капилляров, в просвете которых были видны желчные тромбы, активация звездчатых эндотелиоцитов и незначительная инфильтрация портальных трактов гистиоцитарными клетками.
Редко встречаются наследственные доброкачественно текущие конъюгированные гипербилирубинемии, имитирующие внут рипеченочный холестаз,—синдром Дабина—Джонсона и синдром Ротора. При обеих формах нарушены молекулярные механизмы экскреции конъюгированного билирубина в желчь. Некоторых больных, помимо умеренной желтушности с билирубину рией, беспокоят слабость, иногда, в период усиления желтухи интенсивная и коликообразная боль в правом подреберье. Зуд отсутствует, уровень желчных кислот и холестерина, актив .ность ЩФ крови нормальные. При синдроме Дабина—Джонсона у некоторых больных бывает умеренное увеличение печени и селезенки, желчный пузырь при пероральной холецистографии не виден. Отрицательная холецистограмма при болевом синдроме может явиться поводом к ошибочной холецистэктомии. Печень макроскопически темно-серого или аспидно-черного цвета в связи с накоплением крупнозернистого меланиноподобного, не содержащего железо темно-коричневого пигмента между ядром и каналикулярной мембраной гепатоцита. При синдроме Ротора пигмент в гепатоцитах не накапливается, печень имеет обычный цвет; желчный пузырь контрастируется.
Внепеченочный холестаз обусловлен снижением или прекращением поступления желчи в двенадцатиперстную кишку вследствие механического препятствия на уровне крупных внепече дочных желчных протоков. Наиболее ответственным является "точный диагноз подпеченочной механической желтухи, обычно •неотличимой по биохимическим данным от внутрипеченочного холестаза. И при внутрипеченочном, и при внепеченочном холе стазе диспротеинемия может отсутствовать, активность аминотрансфераз в норме или умеренно повышается. Резко выражен яая гипераминотрансфераземия (в 5—10 раз выше нормы) и диспротеинемия более свойственны внутрипеченочному холеста зу при ОВГ, ХАГ или циррозе печени. При ХАГ и циррозе печени холестаз часто сочетается с симптомами хронической ге патопатии: гепато - и спленомегалией, кожными телеангиэкта зиями, ксантомами и ксантелазмами, гиперпигментацией кожи, геморрагическим диатезом.
Н. Тищенко (1973) отмечает, что основной причиной поздней диагностики механической желтухи является необоснованный диагноз болезни Боткина (т. е. поверхностное обследование больного), в частности невыявление симптома Курвуазье [Позд невич И. Р., 1983]. Острый приступ болей в правом подреберье, эпигастральной области или в верхней половине живота с развитием через 24—48 ч желтухи весьма подозрителен на острый холецистит и холедохолитиаз. Такие больные подлежат срочной госпитализации в хирургическое отделение [, Буром ская Г. А., 1983]. Желтуха с болью и температурой интермитти рующего типа, с ознобом, потом, нейтрофильным лейкоцитозом, нарастанием желтушности на высоте лихорадки и уменьшением при снижении температуры тела наблюдается при восходящем обструктивном гнойном холангите, который почти у всех больных обусловлен желчнокаменной болезнью и является абсолютным показанием к неотложной операции с целью дренирования внепеченочных желчных путей. У лиц пожилого возраста, страдающих хроническим бактериальным холангитом, боли, желтуха и температурная реакция могут быть выражены нерезко или отсутствовать: заболевание в таких случаях проявляется только слабостью, субфебрилитетом, анорексией, похуданием, повышением СОЭ, концентрации IgG крови, активности ЩФ сыворотки и инфекционно-токсической анемией.
При острой внепеченочной закупорке желчных путей наряду с ЩФ нарастает активность ГДГ сыворотки. Активность ами нотрансфераз в начальной стадии внепеченочного холестаза нормальна, но через 2—3 нед умеренно нарастает в связи со вторичным поражением печени. При ОВГ, активизации ХАГ и цирроза печени высокая активность аминотрансфераз отмечается с момента возникновения желтухи.
Медленно, но неуклонно нарастающая на протяжении нескольких недель холестатическая желтуха без боли или с длительной тупой болью в верхней половине живота, сопровождающаяся анорексией и упадком питания, свойственна обычно опухолевой обструкции желчных путей. Выраженного увеличения печени, повышения активности АсАТ и АлАТ не бывает, концентрация железа сыворотки в норме или снижена.
Точный топический диагноз механической желтухи до операции является решающим условием успешной терапии.
Больной 38 лет был переведен в нашу клинику из инфекционной больницы, где первоначально была диагностирована «холестатическая форма вирусного гепатита» и проведена терапия преднизолоном. У больного отмечалась интенсивная холестатическая желтуха с умеренной гипераминотрансфераземией
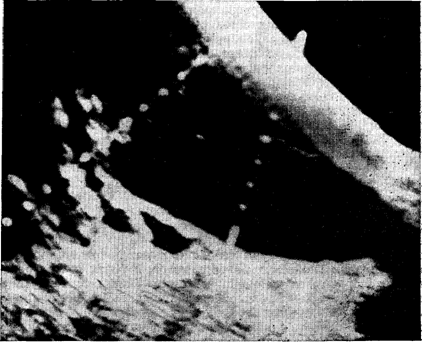
Рис. 14. Рак головки поджелудочной железы: резко увеличенный желчный пузырь (симптом Курвуазье). Сонограмма.
120
без диспротеинемии. Желчный пузырь пальпировать не удалось. При гастро скопии выявлена большая «стероидная» язва субкардиального отдела желудка, при дуоденографии и сонографии—увеличение головки поджелудочной железы. Далее больному в Институте хирургии им. Вишневского была успешно проведена обширная панкреатодуоденальная резекция по поводу рака головки поджелудочной железы. В данном случае причиной диагностической ошибки послужил молодой возраст больного, усыпивший «онкологическую иастороженность» наблюдавших его врачей.
Нередко лапаротомия без достаточных оснований проводится больным первичным билиарным циррозом печени, что можно объяснить только недостаточным знанием врачами-хирургами клиники этого заболевания.
Компенсаторное расширение путей оттока развивается на 7—8-й день после острой механической обструкции, обычно при уровне билирубина сыворотки более 50 мкмоль/л, а при хронической, постепенной обструкции—еще до развития видимой желтухи [Neumann Th. et al., 1982].
Наиболее удобен для больного с холестатической желтухой неинвазивный и достаточно информативный метод уточнения характера желтухи—сонография—ультразвуковое исследование печени, желчных путей и поджелудочной железы (рис. 14— 16). Сонография используется также для скрининга основных диффузных заболеваний печени: стеатоза, хронического гепати-
Рис. 15. Тот же больной. Расширение общего желчного протока.
та и цирроза печени [, , 1984].
При положительном результате сонографии показаны уточняющие исследования. Эндоскопическую ретроградную холан гиопанкреатографию (ЭРХП) в противоположность пероральной и внутривенной холангиографии можно проводить больным с повышенной чувствительностью к содержащим йод препаратам. Она особенно показательна при подозрении на холедохолитиаз без холангита, поскольку камни общего желчного протока у 8—40% больных локализуются в протоках нормального калибра [Vennes I., Bond I., 1983], а также при подозрении на стеноз дуоденального сосочка, механическую желтуху вследствие увеличения головки поджелудочной железы (при раке или индуративном панкреатите), склерозирующий холангит или синдром Кароли [Rosch W. et al., 1983].
Компьютерная томография наиболее информативна при очаговых поражениях печени: доброкачественных и злокачественных опухолях, простых и эхинококковых кистах, очаговой узел ковой гиперплазии.
Пункционная биопсия печени
Пункционная игла Менгини благодаря ее весьма малой трав матичности, практической безопасности (при тщательном учете
Рис. 16. Тот же больной. Расширение внутрипеченочных желчных путей. 122
противопоказаний к пункции и безупречной технике ее проведения), простоте в настоящее время стала универсальным инструментом для проведения диагностической пункционной биопсии печени.
Средняя величина цилиндрика ткани, извлекаемого при пункции печени иглой Менгини, при массе около 30 мг составляет /50000 часть массы всей печени. Вместе с тем объем диагностической информации, получаемой при правильной патоморфо логической оценке пунктата и тщательном сопоставлении гистологических данных с клиническими и лабораторными, чрезвычайно велик. Поистине «мал золотник, да дорог!» Необходимость в прижизненном морфологическом исследовании печени обусловлена нередким отсутствием параллелизма между клинико-био химическими показателями и характером патологического процесса в печени при наиболее распространенных хронических гепатопатиях и большим количеством болезней печени, точный диагноз которых без морфологического исследования невозможен (стеатоз, амилоидоз, пелиоз, болезни накопления, грануле матозные гепатиты), так как наиболее распространенные функциональные пробы печени при них не изменены или неспецифичны. Важным аспектом пункции является также возможность контроля динамики острой и хронической гепатопатии.
При ОВГ решающее значение для диагноза перехода заболевания в хроническую форму имеет пункция печени в связи с отсутствием параллелизма между интенсивностью желтухи и исходом гепатита [Мансуров X. X., 1965; Haupt R. et al., 1977].
Основным показанием к пункционной биопсии печени является необходимость постановки точного диагноза при обоснованном подозрении на активное прогрессирующее диффузное хроническое заболевание печени, особенно в начальной его стадии, или на инфильтративное поражение печени при гемобла стозах.
Пункция с целью подтверждения «нормы» не оправдана, как и любое другое травмирующее вмешательство, у практически здорового человека. Поэтому анамнестические данные (например, перенесенный в прошлом ОВГ) сами по себе не служат показанием к пункции: нормальные размеры печени и селезенки и нормальные показатели биохимических печеночных проб и серологических реакций практически исключают хроническое прогрессирующее заболевание печени. Диагноз гипер <)илирубинемии Жильбера, хронического холецистита, дискине зии желчных путей, постгепатитного вегетодистонического и астенического синдрома, болевого синдрома, обусловленного перигепатитньш спаечным процессом, неспецифического реактивного гепатита у большинства больных не требует проведения пункции печени и может быть установлен обычными клиническими и лабораторно-инструментальными методами.
Типичными примерами показаний к пункции печени явля
ются уточнение степени активности хронического гепатита (дифференциальный диагноз ХПГ и ХАГ) или начальной стадии. цирроза печени, гепатомегалия или спленомегалия с нормальными биохимическими печеночными пробами, желтуха или лихорадка неясной этиологии (при исключении механической обструкции желчных путей), подозрение на гемохроматоз, ами лоидоз, гранулематозную болезнь, болезни накопления, поражение печени при порфирии и других заболеваниях системы крови.
Лишь в редких случаях патоморфологическое исследование пунктата позволяет поставить нозологический диагноз. Необходимо сопоставление клинических, лабораторных, инструментальных и морфологических данных, так как возможны ложноотри цательные и ложноположительные результаты пункции даже при диффузных заболеваниях печени и однотипные патоморфо логические реакции печени на самые различные повреждающие этиологические факторы [, , 1982). Клиницист не должен опускаться до уровня простого регистратора патоморфологических заключений [Thaler Н., 1982]. При пункционной биопсии невозможно также точное распознавание морфологической формы цирроза [Мансуров X. X., 1965; Sheu er P., 1968].
Врач-морфолог может решиться поставить диагноз только при наличии в биоптате не менее 3 портальных трактов [Eriin ger S., Degott С., 1973]. Микроскопически цирроз печени может быть установлен с достаточной достоверностью только при получении нефрагментированного цилиндрика печеночной ткани длиной 1,5—2 см [Vido I., Winckler К., 1872]. Ложноотрицатель ные результаты пункции наблюдаются с частотой до 20—30% при макронодулярных циррозах печени, особенно при неполной септальной (постгепатитной) его разновидности, в случае попадания иглы в крупный регенераторный узел с сохраненной структурой печеночных долек, в связи с неравномерностью поражения различных отделов печени. Возможны ложноотрица тельные результаты и при ХАГ, который на стадии ремиссии морфологически может не отличаться от ХПГ. Морфологическая картина часто не дает информации об этиологии поражения печени. Изменения типа ХАГ возможны при гепатитах вирусной, аутоиммунной и алкогольной этиологии, при болезни Вильсона—Коновалова, макроглобулинемии Вальденстрема. Картины жировой печени, ХПГ, внутрипеченочного холестаза и фиброза печени наблюдаются при различных заболеваниях, Липофусциноз печени возможен при злоупотреблении фенацетином или производными пиразолина, при синдроме Жильбера и хронических заболеваниях желудочно-кишечного тракта. Изменения, свойственные 1-й стадии первичного билиарного цирроза, можно видеть при ХАГ, склерозирующем холангите и поражении печени при макроглобулинемии Вальденстрема [Rosch lau G„ 1977]. Некоторые формы ХПГ морфологически трудна отличимы от ХАГ с умеренной активностью и от неспецифического реактивного гепатита. Морфология ОВГ и острого лекарственного гепатита может быть идентичной. Труден дифференциальный морфологический диагноз между идиопатическим гемохроматозом и резко выраженным гемосидерозом печени при хроническом алкоголизме, часто на фоне алкогольного цирроза печени, или сидерозом печени после портосистемных шунтирующих операций, между первичным билиарным циррозом печени и ХАГ с внутрипеченочным холестазом. Чрезвычайно широк спектр морфологических изменений печени при некоторых системных заболеваниях. Так, у больных язвенным колитом при поражении печени можно видеть картину неспецифического реактивного гепатита, жировой дистрофии, ХПГ, ХАГ, ХАГ с холестазом, первичного склерозирующего холангита и цирроза печени. Ложноположительные результаты исследования пунктата возможны при затяжном течении ОВГ (более 6 мес, иногда до года), интерпретируемом как ХАГ, особенно при ОВГ-А, который часто протекает с явлениями перипортального воспаления, холестазом и ступенчатыми некрозами [Roschlau G., 1984]. Иногда безобидный остаточный фиброз после перенесенного ОВГ расценивается как цирроз печени.
Эволюция морфологических изменений нередко зависит не от характера их, а от этиологии. Так, несмотря на то, что гистологическая картина ХАГ в период ремиссии идентична таковой при ХПГ, рецидивы возможны при отмене глюкокортикостерои дов. Лекарственный гепатит с мостовидными некрозами дольки и мультилобулярными некрозами имеет значительно лучший прогноз, чем ОВГ или ХАГ с такой же гистологической картиной [Spitz R. D. et al., 1978]. При лечении ОВГ кортикостерои дами за кажущимся клиническим и морфологическим улучшением нередко скрывается постепенный переход острого гепатита в хронический; та же терапия при аутоиммунном ХАГ может вызывать полную морфологическую ремиссию, предотвращая исход ХАГ в цирроз печени.

|
Из за большого объема эта статья размещена на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 11 |



