При заболеваниях печени лихорадка наиболее часто отмечается у больных первичным и вторичным раком печени, гнойным и амебным абсцессом печени, при восходящем гнойном холан гите у больных холедохолитиазом и при инфицированном аль веококкозе.
У 2\з больных циррозом печени лихорадка обусловлена не заболеванием печени, а сопутствующими инфекционными поражениями—пневмонией, асцитом-перитонитом и др. Частые инфекционно-септические осложнения наряду с острыми желу. дочно-кишечными кровотечениями и токсическим действием лекарств относятся к важнейшим причинам декомпенсации цирроза с нередким исходом в печеночную кому. Поэтому при лю <бых инфекционных осложнениях у больных циррозом необходима срочная и энергичная терапия. Развитию септицемии, обусловленной, как правило, грамотрицательными возбудителями, способствуют инфекционная диарея, требующая лечения антибиотиками широкого спектра, а также очаговые гнойные процессы, подлежащие срочной санации. Назначение глюкокортико
•стероидов у больных циррозом печени с длительной высокой
•лихорадкой оправдано только после тщательного исключения
•ее инфекционного происхождения, в частности после получения повторных отрицательных результатов бактериологического исследования крови, взятой на высоте лихорадки, отрицательных кожных реакций и бактериологических исследований мокроты и смывов бронхов на туберкулез и при неэффективности пробной терапии антибиотиками.
Важно учитывать снижение противоинфекционного иммунитета у больных циррозом печени, особенно алкогольной этиологии, и при циррозах, леченных иммунодепрессивными препаратами.
У больных циррозом печени, получающих глюкокортикостероиды, часто наблюдают быструю генерализацию инфекции.. Фурункул может осложниться флегмоной без температурной реакции, постинъекционный абсцесс может привести к развитию септицемии и септикопиемии. Сепсис иногда принимают за аллергическую лекарственную реакцию в связи с такими типичными для сепсиса проявлениями, как воспалительное поражение суставов с полиартралгией и геморрагической пурпурой. Кишечная инфекция может осложниться развитием асцита-пе ритонита.
Портальная гипертензия
Стойкое повышение давления крови в портальной системе-наблюдается при циррозе печени любой этиологии и на любом этапе заболевания. У здоровых людей через печень протекает около 1 л портальной и 0,5 л артериальной крови за 1 мин при низком давлении (4—6 мм рт. ст.). Оба потока соединяются на уровне синусоидов, где смешанная портальная и артериальная кровь интенсивно контактирует с микроворсинками гепатоци тов в пространствах Диссе, обеспечивая выполнение печенью ее многочисленных метаболических функций. Нарастающее повышение механической резистентности току крови вследствие нарушения архитектоники печени в сочетании с повышенным притоком крови через систему печеночной артерии приводит к постепенному увеличению давления в главном стволе воротной вены до достижения плато на уровне 25—30 мм рт. ст. К моменту, когда портальное давление достигает этого уровня, развивается интенсивная коллатеральная циркуляция, которая предупреждает дальнейшее нарастание портальной гипертензии. Особенно опасны анастомозы, переводящие портальную кровь через непарную вену и левую коронарную вену желудка в тонкостенные подслизистые и периадвентициальные венозные сплетения нижней трети пищевода и кардиального отдела желудка. Анастомозы между системами воротной и нижней полой вены (в обход внутрипеченочного препятствия) образуются в передней брюшной стенке, вокруг прямой кишки и между селезеночной и левой почечной венами, это может вызвать тяжелые геморроидальные кровотечения и развитие синдрома портокаваль ной энцефалопатии, как после наложения портокавального шунта [Reynolds Т., Campra J., 1983].
Наряду с узловой регенерацией печени в патогенезе портальной гипертензии играет роль вторичный феномен «гидравлического затвора»: в условиях затруднения тока крови через разветвления печеночных вен величина портального давления еще более нарастает вследствие гидравлической передачи давления с печеночной артерии и ее артериовенозных анастомозов на воротную вену [Мансуров X. X., 1963J.
Следствиями портальной гипертензии при циррозе печени являются спленомегалия и гиперспленизм, снижение портального кровотока в среднем на 50% и повышение притока в печень артериальной крови со значительным ухудшением условий метаболизма печеночных клеток, кровотечения из варикозно. расширенных вен пищевода и желудка, гемодинамические сдвиги, способствующие развитию отечно-асцитического синдрома, тюртокавальная энцефалопатия и изменение фармакокинетики
•большинства лекарственных соединений.
В начальной, компенсированной, фазе портальная гипер тензия клинически не проявляется или проявляется неспеци
•фическими диспепсическими нарушениями—метеоризмом, на жлонностью к диарее, тошнотой и болью в подложечной области и правом подреберье. Биохимические пробы печени могут
•быть нормальными даже при резко выраженной портальной гипертензии. На начальной (доклинической) стадии портальная типертензия может быть выявлена при пункции селезенки с определением внутриселезеночного давления, путем катетери. зации печеночных вен и воротной вены или методом прямой чреекожной транспеченочной манометрии тонкой иглой, вводимой в воротную вену [ и др., 1984], а также при пробе с нагрузкой аммиаком и путем ультразвукового или ангиографичеокого рентгеноконтрастного исследования портальной системы.
На стадии начальной декомпенсации портальной гипертензии обнаруживаются выявляемое эндоскопически и менее надежно рентгенологически умеренное варикозное расширение вен нижней трети пищевода и нерезко выраженные явления
•гиперспленизма. Стадия декомпенсированной, или осложненной, портальной гипертензии характеризуется развитием одного или чаще нескольких симптомов: значительной цитопении (гиперспленизм), особенно часто тромбоцитопении с геморрагическим синдромом, резко выраженного варикозного расширения вен нижних ^з пищевода, овода и кардиального отдела желудка с возможными пищеводно-желудочными кровотечениями (рис. 22), развитием отечно-асцитического синдрома и портокавальной энцефалопатии.
Механическое препятствие току портальной крови может локализоваться на всем протяжении портальной системы: на тфедпеченочном ее отрезке (предпеченочная блокада, блокада портального притока), на уровне внутрипеченочных разветвлений (внутрипеченочная блокада) или на уровне внепеченочных стволов печеночных вен или надпеченочного сегмента нижней полой вены (постпеченочная блокада, блокада печеночного оттока). Приводим клинические варианты портальной гипертензии по локализации препятствия току венозной крови.
Локализация препятствия выявляется манометрическими и
•ангиографическими методами. В клинической практике они наиболее часто применяются при подозрении на внепеченочную форму портальной гипертензии и при необходимости проведения шунтирующих операций на портальной системе у больных с частыми пищеводными кровотечениями.
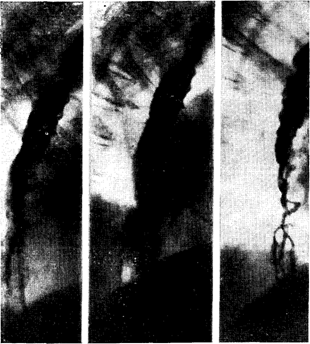
Рис. 22. Резко выраженное варикозное расширение вен пищевода при циррозе печени. Рентгенограмма.
Для определения синусоидального давления сердечный катетер проводят через локтевую вену, правые отделы сердца и нижнюю полую вену в одну из печеночных вен до заклинивания в небольшой внутрипеченочной вене: на кончик катетера передается синусоидальное венозное давление (рис. 23). Величина определяемого таким образом заклиненного подпеченоч ного венозного давления (ЗПВД) соответствует синусоидальному давлению. Свободное портальное давление (СПД), определяемое путем катетеризации или пункции основного ствола воротной вены, и внутриселезеночное давление отражает давление в пресинусоидальных разветвлениях воротной вены (пресинусоидальное давление). У здоровых лиц градиент между ЗПВД и СПД составляет всего 1—4 мм рт. ст.
Наиболее частым этиологическим фактором портальной гипертензии является цирроз печени. При циррозе печени в одинаковой степени повышены и ЗПВД, и СПД, составляя в среднем около 22 мм рт. ст. (или 30 см вод. ст.) и отражая гене-рализованное нарастание сопротивления току крови на протяжении всей сосудистой системы печени [Sherlock Sh., 1978]. Среднее СПД у больных циррозом печени с варикозно расширенными венами пищевода (40 см вод. ст.) значительно
Заклиненное печеночное венозное давление
|
и селезеночное. авление |
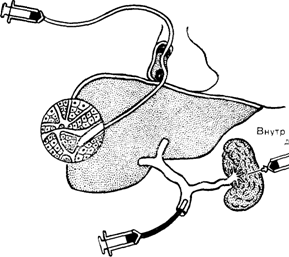
Свободное портальное давление
Рис. 23. Методы измерения давления крови в портальной системе [по Willi ams R„ 1976].
выше, чем у больных без расширения вен пищевода (30 см вод. ст.; нор^ма—16—25 см вод. ст.) [Christensen U. et al„ 1983]. При предпеченочной обструкции ствола воротной вены или ее ветвей ЗПВД нормально (около 4 мм рт. ст. или 5,5 см вод. ст.), а СПД и внутриселезеночное давление резко повышены, печеночный кровоток снижен. При постпеченочной блокаде, напротив, ЗПВД резко повышено, а СПД существенно не изменено. Повышенный (около 21 мм рт. ст.) портока вальный градиент (низкое давление в нижней полой вене и высокое ЗПВД) указывает на внутрипеченочную постсинусоидальную блокаду, нормальный градиент (около 5 мм рт. ст.)— на внутрипеченочную пресинусоидальную блокаду [Bertrand J. et al„ 1984].
Тяжесть клинических проявлений портальной гипертензии при циррозе печени (степень спленомегалии, гиперспленизма, варикозного расширения вен пищевода и желудка, развитие пищеводно-желудочных кровотечений) коррелирует с двумя гемодинамическими параметрами при условии совместного их учета: высотой портального давления (более 30 см вод. ст.) и увеличением (до 40 с и более) кардиопортального времени при радионуклидном его определении, характеризующим степень застоя крови в воротной системе [Мансуров X. X., 1976].
Контрастирование портальной системы осуществляется с помощью целиакографии (артериальной портографии). Применявшаяся ранее для рентгенографии портальной системы
Классификация портальной гипертензии
Нозологические формы
Гемодинамические показатели
|
Внутрипеченочная Пресинусоидальная Повышено СПД* и внутриселезеночное давление; ЗПВД** нормальное; портокавальный градиент существенно не изме-iHeH |
Цирроз печени, саркоидоз, альвеококкоз, шистосомоз, болезнь Кароли, врожденный фиброз печени, синдром Фелти, болезнь Гоше, кистозный фиброз поджелудочной железы, поликистоз печени, опухоли печени, частичная узелковая трансформация печени; идиопатическая портальная гипер тензия; нецирротический гепатопортальнын склероз (болезнь Банти)
Постсинусоидальная
|
Повышено ЗПВД. СПД и •внутриселезеночное давление нормальные или нерезко повышены, портокавальный градиент повышен |
|
Цирроз печени, центрально-дольковый фиброз печени алкогольной этиологии, веноок-клюзионная болезнь печени |
|
Сдавление или тромбоз ствола воротной или селезеночной вены; мигрирующий фле бит, портальный пилефлебит; аневризмы селезеночной и печеночной артерии, гигантская спленомегалия при миелопролифера тивных заболеваниях (полицитемия, остео миелофиброз, геморрагическая тромбоците мия); ретроперитонеальпый фиброз, синдром Крювелье — Баумгартена |
Предпеченочная (блокада портального притока)
Повышено СПД и внутриселе. зеночное давление. ЗПВД нормальное
|
Повышено ЗПВД. СПД нормальное. Портокавальный градиент повышен |
Постпеченочная (блокада печеночного оттока)
Синдром Бадда — Киари, констриктивный перикардит; тромбоз или сдавление нижней полой вены
* СПД — свободное портальное давление.
•• ЗПВД — заклиненное подпеченочное венозное давление.
•спленопортография (введение контрастного вещества в селезенку при ее пункции) в настоящее время оставлена в связи
•с развитием у 1—2% больных кровотечения из селезенки и нередким при циррозе печени феноменом ложного тромбоза воротной вены — ускользания всего контраста через интенсивно развитые коллатерали до попадания его в воротную вену {Reynolds Т., Campra J., 1983].
Ретроградную печеночную венографию и каваграфию при подозрении на синдром Бадда — Киари проводят путем введения контраста через катетер, проведенный в нижнюю полую
вену к устьям печеночных вен или путем трансъюгулярной катетеризации печеночных вен.
При ультразвуковом исследовании портальная гипертензия диагностируется на основании увеличения диаметра воротной вены и недостаточного расширения ее разветвлений во время вдоха.
Нецирротические формы внутрипеченочной пресинусоидаль ной и предпеченочной портальной гипертензии у большинства больных характеризуются значительно меньшим нарушением функциональной способности печени, чем цирротические или обусловленные постпеченочной блокадой портального кровообращения. Нецирротическая предсинусоидальная внутрипеченоч ная портальная гипертензия наиболее часто бывает вызвана врожденным печеночным фиброзом, синдромом регенераторной узелковой гиперплазии печени и идиопатической портальной гипертензией.
Врожденный фиброз печени — наследственное заболевание, выявляемое обычно в возрасте 10—30 лет, часто (в 30%) сочетается с врожденными дефектами развития почек, клинически проявляется гепатомегалией со значительным уплотнением печени и симптомами портальной гипертензии: спленомегали ей с явлениями гиперспленизма и повторными кровотечениями из варикозно расширенных вен пищевода. Биохимические печеночные пробы нормальные, за исключением наблюдаемого иногда повышения активности ЩФ крови. При патоморфоло гическом исследовании видно, что интактные печеночные дольки окружены широкими прослойками фиброзной соединительной ткани, распространяющейся из портальных пространств, с про лиферирующими в ней желчными канальцами, иногда с признаками холангита [Grishan P., Jounoszai М., 1981].
Регенераторная узелковая гиперплазия печени — редкая диффузная или очаговая (перипортальная) микронодулярная трансформация печеночной паренхимы в узелки, состоящие из пролиферирующих гипертрофированных гепатоцитов, часто образующих балки толщиной в 2 клетки. В отличие от цирроза они не окружены фиброзной тканью, выявляются лишь при импрегнации серебром. Печень незначительно увеличена, нормальной консистенции или с мелкозернистой нерезко уплотненной поверхностью. Спленомегалия бывает у 50% больных, асцит—у 30%, варикозное расширение вен пищевода—у 57%, желудочно-кишечные кровотечения—у 27% больных, Заболеванию свойственны умеренные изменения активности аминотрансфераз, щелочной фосфатазы, снижение клиренса БСФ. У подавляющего большинства больных нецирротическая узелковая гиперплазия является вторичным поражением печени: наиболее часто она развивается при ревматоидном артрите, особенно часто при синдроме Фелти, при множественной миеломе и других моноклональных гаммапатиях, миелопроли феративных заболеваниях, лимфоме, макроглобулинемии Вальденстрема, хроническом лимфолейкозе, миелофиброзе, первичной тромбоцитемии, полицитемии, хроническом гломерулонеф рите, подостром бактериальном эндокардите и раке внутренних органов [Shedlofsky S. et al., 1980; Capron J. P. et al., 1983].
При идиопатической портальной гипертензии—редком заболевании, проявляющемся спленомегалией с явлениями гиперспленизма и повторными кровотечениями из варикозно расширенных вен пищевода, не находят каких-либо морфологических изменений печени или внепеченочной сосудистой сети, которые могли бы объяснить развитие гипертонии в системе воротной вены. Портальное и селезеночное давление резко повышено, синусоидальное давление нормальное, портокавальный градиент низок, т. е. имеет место пресинусоидальная блокада. Функциональные пробы печени нормальные или изменены незначительно, больные переносят кровотечения значительно легче и живут значительно дольше, чем больные циррозом печени. После кровотечения желтуха и печеночная энцефалопатия никогда не развиваются, как это обычно наблюдается при циррозе, но нередко развивается постгеморрагическая железодефи цитная анемия. Варикозное расширение вен пищевода исчезает и кровотечения прекращаются после операции наложения пор токавального анастомоза, которую больные с идиопатической и предпеченочной портальной гипертензией переносят значительно легче, чем больные циррозом печени. Однако после операции, как и при циррозе, возможно ухудшение функционального состояния печени и развитие эпизодов портокавальной эн цефалопатии [Capussotti L. et al., 1982].
Мы наблюдали 2 больных женщин 46 и 52 лет, у которых, несмотря на неоднократные пищеводные кровотечения в интервалах от нескольких месяцев до 3—4 лет, сохранялось удовлетворительное самочувствие и отсутствовали изменения биохимических проб печени. У обеих больных была умеренная спленомегалия, в пунктатах неувеличенной печени выявлялись умеренные изменения типа НРГ, при ангиографии портальной системы механического препятствия в портальной системе не обнаружено.
Описано развитие идиопатической порталыюй гинергензии на фоне системной склеродермии, аутоиммунной гемолитичес кой анемии, зоба Хашимото, хронического нефрита и длительного лечения иммунодепрессивньши препаратами после трансплантации почки [Levison D. et al., 1982; Umeyama К. et al., 1982; Bertrand L. et al., 1984].
Аналогичная клиническая картина наблюдается при нецир ротическом гепатопортальном склерозе (облитерирующая портальная венопатия печени, синдром Банта), выявляемом в Японии и Индии у 25—30% больных, которым проводится операция по поводу портальной гипертензии FSarin S., Babu S., 1983]. Полагают, что это заболевание обусловлено медленно прогрессирующей облитерацией крупных и средних внутрипе ченочных ветвей воротной вены с сегментарньм утолщением их интимы и частыми тромбозами. В пунктатах печени выявляется нормальная архитектоника с перипортальным фиброзом.
При внепеченочной обструкции ствола воротной или селезеночной вены симптомы портальной гипертензии также не сопровождаются выраженными явлениями печеночной дисфункции: отсутствуют малые печеночные знаки, биохимические пробы не изменены или изменены незначительно. Характерны сочетание спленомегалии с незначительно увеличенной или нормальных размеров печенью, отсутствие изменений или нерезкие изменения в пунктате печени. Асцит обычно отсутствует или появляется на короткий срок после кровотечения. Самочувствие больных между эпизодами кровотечений из вен пищевода в течение ряда лет остается удовлетворительным, однако с течением времени в связи с ухудшением кровоснабжения печени и развитием мощного коллатерального кровообращения» появляются признаки печеночной энцефалопатии. —
Наиболее часто изолированный внепеченочный тромбоз воротной вены развивается у детей и подростков в результате перенесенной интраабдоминальной инфекции или неонатально го пупочного сепсиса, но бывает и у взрослых больных любого возраста при заболеваниях брюшной полости [Webb L., Sher lock Sh., 1979].
При панкреатите с псевдоопухолевым увеличением хвоста поджелудочной железы в воспалительный процесс нередко вовлекается селезеночная вена: развивается ее сдавлениеи тромбоз со спленомегалией и варикозным расширением вен пищевода, иногда с асцитом [ и др., 1984; Harnar F. et a!.. 1982].
При гигантских спленомегалиях у больных мнелопролифе ративными заболеваниями (хроническая миелодная лейкемия. полицитемия, миелофиброз, геморрагическая тромбоцитемия) портальная гипертензия с пищеводными кровотечениями может быть обусловлена тромбозом воротной, селезеночной или печеночных вен в связи с повышением свертываемости крови или значительным увеличением портального кровотока [Золотннц кая Р. П. и др., 1983; , 1984; Grundfest Sh. et al„ 1980].
Реканализация не функционирующих у здоровых людей пупочной и околопупочных вен (синдром Крювелье — Баумгарте на) сопровождается выраженным расширением вен передней брюшной стенки между пупком и мечевидным отростком грудины («голова Медузы»), иногда с сосудистым шумом в этой-области. Данный синдром наиболее часто развивается у больных циррозом печени. Коллатерали обеспечивают сброс части портальной крови в систему нижней полой вены. Значительно реже наблюдается болезнь Крювелье — Баумгартена — врожденный дефект, при котором отмечается постнатальное сохранение воротно-пупочного кровообращения благодаря незараще нию пупочной вены. Постпеченочные формы портальной гипертензии с блокадой венозного оттока из печени отличаются наиболее тяжелым течением и часто трудно дифференцируются от декомпенсиро ванного цирроза печени. Эти формы представлены синдромом Бадда — Киари — тромбозом, компрессией или обтурацией печеночных вен либо нижней полой вены вблизи впадения в нее печеночных вен и веноокклюзионной болезнью печени — обтурацией внутрипеченочных ветвей печеночных вен, которую многие авторы считают разновидностью синдрома Бадда — Киари.
Причинами синдрома Бадда — Киари могут быть тромбозы печеночных вен у больных с повышением свертывающей системы крови при полицитемии, пароксизмальной ночной гемогло бинурнн, мигрирующем флебите, послеродовом статусе [Trey Ch. et al., 1982; Baert A. et al., 1983]; врожденные аномалии развития вен с наличием мембран и перепонок клапанного типа, частично перекрывающих просвет печеночных или нижней полой вен; распространение воспалительного процесса при констриктивном перикардите, инфекционных процессах и вас кулитах на нижнюю полую вену и устья печеночных вен; сдавление печеночных или нижней полой вены забрюшинной опухолью, опухолями или кистами печени, надпочечника, почки, поджелудочной железы или лейомиомой правого предсердия.
Основными симптомами синдрома Бадда — Киари являются быстро (на протяжении нескольких месяцев) нарастающий асцит, резистентный к диуретической терапии, в сочетании с болями в верхней половине живота и пояснице, нередко с диареей н рвотой, увеличением, уплотнением и болезненностью печени, преимущественно левой ее доли, и увеличением селезенки. функциональные пробы печени на начальных стадиях изменены умеренно, однако с течением времени развиваются желтуха гепатоцеллюлярного типа и другие клинические и биохимические признаки тяжелой печеночной недостаточности, появляются расширенные подкожные венозные коллатерали в области передней брюшной стенки, поясницы и спины и кровотечения из варикозно расширенных вен пищевода. У некоторых вольных синдром Бадда — Киари протекает остро, сопровождается резкими болями в верхней половине живота и через 1—4 мес после начала заболевания заканчивается летальных исходом.
На сканограмме часто отмечаются характерное перемещение радионуклида в центральные отделы печени за счет преимущественного накопления в гипертрофированной хвостатой доле, множественные зоны сниженного накопления в периферических отделах печени и повышенная фиксация радионуклида в селезенке; на сонограмме вместо нормальных печеночных вен выявляется извитая сеть венозных коллатералей. При лапароскопии видны увеличенная печень преимущественно за счет хвостатой и левой доли с гладкой или слегка неровной темно-красной «мускатной» поверхностью и развитое коллатеральное кровообращение; в пунктатах печени — расширение синусоидов, венозный застой, очаговые некрозы в центральных отделах печеночных долек, атрофия гепатоцитов в правой и левой долях печени и гипертрофия—в каудальной доле. Диагноз уточняется с помощью нижней кавографии. В случае ранней диагностики синдрома Бадда — Киари больной подлежит оперативному лечению. Применяют наложение портока вального анастомоза, чреспредсердное расширение стенозиро ванного участка нижней полой вены или чреспредсердную мембранотомию. Перспективны методы баллонного расширения стенозированных сегментов печеночных вен при их катетеризации [, 1984; Demol P. et al., 1976].
Постепенная облитерация или тромбоз внутрипеченочных разветвлений печеночных вен при веноокклюзионной болезни печени протекает значительно дольше, чем синдром Бадда — Киари. Дифференциально-диагностическим критерием является наличие спленомегалии, асцита, коллатерального венозного кровообращения и признаков выраженного венозного застоя в печени при отсутствии застойной сердечной недостаточности и внепеченочной обструкции портальных сосудов и печеночных вен при ангиографии. В биоптатах печени выявляют венозный застой в центре долек с некрозами гепатоцитов, прогрессирующую облитерацию сублобулярных и центральных вен со значительным утолщением субэндотелиального слоя, нарастающий центролобулярный фиброз с развитием мелкоузлового цирроза печени. Впервые веноокклюзионная болезнь была описана у жителей Южной Америки и Ямайки, которые употребляли в пищу в виде чая растения, содержащие пирролизидиновые алкалоиды или недостаточно очищенные злаки, на которых паразитируют эти растения. В нашей стране были описаны аналогичные случаи при попадании в пищу гелиотропа. Веноок клюзионную болезнь печени могут вызвать также длительный прием иммунодепрессивных средств, в том числе азатиоприна, антинеопластических агентов, уретана, аллопуринола и облучение печени [Kaneata S. et al., 1981]. Она может развиваться также в ходе реакции отторжения «трансплантат—против хозяина» у больных, перенесших пересадку костного мозга.
Спленомегалия и синдром гиперспленизма
Спленомегалия наблюдается у 77—85% больных циррозом печени [, 1966; Cozzolino G. et al., 1983], т. е. относится к числу наиболее частых, но неспецифичных для цирроза симптомов.
К механизмам спленомегалии, помимо застойной венозной гипертрофии, наблюдаемой при циррозе печени и внепеченоч ных формах портальной гипертензии, относятся «рабочие» гипертрофии вследствие иммунной реакции (например, при под остром бактериальном эндокардите, синдроме Фелти или инфекционном мононуклеозе) или при повышенной деструкцию эритроцитов (например, при врожденном сфероцитозе или. большой талассемии) и инфильтративные спленомегалии при миелопролиферативных, неопластических заболеваниях (хронический миелоидный лейкоз, хронический лимфолейкоз, острый лейкоз, полицитемия, лимфомы, лимфогранулематоз,. остеомиелосклероз, метастатический рак), при процессах другой этиологии (саркоидоз, амилоидоз, болезнь Гоше) [Eich ner E., Whitefield Ch., 1981]. Другими причинами спленомегалии могут быть травмы селезенки с разрывом и субкапсуляр ной гематомой, кисты, абсцессы, тромбоэмболии, гемангиомы селезенки, цитомегалия, диссеминированный гистоплазмоз или токсоплазмоз. Спленомегалия в сочетании с длительной лихорадкой наблюдается при сепсисе, висцеральном лейшманиозе (кала-азар), гемобластозах и милиарном туберкулезе.
Среди хронических заболеваний цирроз печени является. наиболее частой причиной спленомегалии и сопутствующего-ей синдрома гиперспленизма, т. е. значительной интенсификации и извращения нормальной функции селезенки по элиминации стареющих форменных элементов крови и регуляции кроветворной функции костного мозга. Для развернутой картины гиперспленизма, помимо спленомегалии, характерны анемия,. чаще нормоцитарная или макроцитарная (после повторных кровотечений — гипохромная микроцитарная с умеренным ре тикулоцитозом), лейкопения с нейтропенией и лимфомоноцито пенией, тромбоцитопения и компенсаторная гиперплазия костного мозга с преобладанием клеток — незрелых предшественников эритроцитов и тромбоцитов (задержка созревания). В костном мозге выявляется также свойственная циррозу плаз моклеточная реакция. Наиболее часто гиперспленизм проявляется преимущественным снижением числа одного или двух типов клеток периферической крови, например, тромбоцитопени ей. Снижение числа тромбоцитов до 50 • Ю^/л — 30 • W/л и менее часто сопровождается геморрагическим синдромом: резко выраженной кровоточивостью десен, носовыми, маточными № почечными кровотечениями, постинъекционными, посттравматическими и спонтанными кровоизлияниями в кожу и слизистые оболочки. Кровоизлияния в глазное дно часто предшествуют внутричерепным. Возможны лейкопения со снижением числа лейкоцитов крови до 1 • Ю^л—2- Ю^л и опасностью развития гнойно-септических осложнений. Резко выраженная анемия, обусловленная только гиперспленизмом, наблюдается редко. Эти изменения не коррелируют со степенью воспалительно-некротической активности цирроза печени, но указывают на его декомпенсацию по сосудистому типу. Согласно данным и соавт. (1975, 1976), интенсивность периферической цитопении (гиперспленизма) при циррозе печени пропорциональна величине внутриселезеночного давления, т. е. степени портальной гипертензии. Быстрое нарастание цигонении указывает на повышенный риск пищеводного кровоте
чения.
Критическое снижение числа форменных элементов крови в сочетании с повышенной кровоточивостью или опасностью инфекционных осложнений является показанием к гемостатичес кой, противоинфекционной и заместительной терапии: переливаниям тромбоцитной массы или лейкомассы или к кратковременному (на 3—6 мес) назначению средних доз (20—40 мг/сут) преднизолона. Эффект глюкокортикостероидов, по-видимому, обусловлен не только стимуляцией кроветворной функции костного мозга, но также подавлением ими синтеза селезеноч :ных аутоантител к форменным элементам крови. Аутоиммун ный фактор наряду с застоем венозной портальной крови в селезенке играет несомненную роль в патогенезе гиперспленизма: в противном случае было бы трудно объяснить развитие у некоторых больных выраженной цитопении при наличии лишь умеренно увеличенной селезенки.
Спленэктомия у большинства больных приводит к нормализации цитопении или иногда к развитию гипоспленизма с наличием в крови телец Жолли, мишеневидных эритроцитов, си дероцитов и акантоцитов. Гипоспленический тромбоцитоз и лейкоцитоз ведет к тромбозам, снижению противоинфекционного иммунитета с опасностью развития молниеносного сепсиса или. долевой пневмонии, особенно у лиц с иммунным дефицитом ;[Albrechtsen D., 1981]. Число тромбоцитов приходит к норме через 2—3 нед после спленэктомии. При циррозе печени сплен эктомия является серьезным вмешательством, смертность при котором достигает 5%. Поэтому вряд ли целесообразно рекомендовать эту операцию в качестве приятного метода лечения гиперспленизма. Более щадящий и менее опасной манипуля ;цией является эмболизация селезеночной артерии желатиновой губкой [ и др., 1981].
Клиническим примером трудностей дифференциальной ди. агностики гиперспленизма является следующее наблюдение.
58 лет, в течение ряда лет беспокоили длительная приступообразная боль в правом и левом подреберье с иррадиацией в подложечную область, вздутие живота. Около 40 лет назад перенесла бруцеллез, в последующем — субтотальную резекцию щитовидной железы по поводу тиреотокси коза. В течение последних 2 лет отмечается лейкопения до 2,8—2,0- W/л. Консультант-гематолог заболевания крови не обнаружил. За год до поступления в нашу клинику было выявлено увеличение печени и селезенки, диагностирован «цирроз печени». При обследовании у больной выявлены нормальные размеры печени и гигантская спленомегалия: плотная безболезненная селезенка занимала весь верхний левый квадрант живота. Эти данные были подтверждены при лапароскопии: печень не увеличена, поверхность ее гладкая, цвет бледно-красный, желчный пузырь без особенностей. Селезенка значительно увеличена и занимает всю верхнюю левую половину брюшной полости, прилегая к левой доли печени; явления периспленита и перигепатита. При проведенной ранее компьютерной томографии данные об объемном процессе отсутствовали. При эндоскопическом исследовании выявлен хронический гастрит. В лабораторных анализах—умеренная гипохромная анемия, лейкопения
•^•W/n) при нормальной лейкоцитарной формуле, небольшая тромбоцитопения (136—Пб-ЮУл); СОЭ 28—36 мм/ч. Биохимические пробы не изменены, за исключением умеренной гиперфосфатаземии и увеличения концентрации IgM крови. Серологические реакции на бруцеллез отрицательные, реакция на HBsAg, реакция Манту отрицательные. На сканограмме печени значительная спленомегалия (22х13 см), повышенное включение радионуклида в селезенку. При трепанобиопсии подвздошной кости обнаружено очаговое размножение-лимфобластов и уменьшение количества клеток нормального гемопоэза — изменения, свойственные лимфоме. Диагноз лимфомы селезенки был подтвержден при дальнейшем обследовании больной в условиях специализированной гематологической клиники.
В данном случае гигантская спленомегалия сопровождалась. явлениями гиперспленизма, но не повлекла развития клинически выраженных признаков портальной гипертензии, что дало возможность исключить внепеченочную ее форму, в частности. тромбоз селезеночной вены.
Отечно-асцитический синдром
Патогенез
На поздних стадиях цирроза печени асцит развивается у 50—85% больных; у 25% больных он является первым симптомом болезни. Развитие у больного отечно-асцитического синдрома означает переход заболевания в чрезвычайно сложную по патогенетическим механизмам и весьма ответственную для врача фазу. Дальнейшее течение цирроза печени и прогноз а значительной степени зависят от тщательного соблюдения основных правил терапии отечно-асцитического синдрома, основанных на знании его патогенеза. Наибольшей ошибкой является взгляд на больного циррозом печени с асцитом как на безнадежно больного. Несмотря на среднестатистические данные о том, что средняя продолжительность жизни больных с момента появления асцита составляет около 3 лет, индивидуальные колебания чрезвычайно велики и многие больные живут-значительно дольше.
Патогенез асцита при циррозе печени связан с взаимодействием нескольких факторов: мехалического, обусловленного портальной гипертензией, гормонального и нервно-гуморального звеньев, обусловленных гемодинамическими сдвигами и нарушениями водно-электролитного равновесия (схема).
Повышение синусоидального гидростатического давления при внутрипеченочной портальной гипертензии приводит к повышенной транссудации богатого белком фильтрата через по розные стенки синусоидов в пространства Диссе, резкому увеличению образования печеночной лимфы и объема интерсти циальной жидкости с сопутствующим снижением ее онкотичес кого давления вследствие дефицита синтеза альбумина. Значительная часть лимфы, образующейся при избытке интерстици альной жидкости, поступает в большой круг кровообращения через систему лимфатических сосудов печени и грудной лим
Механизмы развития аСцита при циррозе печени (схема по К. Skopecki, В. Brenner, 1982; модифицировано)
|
.Механический, и гипоонко-тический факторы |
Гемодинамический и гормональный факторы | |
|
теория «недостаточного наполнения» центрального венозного и артериального сосудистого русла |
теория «избыточного притока» | |
|
Цирроз печени |
Цирроз печени |
Цирроз печени |
|
Портальная гипертензия |
Портальная гипер |
Дефицит натрийурети |
|
^ |
тензия |
теского гормона |
|
Повышение синусоидаль |
• t |
1 |
|
ного гидростатического |
Депонирование зна |
Повышение канальцевои |
|
давления |
чительной части кро |
реабсорбцнн натрия. |
|
\ |
ви в спланхнической |
снижение почечного кро- |
|
Транссудация богатого |
системе- |
вотока и гломеруляр- |
|
белком фильтрата в про |
\ |
ной фильтрации |
|
странстве Диссе |
Снижение эффектив |
\ |
|
^ |
ного объема плазмы |
Увеличение эффективно |
|
Повышенное образование |
^ |
го объема крови |
|
печеночной лимфы со |
Активация ренин-ан- |
1 |
|
сниженным вследствие |
гиотензин-альдосте- |
Изменение сил Стар- |
|
•гипоальбуминемии онко- |
роновой системы |
линга в спланхнической |
|
тическим давлением |
^ 1 |
циркуляции в связи с |
|
1 |
Почечная Стимуляция |
наличием портальной |
|
Превышение скорости |
вазокон - секреции АДГ |
гипертензии и гипоаль |
|
образования интерсти- |
стрикция задней долей |
буминемии |
|
циальной жидкости и ее |
1 гипофиза |
1 |
|
дренирования через лим |
Т 1 |
Асцит |
|
фатический проток в си |
Задержка натрия и | |
|
стему кровообращения |
воды | |
|
^ |
1 | |
|
Асцит |
Асцит |
фатический проток, однако если скорость накопления интерсти циальной жидкости превышает способность ее удаления через лимфатическую систему, часть жидкости просачивается в полость брюшины, и формируется асцит. Отток лимфы от печени при циррозе печени достигает 15—20 л в сутки и более при норме 8—9 л [Witte M. et al., 1971].
Одновременно с накоплением асцитической жидкости развивается снижение центрального внутрисосудистого объема:
несмотря на то что объем плазмы крови при циррозе печени повышен, значительная ее часть депонирована в сосудах брюшной полости, поэтому эффективный, т. е. участвующий в циркуляции, объем плазмы снижен. Снижение эффективного объема плазмы вызывает активацию ренин-ангиотензин-альдо стероновой системы, которая в физиологических условиях обеспечивает восстановление сниженного эффективного объема плазмы и крови и нормализацию водно-электролитного и кислотно-щелочного равновесия и артериального давления.
Неврогенные факторы
Цирроз печени
Обструкция печеночного венозного оттока
\ Портальная гипертензия
Депонирование крови в спланхнической системе
Снижение эффективного-объема плазмы и гипо-волемия внутригрудного сосудистого ложа (центральная гиповоле--иия)
«•Стимуляция ренин-ан-гиотензин-альдостеро-новой системы
>-Сигнал от объемных симпатических внутри-сосудистых рецепторов и„
_от объемных рецепторов. печени
Увеличение образования печеночной
лимфы
Снижение внутрисосудистого объема
|
-Задержка почками Асцит |
|
натрия |
Расширение объема вне-клеточной жидкости
Возможно также, что ренин-альдостероновая система активируется непосредственно под влиянием нарушений внутрипече ночной гемодинамики [, M., 1968;
Reinolds Т., 1981]. Повышенная секреция ренина в юкстагло мерулярном аппарате почек приводит к нарастанию синтеза ангиотензина I из синтезируемого печенью ангиотензиногена (а2-глобулин); ангиотензин I превращается в ангиотензин II, обладающий выраженным сосудосуживающим эффектом и снижающий гломерулярную фильтрацию и почечный кровоток. Ангиотензин II также стимулирует секрецию антидиуретического гормона гипофиза (АДГ, вазопрессин) и наиболее активного мннералокортикоидного гормона — альдостерона, вырабатываемого в клубочковой зоне коры надпочечников и метаболизи руемого печенью. Альдостерон вызывает повышение реабсорб ции натрия и воды в обмен на экскрецию ионов калия и водорода в дистальных отделах нефрона — восходящей части петли Генле и дистальных канальцах только при наличии в просвете этих частей нефрона ионов натрия, поступающих сюда из проксимальных сегментов.
Чрезмерная потеря калия и водорода в условиях повышенной продукции альдостерона приводит к гипокалиемии (калий сыворотки крови менее 3,5 ммоль/л), гипомагнезиемии (менее
1,4 ммоль/л) и метаболическому алкалозу. Экскреция натрия с мочой значительно снижается (менее 150 ммоль/сут). При этом, несмотря на повышенную задержку натрия, у большинства больных развивается гипонатриемия (натрий сыворотки менее 135 ммоль/л) в связи с переходом большей части натрия в интерстициальную и асцитическую жидкость [ и др., 1983]. Задержка почками натрия и воды ведет к дальнейшему накоплению асцитической жидкости. Таким образом, данная теория «недостаточного наполнения» (центрального венозного и артериального) сосудистого русла (underfilling theory) постулирует первичность гемодинамических и гормональных сдвигов и вторичность реакции почек в виде задержки натрия.
За последние годы было установлено, однако, что у 2\з больных циррозом печени, не получавших лечения гипонатрие вой диетой и мочегонными средствами (факторы, активирующие выработку альдостерона), стимуляция ренин-ангиотензин альдостероновой системы отсутствует. Возможно, у таких больных имеется повышенная чувствительность почечных каналь цев к альдостерону. Активность ренина плазмы была почти всегда повышенной в группе больных циррозом печени с асцитом и сопутствующей функциональной почечной недостаточностью (при гепаторенальном синдроме), особенно при резком снижении натрийурии (менее 2 ммоль/сут). Предполагают, что причина этого — снижение почечного кровотока. Допамин, увеличивающий почечный кровоток, снижал активность ренина [Wilkinson S., Williams R., 1980]. Эти данные привели к разработке альтернативной теории формирования цирротического асцита — теории «избыточного притока» (overflow theory), согласно которой задержка натрия, по крайней мере у Уз больных циррозом, является первичным феноменом, независимым от активации ренин-ангиотензин-альдостероновой системы и развивающимся на фоне уже увеличенного до появления асцита объема плазмы и крови. Возможно, причиной является дефицит еще не идентифицированного натрийурического гормона, вырабатываемого печенью и выявляемого в асцитической жидкости [Robin M., Nizet A., 1983]. Задержка натрия сопровождается нарастанием объема внеклеточной жидкости, тормозящего активность ренин-ангиотензин-альдостероновой системы. При достаточном влиянии некоторых локальных факторов (портальная гипертензия, снижение онкотического давления плазмы, нарушение дренажа лимфы в печени) происходит истечение избытка внеклеточной жидкости в полость брюшины и в периферические межкапиллярные интерстициальные пространства с формированием асцита и отеков [Epstein М. 1979].
Однако теории «избыточного притока» противоречит ряд факторов, указывающих на недостаточное наполнение кровью центрального сосудистого русла у больных циррозом печени, несмотря на увеличение объема плазмы. Это низкое артериальное давление, выраженный натрийурический эффект длительного погружения больного с асцитом до уровня шеи в воду, что ведет к перераспределению плазмы с увеличением притока ее к почкам; натрийурический и диуретический эффект пери тонеально-венозного шунта по Le Veen, приводящего к увеличению объема плазмы вследствие поступления асцитической жидкости в сосудистое русло.
Эти данные послужили основанием для возрождения теории «недостаточного наполнения» на новой основе, согласно которой в начальной стадии имеет место задержка натрия почками и увеличение объема плазмы. Избыток жидкости в связи с портальной гипертензией и увеличением коллоидно-осмотического давления плазмы секвестрируется в полость брюшины и приводит к снижению эффективного объема плазмы с соответствующей вторичной реакцией почечных канальцев в виде повышения реабсорбции натрия и воды. Предполагается также, что гиповолемия центрального сосудистого русла вызывает афферентную стимуляцию со стороны внутригрудных объемных сосудистых рецепторов. Эта активация симпатической нервной системы на уровне почек приводит к почечной вазоконстрикции, снижению почечного кровотока и гломеруляр ной фильтрации, повышению проксимальной канальцевой реабсорбции натрия и к последующей активации ренин-ангио тензин-альдостероновой системы с повышенной дистальной ре абсорбцией натрия [Henriksen J., 1983]. Аналогичные сдвиги вызывает инфузия ангиотензина II или норадреналина. Сточки зрения этой теории значительное нарастание натрийуреза, калийуреза и экскреции воды с одновременным резким увеличением натрийурического эффекта антагониста альдостерона спиронолактона у больных, погруженных по шею в воду, обусловлено перераспределением жидкости из интерстициального в циркуляторный внутригрудной отсек и устранением центральной гиповолемии [Skopecki К., Brenn В., 1982].
Выраженный натрийурический и диуретический эффект антагонистов альдостерона у большинства больных циррозом печени с асцитом, особенно на начальной его стадии и при отсутствии функциональной почечной недостаточности, показывает, что нельзя сбрасывать со счета гормональное звено в патогенезе асцита. Вторичный, т. е. не связанный с поражением надпочечников, гиперальдостеронизм при циррозе печени является таким же клиническим фактом, как и у больных застойной сердечной или почечной недостаточностью, пиелонефритом с потерей натрия или калия или при других нарушениях водно-электролитного баланса. Одной из причин гиперальдостеро-низма при циррозе печени, как и у больных с сердечной и почечной недостаточностью, по-видимому, может быть снижение кровотока в печени и уменьшение метаболического клиренса альдостерона и экскреции его с мочой.
Диагноз и дифференциальный диагноз асцита
Диагноз асцита обычно не представляет больших трудностей; важно, однако, иметь в виду, что увеличение объема живота — обязательный, но наименее надежный симптом асцита. Оно наблюдается при метеоризме, у больных с общим ожирением или ожирением сальника, при атонии передней брюшной стенки, опухолях брюшной полости, больших кистах яичника, беременности и гидрамнионе. В начальных стадиях накопления асцитической жидкости важными симптомами являются отрицательный диурез, нарастание массы тела, появление перемещающегося при перемене положения тела притупления перку торного звука на фланках и в нижней половине живота. На обзорном снимке живота контуры органов брюшной полости нечеткие, определяется высокое стояние куполов диафрагмы. Большой асцит вызывает расхождение прямых мышц живота подъем диафрагмы с поворотом сердца и смещением верхушечного толчка влево, увеличение давления в правом желудочке сердца с набуханием шейных вен.
У больных циррозом печени развитие асцита часто сопровождается образованием пупочной грыжи. Радикальное гры жесечение нецелесообразно в связи с опасностью инфицирова ния асцита и рецидива грыжи. При большом асците возникает опасность разрыва истонченной, часто мацерированной и изъязвленной кожи, отграничивающей асцитическую жидкость над грыжевым мешком. В таких случаях приходится прибегать к герниорафии — сшиванию краев грыжевого дефекта и наложению перитонеально-венозного шунта [Belghiti J. et al., 1983;
Fruchter G. et al., 1983]. Гидроторакс, чаще правосторонний, при циррозе печени с асцитом наблюдается почти у 20% больных [Guinot F. et al., 1982]. Причиной этого является просачивание асцитической жидкости в полость плевры через щели в сухожильной части диафрагмы. Поэтому пункции плевральной полости при отсутствии дыхательной недостаточности нецелесообразны; при ликвидации асцита обычно исчезает и гидроторакс.
Дифференциальный диагноз заболеваний, ведущих к асциту, нередко представляет большие трудности. В типичных случаях на цирротическую его этиологию указывают кожные печеночные знаки и другие симптомы печеночной недостаточности в сочетании с признаками портальной гипертензии, нарушения биохимических печеночных проб. При отсутствии полной уверенности в наличии у больного цирроза печени важно исключить другие заболевания, при которых возможно развитие асцита: механическую обструкцию печеночных вен (синдром Бадда — Киари) или нижней полой вены, застойную сердечную недостаточность, слипчивый перикардит, туберкулезный перитонит, хронический перитонит другой этиологии, микседе му, нефротический синдром с хронической почечной недостаточностью, кисты и опухоли яичника, опухолевое поражение других органов с метастазами в брюшину (раковый, часто геморрагический или хилезный асцит) и мезотелиому брюшины.
Для уточнения этиологии асцита большую пользу может принести диагностическая пункция брюшной полости тонкой иглой с извлечением 10—20 мл асцитической жидкости. Неин фицированная асцитическая жидкость при циррозе печени обычно является стерильным транссудатом с относительной плотностью менее 1015, низким содержанием белка (менее 25—30 г/л) и небольшим количеством лимфоцитов и мезоте лиальных клеток. Число лейкоцитов составляет около 280 в 1 мкл, в том числе около 27% — палочкоядерные нейтрофилы. Однако у 15—20% больных возможен асцит с более высоким содержанием белка вследствие высокого уровня белка в сыворотке крови. Геморрагический асцит (число эритроцитов асцитической жидкости более 1,3 • 10/мкл) более свойствен асциту при циррозе-раке печени, при других злокачественных опухолях и при травматическом асците. Он возможен у 2—3% больных циррозом печени. Причинами геморрагического асцита при циррозе могут быть внезапное кровотечение в брюшную полость при разрыве крупной венозной коллатерали или селезенки, требующее срочного хирургического вмешательства, или (чаще) просачивание крови из мелкого кровеносного сосуда. Геморрагический асцит при циррозе является неблагоприятным прогностическим симптомом: у этих больных чаще развиваются энцефалопатия и гепаторенальный синдром [Sitter De L„ Rector W., 1984].
Для туберкулезного асцита-перитонита, который в редких случаях может быть геморрагическим, характерно высокое содержание белка (30—70 г/л) и обилие лимфоидных элементов в асцитической жидкости, при лапароскопии — интенсивные фибринозные наложения в сочетании со специфическими грануляциями на поверхности брюшины, обнаруживающими при микроскопии более чем в 55% случаев структуру казеозных гранулем [ и др., 1984; Buffet С. et al., 1983]. При раковом асците концентрация белка асцитической жидкости превышает 30 г/л, а число лейкоцитов (около 400 в 1 мкл) значительно больше, чем при асците, обусловленном заболеванием печени (около 200 в 1 мкл). При раковом асците повышена активность ЛДГ асцитической жидкости, при панкреатическом асците — активность амилазы. Жидкость типа экссудата, помимо ракового и туберкулезного асцита, наблюдается при панкреатическом и микседематозном асците.

|
Из за большого объема эта статья размещена на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 11 |



