дефекты в работе | Причини и пути их устранения |
При анализе выявлены мелкие капельки эфирного масла в ароматной воде | |
В производстве сахарного сиропа наблюдается засахаривания | |
В производстве сахарного сиропа обнаружен посторонний запах | |
В производстве сахарного сиропа при анализе установлена плотность 1,225 |
Тема: Производство водных растворов в промышленных условиях. Испытания.
Актуальность темы: Знание технологии растворов важно при изготовлении многих других лекарственных форм, растворы являются полупродуктами или вспомогательными компонентами. Изучение химических превращений, которые лежат в основе производства водных растворов определяют актуальность темы.
Цель занятия: Научиться пользоваться нормативно - технической документацией, справочной литературой для поиска необходимой информации по изготовлению официнальных растворов, составлять рабочие прописи на изготовление необходимого количества готового продукта. Овладеть методикой определения их концентрации.
Контрольные вопросы. 1. Водные растворы. Определение. Характеристика. Номенклатура.
2. Растворение, как диффузионно-кинетический процесс.
3. Пути интенсификации процесса растворения.
4. Процесс перемешивания.
5. Типы мешалок.
6. Механическое перемешивание.
7. Пневматическое перемешивание.
8. Гравитационное перемешивание.
9. Перемешивание в трубопроводе.
10. Акустическое перемешивания.
11. Циркуляционное перемешивание.
12. Разделение жидких гетерогенных систем.
13. Отстаивание.
14. Фильтрация.
15. Центрифугирование.
Информационный материал Создание лекарств, которые обеспечивают оптимальный терапевтический эффект с минимумом побочных эффектов, удобных для применения является актуальной задачей современного фармацевтического производства. Этим требованиям отвечают жидкие лекарственные формы. Растворы широко используются в медицинской практике и занимают значительное место среди лекарственных средств.
Растворы - это жидкие гомогенные системы, состоящие из растворителя и одного или нескольких компонентов, распределенных в нем в виде ионов или молекул.
Медицинские растворы различных по свойствам, составу, способам получения и назначению.
Любая жидкость имеет ограниченную растворяющую способность. Это означает, что определенное количество растворителя может растворить лекарственное вещество в количествах, которые не превосходят обозначенной границы. Растворимостью вещества называется его способность образовывать с другими веществами растворы. Данные о растворимости лекарственных веществ приводятся в фармакопейных статьях. Для удобства в Государственной фармакопеи Украины указывается приблизительное количество растворителя (мл), необходимое для растворения 1 г вещества в интервале температур от 15 до 25 º С.
По степени растворимости различают вещества: • очень легкорастворимые;
• легкорастворимые;
• растворимые;
• труднорастворимые;
• малорастворимые;
• очень малорастворимые;
• практически нерастворимые;
В зависимости от растворителя растворы подразделяют:
• водные;
-Растворы;
-Жидкости;
• спиртовые;
• глицериновые;
• масляные;
Согласно ГФУ различают:
жидкие лекарственные средства для наружного применения;
жидкие лекарственные средства для орального применения;
Учебные задачи и примеры решения
Задача: Необходимо приготовить раствор азотной кислоты, определить количество воды и раствора азотной кислоты, плотность которого 1,250 г / мл при температуре 17 0С, чтобы приготовить 12 кг 10% раствора.
Решение: Концентрацию растворов кислот определяется плотностью с помощью таблиц ДФ. Откуда видна зависимость между плотностью водного раствора при 20 º С и их концентрацией. Для определения плотности при любой - какой температуре (в указанных интервалах) по найденному значении ρ20 применяют:
ρ20 = ρt + α (t - 20 º) откуда, ρt = ρ20 - α (t - 20 º)
1). Определяем плотность раствора при 20 º С.
ρ20 = 1,250 - 0,00096 (17 º - 20 º) = 1,2471 г / мл
2) определяем концентрацию при 20 º С.
Используем метод интерполяции.
1,2471 - 1,2463 = 0,0008
1,2527 - 41%
1,2463 - 40%
_________________
0,0064 - 1%
0,0008 - х% х = 0,125% 40% + 0,125% = 40,125%
3) определяем количество азотной кислоты.
40,125 10
10%
0 30,125
________________________
40,125
40,125 - 10
12 - х х = 2,99 кг (азотной кислоты 40,125%)
4) определяем количество воды
12кг - 2,99 кг = 9,01 кг (воды очищенной)
Учебные задания к выполнению практической работы
Задача № 1 Приготовить раствор кальция гидроксида.
Раствор кальция гидроксида. Известковая вода.
Состав: кальция оксида (извести гашеной) 1 г
воды очищенной 70 г
Технологические стадии производства:
- Получение кашицеобразной массы;
- Удаление растворимых примесей;
- Получение раствора;
- Фильтрация раствора.
Технология приготовления В химический стакан на 50-100 мл помещают 1,0 г кальция оксида и добавляют (осторожно) 5 мл свежепрокипяченной (освобожденной от СО2) охлажденной до комнатной температуры воды очищенной, тщательно перемешиваем. Кашицеобразную массу заливають15, 0 мл холодной свежепрокипяченного водой из стакана в колбу на 100 мл с притертой пробкой, плотно закрывают, взбалтывают и оставляют на 4-5 часа. Затем жидкость сливают с осадка. К осадку добавляют 50 мл холодной свежепрокипяченной очищенной воды, взбалтывают, плотно закрывают колбу и оставляют в прохладном месте для отстаивания.
Задача № 2 Приготовить жидкость Бурова (раствор ацетата алюминия основного)
Состав: квасцы 46,5 г, кальция карбоната 14,5 г, кислоты уксусной разбавленной (30%) 39 г, воды очищенной достаточное количество.
Существует два способа получения жидкости Бурова: путем взаимодействия квасцов с мелом и уксусной кислотой и электролизом.
Характеристика готового продукта. Бесцветная прозрачная жидкость кислой реакции, со слабым запахом уксусной кислоты и сладковато-вяжущим вкусом. Плотность 1,036-1,048.
Технология приготовления В колбу или банку помещают горячую воду и в ней растворяют алюмокалиевые квасцы при перемешивании. Отдельно в фарфоровой чашке кальция карбонат растирают с водой и кашицеобразную смесь порциями при постоянном перемешивании добавляют в охлажденный раствор квасцов. Смесь отстаивают до прекращения выделения углекислого газа, затем осадок промывают водой способом декантации до полного удаления ионов калия и сульфата (проба с кобальтинитритом натрия и раствором бария хлорида). Промытый осадок отсасывают в воронке Бюхнера с помощью вакуумного насоса. Почти сухой осадок переносят в тарированные фарфоровую чашку и к нему добавляют разведенную уксусную кислоту, тщательно перемешивают и переносят в хорошо закрытую банку и оставляют в прохладном месте на 2-3 суток. По истечении указанного срока жидкость осторожно сливают с осадка, фильтруют, определяют плотность и при необходимости доводят ее до 1,044-1,048. Реакция образования жидкости Бурова протекает по следующей схеме:
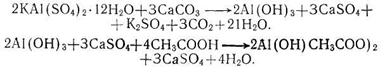
Приготовление жидкости Бурова методом электролиза
Жидкость Бурова можно быть получена путем растворения металлического алюминия в 8% растворе уксусной кислоты. Однако металлический алюминий быстро окисляется на воздухе и теряет способность растворяться в слабых растворах уксусной кислоты. Поэтому в 1951 г. предложила метод электролиза, т. е. анодного растворения алюминия в 8% растворе уксусной кислоты.
Уксусная кислота в водном растворе частично подвергается диссоциации:
СН3СООН Н + + СН3СОО-.
В то же время распадается вода: Н2О= Н + + ОН-.
В нормальных условиях в навколоанодному пространстве происходят следующие процессы.
1. На аноде осуществляется переход металлического алюминия в ионное состояние (растворение):
А1о![]() Аl+++
Аl+++
2. На катоде образуется водород 2Н+![]() Н2:
Н2:
В результате этого в процессе электролиза в растворе накапливаются ионы алюминия и гидрооксида. Процесс электролиза заканчивается, когда количество ионов А1 + + + и ОН-будет достаточным для образования соли Аl (ОН) (СН3СОО) 2.
2Аl+4СН3СООН+2Н2О![]() 2Аl (OH) (СН3СОО)2+ЗН2.
2Аl (OH) (СН3СОО)2+ЗН2.
Лабораторная установка для электролиза представляет собой ванну стеклянную емкостью 1000 мл, охлаждаемую холодной проточной водой
Перед работой аноды и катоды обрабатывают 10% раствором кислоты хлористоводородной и ополаскивают очищенной водой. В ванну наливают 500 мл 8% раствора кислоты уксусной и опускают промытые электроды, которые подключают в цепь через выпрямитель и реостат. Процесс контролируется с помощью амперметра, вольтметра и термометра. В течение всего опыта поддерживают силу тока из расчета от 0,1 до 0,5 А.
Температура раствора должна быть 20 ° С. Процесс электролиза продолжают до тех пор, пока плотность раствора не достигнет 1,040-1,046 и значение рН 4,0-4,85. После этого прибор выключают, раствор сливают в емкость, дают ему отстояться в течение суток, а затем фильтруют через активированный уголь.
Задача № 3 Составить технологическую схему приготовления раствор ацетата алюминия основного.
Задача № 4 Пользуясь литературными источниками охарактеризовать фильтры в зависимости от механизма задержки частиц
фильтры | характеристика |
Пластинчастые | |
Поверхностные | |
Мембранные | |
Глубинные |
Задача № 5 Указать показатели качества водного раствора согласно ГФУ.
Задание № 6 Указать факторы, от которых зависит скорость фильтрации (из уравнения Пуазейля).
Задание № 7 Пользуясь литературными источниками привести примеры растворов, выпускаемые промышленностью:

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 |





