б) Реакция с йодистым калием. К разбавленному раствору соли двухвалентной меди прибавляют йодистого калия; выделяющийся йод окрашивает раствор в желтый цвет. Кроме того, если в солянокислый раствор, содержащий медь, положить кусочек йодистого калия, образуется очень тонкий светложелтый аморфный осадок йодистой меди. Желтая окраска йодистой меди придается в этом случае выделяющимся йодом.
в) Реакция с металлическим железом. Если к солянокислому раствору меди прибавить кусочек металлического железа или опустить в раствор кончик стальной иглы, то из раствора выделяется металлическая медь в виде налета на кусочке железа или на иголке.
г) Сухая реакция. Солянокислый раствор меди окрашивает пламя спиртовки в голубой или зеленый цвет. При сплавлении с содой медного минерала медь восстанавливается - до металлической и выделяется в виде красного ковкого королька.
д) Получение кристаллов Cu(CNS)2 • Hg(CNS)2 • Н2O. Минерал растворяют в HNO3, и затем раствор выпаривают досуха. Сухой остаток растворяют в разбавленной уксусной кислоте. К холодной капле раствора прибавляют маленькую каплю реактива NH4Hg(CNS)2, и немного подогревают. При этом выпадает
Cu(CNS)2 • Hg(CNS)2 • Н2O. Минерал растворяют в HNO3, и затем раствор выпаривают досуха. Сухой остаток растворяют в разбавленной уксусной кислоте. К холодной капле раствора прибавляют маленькую каплю реактива NH4Hg(CNS)2, и немного подогревают. При этом выпадает
желто-зеленый моховидный осадок роданистой медно-ртутной соли Cu(CNS)2 • Hg(CNS)2 • Н2O (рис. 23). Под микроскопомэтот осадок представлен призматически-игольчатыми агрегатами. Отдельные иголочки имеют прямое угасание.
е) Капельная реакция. Фильтровальную бумагу пропитывают насыщенным раствором роданистого калия, который перед этим наполовину разбавляют водой, и на эту бумагу помещают каплю испытуемого медьсодержащего раствора. В присутствия меди на бумаге образуется бурое пятно. Затем бумагу держат над парами NН3, и получают комплексный ион аммония и меди голубого цвета. На это голубое пятно помещают каплю желтой кровяной соли. Пятно переходит в бурый цвет (отличие от никеля).
Молибден
Молибден встречается в виде молибденита, вульфенита и повеллита. В молибдените молибден четырехвалентный, а в вульфените и повеллите — шестнвалентный. Соединения молибдена обычно растворимы в кислотах.
а) Реакция с серной кислотой. Если выпарить в капле крепкой H2SO4 молибденовое соединение, как, например, вульфенит или повеллит, то сухой остаток окрашивается в интенсивный синий цвет, т. е. происходит образование молибденовой сини.
б) Реакция с цинком. Если к солянокислому раствору молибдена прибавить кусочек цинка, то раствор окрашивается сначалав синий, затем в зеленый и, наконец, в бурый цвет. Так же действуют SnCb и другие восстановители.
в) Реакция с ксантогенатом калия. Несколько зерен молибденита сплавляют в ушке платиновой проволоки с содой, и растворяют сплав в нескольких каплях соляной кислоты (1:1). К полученному слабо кислому раствору прибавляют кристаллик ксантогената калия. При этом молибден окрашивает раствор в красный цвет. Реакция очень чувствительная и специфичная для молибдена.
г) Реакция с роданистым калием. Если на солянокислый раствор молибдена подействовать роданистым калием в присутствии цинка или SnCl2, то в связи с образованием роданистого молибдена раствор окрасится в кроваво-красный цвет. При прибавлении перекиси водорода окраска исчезает.
д) Получение кристаллов TlMoO4. Минерал сплавляют с КОН
на платиновой проволочке, н сплав растворяют в воде. В растворе должен быть избыток КОН или NaOH. На предметное стекло помещают каплю раствора, и к ней прибавляют кристаллик азотнокислого таллия. Выпадают просвечивающие бесцветные или слабо окрашенные в желтый цвет шестисторонние листочки молнбденовокислого таллия, иногда появляются красивые решетчатые шестилучевые звезды, лучи которых направлены под углами 60 и 120°.
Мышьяк
Важнейшими из мышьяковых руд являются сульфиды, арсениды н сульфосоли. Среди сульфидов известны реальгар, аурипигмент, арсенопирит. Из арсенидов — никелин, шмальтин. Из сульфосолей — блеклая руда, представляющая собой смесь сульфо-мышьяковистокислых и сульфо-сурьмянистокислых соединений, главным образом меди, ртути, железа и цинка. Все перечисленные соединения мышьяка растворимы в азотной кислоте или в царской водке. При прокаливании их с содой на угле в окислительном пламени они дают белый дым с резким чесночным запахом и образуют пепельно-серый налет.
а) Реакция с молибденовокислым аммонием. Если минерал не растворим в крепкой HNO3, его сплавляют с Na2СО3. Сплав растворяют в азотной кислоте, и к раствору прибавляют молибденовокнслого аммония. Этот раствор подогревают на слабом пламени спиртовки. В присутствии мышьяка выпадает желтый осадок мышьяково-молибденовокислого аммония. Аналогичная реакция получается в присутствии фосфора без подогревания.
б) Получение мышьякового зеркала. Измельченный мышьяковый минерал помещают в закрытую трубку и прокаливают перед паяльной трубкой на пламени спиртовки: на стенках закрытой трубки в удалении от пробы образуется возгон металлического мышьяка черного цвета и вблизи пробы — светлосерый налет As2S3. Металлический налет можно проверить на мышьяк, растворяя в азотной кислоте и действуя на раствор молибденово-кислым аммонием. При этом должен получиться желтый осадок мышьяково-молибденовокислого аммония,
в) Восстановление мышьяка. Минерал растворяют в царской водке, и раствор выпаривают досуха (не рекомендуется оставлять сухой остаток на огне, так как мышьяк летуч). Сухой остаток растворяют в капле соляной кислоты и капле воды, и к раствору прибавляют хлористое олово, В присутствии мышьяка выпадает осадок черного или бурого цвета (при малом содержании мышьяка надо раствор нагреть и подождать 3—5 мин.). При кипячении сухого остатка с соляной кислотой и металлическим цинком выделяется черная пена металлического мышьяка.
Натрий
Соединения натрия, растворенные в соляной кислоте, окрашивают пламя в интенсивный желтый цвет.
Никель
К раствору никельсодоржащего минерала прибавляют небольшой избыток аммиака и немного порошка дпметилглиоксима и нагревают раствор до кипения. В присутствии даже небольших количеств никеля выпадает красивый карминово-красный осадок.
 Олово
Олово
Важнейшими минералами олова являются касситерит и станнин.
а) Открытие олова в касситерите. На предметное стекло помещают каплю крепкой соляной кислоты, в каплю погружают небольшое зерно касситерита и прибавляют цинковой пыли. Происходит восстановление SnO2 до металлического олова, которое выделяется в виде металлического зеркала — налета на зерне касситерита. В случае, если цинковой пыли было прибавлено недостаточно для нейтрализации всего раствора, после некоторого стояния оловянная рубашка на зерне касситерита растворяется в соляной кислоте и зерно приобретает прежний вид. Металлическое зеркало не всегда получается быстро, особенно на светлых разностях касситерита. Если зерно не покрывается металлическим налетом с одного раза, его следует поместить в новую каплю соляной кислоты и прибавить новые порции цинковой пыли: при повторной обработке зерна налет получается моментально.
б) Получение кристаллов Rb2SnCl6. Минерал, содержащий олово, растворяют в азотной кислоте, и раствор выпаривают на водяной бане досуха. Сухой остаток снова растворяют и воде: остается нерастворимой метаоловянная кислота, которую отфильтровывают по способу Геммеса. К остатку метаоловянной кислоты прибавляют каплю слабой соляной кислоты и кристаллик хлористого рубидия. В присутствии последнего выпадают кристаллы хлоростанната рубидия кубической сингонии, представленные октаэдрами, ромбододекаэдрами и кубооктаэдрами. Иногда в вершинах октаэдров появляются темные точки (рис. 24).
Платина
В природе встречается главным образом самородная платина,
а) Реакция с диметилглиоксимом. К раствору платины в царской водке прибавляют воды, каплю соляной кислоты и избыток диметилглиоксима. При кипячении раствора получается осадок сине-зеленого цвета. При небольшом содержании платины осадок выпадает только после охлаждения раствора,
б) Получение кристаллов Rb2PtCl6. Если самородная платина не содержит значительных примесей иридия, осмия и родия, то она легко растворяется в царской водке. При этом получается раствор хлорной платины. Если к капле этого раствора прибавить кристаллик хлористого рубидия, получаются мелкие октаэдры совершенной формы желтого цвета, наблюдаемые под микроскопом/
 в) Получение кристаллов K2PtCl6. Хлористый калий осаждает из раствора хлорной платины красивые лимонно-желтые октаэдры (рис. 25). (Описание их было дано при калии.)
в) Получение кристаллов K2PtCl6. Хлористый калий осаждает из раствора хлорной платины красивые лимонно-желтые октаэдры (рис. 25). (Описание их было дано при калии.)
Ртуть
Ртуть в природе встречается главным образом в виде киновари HgS, растворимой в царской водке с выделением серы.
а) Восстановление ртути из киновари. Раскаленным шарикомсоды на платиновой палочке прикасаются к порошку или зерну киновари, помещенному в фарфоровой чашечке. Минерал дает газообразные продукты разложения, но на холодных стенках чашечки пары ртути, конденсируясь, образуют капельки металлической ртути, которые хорошо можно видеть под бинокуляром. Для этой реакции достаточно одного зерна киновари, размером около 0,2 мм. Капельки ртути растворяются в HNO3.
б) Получение кристаллов Hg(CNS)2 • Co(CNS)2. К капле раствора киновари в царской водке прибавляют каплю раствора азотнокислого кобальта и роданистого аммония. В результате выпадают синие призматические двойные кристаллы Hg(CNS)2 • Co(CNS)2.
Свинец
 Свинец в природе встречается в виде галенита, церуссита, англезита, пироморфита, миметезита, ванадинита, вульфенита и т. д. Перечисленные свинцовые минералы, за исключением англезита, растворимы в соляной и азотной кислотах. Нерастворимые минералы свинца сплавляются с содой и сплав выщелачивают кислотами.
Свинец в природе встречается в виде галенита, церуссита, англезита, пироморфита, миметезита, ванадинита, вульфенита и т. д. Перечисленные свинцовые минералы, за исключением англезита, растворимы в соляной и азотной кислотах. Нерастворимые минералы свинца сплавляются с содой и сплав выщелачивают кислотами.
а) Получение кристаллов соли двуиодистого свинца. Минерал растворяют на предметном стекле в соляной или азотной
кислоте. Полученный раствор, содержащий свинец, досуха выпаривают. Сухой остаток растворяют в капле воды, и к водному
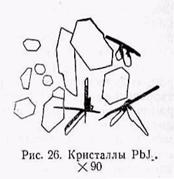
раствору свинца прибавляют кристаллик йодистого калия. В результате получаются золотисто-желтые кристаллы PbJ2 в виде
неправильных шестиугольных пластинок, которые можно наблюдать под микроскопом (рис. 26).
б) Получение свинцового королька. При сплавлении порошка свинцового минерала с содой на угле в восстановительном пламени получается королек металлического свинца, отличающегося большой ковкостью, легкой растворимостью в азотной и, при нагревании, в соляной кислоте.
Сера
а) Получение серной печени. Порошок минерала сплавляют с содой и небольшим количеством угля на платиновой проволочке или на угле в окислительном пламени. Полученный сплав погружают в каплю воды на металлической пластинке серебра (монете). При наличии в минерале серы на серебряной пластинке образуется черное или темно бурое пятно.
б) Получение осадка сернокислого бария. При действии раствором хлористого бария на солянокислый раствор минералов, содержащих шестивалентную или сульфатную серу, выпадает густой тонкокристаллический осадок сернокислого бария.
Серебро
Серебро встречается в самородном состоянии, но главным образом в соединениях с серой, мышьяком и сурьмой в виде пираргирита Ag3SbS3 и прустита Ag3AsS3, а также в виде кераргирита AgCl. Примеси серебра встречаются в блеклых рудах и в галените. Большинство серебросодержащих минералов хорошо растворимо в азотной кислоте. Все соединения серебра при прокаливании с содой на угле легко восстанавливаются, образуя белый металлический ковкий королек серебра без налета (отличие от свинца и олова), легко растворимый в азотной кислоте (отличие от олова). Азотнокислый раствор серебра с соляной кислотой дает белый творожистый осадок хлористого серебра (отличие от свинца).
а) Образование окиси серебра. Минерал растворяют в азотной кислоте и раствор выпаривают досуха. Сухой остаток растворяют в воде и к нейтральному водному раствору серебра добавляют каплю аммиака. В результате образуется AgOH, а затем бурая окись серебра Ag2O, которая растворима в избытке аммиака.
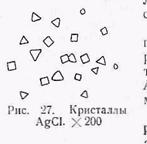 б) Образование хлористого серебра. При действии на азотнокислый раствор серебряных минералов соляной кислотой выпадает белый творожистый осадок хлористого серебра AgCl, который на воздухе быстро темнеет. Осадок хлористого серебра легко растворяется при прибавлении нескольких капель аммиака (рис. 27).
б) Образование хлористого серебра. При действии на азотнокислый раствор серебряных минералов соляной кислотой выпадает белый творожистый осадок хлористого серебра AgCl, который на воздухе быстро темнеет. Осадок хлористого серебра легко растворяется при прибавлении нескольких капель аммиака (рис. 27).
в) Образование йодистого серебра. Прифибавлении к нейтральному раствору серебра капли йодистого калия выпадает желтый творожистый осадок йодистого серебра AgJ, практически не растворимого в аммиаке.
г) Образование двухромовокислого серебра. При прибавлении к слабо нагретому азотнокислому раствору серебра кристаллика хромовокислого аммония выпадает соль Ag2Cr2O7 в виде крупных триклинных пластинок и ромбов, окрашенных в разные цвета (начиная от желтого и кончая кроваво-красным).
Сурьма
Из сернистых соединений сурьмы наиболее важное значение имеет антимонит, из кислородных — валснтпнит. В окислительном пламени сурьмяные минералы дают на угле белый налет Sb205 вблизи пробы и хрупкий металлический королек.
а) Открытие сурьмы в антимоните. В КОН зерна антимонитапокрываются оранжевой пленкой сурьмяных сульфосолей. Этареакция хорошо удается в свободных зернах я при травленииполированных шлифов с антимонитом.
б) Открытие сурьмы в валентините. Минерал растворяют в соляной кислоте. При прибавлении к раствору хлористой сурьмы воды образуется белый осадок хлорокиси сурьмы SbOCl. Если солянокислый раствор сурьмы покипятить с кусочком металлического железа, выпадают черные хлопья металлической сурьмы.
в) Получение кристаллов Cs2SbCl5 • 2,5Н3O. Берут каплю солянокислого раствора сурьмяного минерала, С одной стороны капли помещают кристаллик CsCl, а с противоположной — немного KJ. Выпадают кристаллы состава Cs2SbCl5 • 2,5Н3O в виде шестиугольных пластинок желтого цвета, похожих по форме на кристаллы аналогичной соли висмута (см. рис. 15), но отличных по цвету (последние имеют красный цвет).
г) Определение сурьмы с родамином В. Зерна сурьмяного минерала растворяют в нескольких каплях соляной кислоты при нагревании на часовом стекле. Затем раствор охлаждают, и приливают в фарфоровый тигелек или фарфоровую чашечку к 1 см3 раствора родамина В. Присутствие сурьмы вызывает изменение красной окраски реактива в фиолетовую. Трехвалентную сурьму следует предварительно окислить прибавлением нескольких крупинок нитрита натрия. Родамин В применяют в концентрации 0,01 г красителя на 100 см3 воды.
Тантал и ниобий
а) Реакция образования гексатанталата натрия Na8Ta6O19 · 25Н2О и гексаниобата натрия Na2Nb6O19 • 16Н2O. Реакция основана на различной растворимости калиевой и натриевой солей кислот тантала и ниобия. Калиевая соль сравнительно хорошо растворима в воде, натриевая соль растворима при комнатной температуре очень мало, несколько больше при нагревании.
Разложение минерала производят путем сплавления с КОН. Сплав выщелачивают на часовом стекле небольшим количеством воды, к которой прибавлена капля КОН (10%), чтобы предотвратить выпадение трудно растворимой кислой калиевой соли. Раствор отфильтровывают по методу Геммеса. Затем к капле раствора на предметном стекле прибавляют 1 каплю 10%-ного раствора NaOH и несколько кристалликов уксуснокислого натрия. Через некоторое время у края капли начинают расти бесцветные кристаллы гексатанталата натрия Na8Ta6O19 · 25Н2О и гексаниобата натрия Na2Nb6O19 • 16Н2O. Сначала выпадают палочки, затем шестиугольники, совершенно правильные пли слегка вытянутые, и, наконец, шестиугольные звезды.
б) Открытие тантала и ниобия с таннином. Небольшое количество зерен танталового или ниобиевого минерала растирают в тонкий порошок и сплавляют в маленьком фарфоровом тигле с кристалликами KHSO4, или К2S2О7. Затем сплав растворяют в 1 — 2 см3 горячего раствора щавелевокислого аммония. К полученному раствору прибавляют 0,1 г NH4C1 и 0,02 г сухого таннина, и раствор осторожно кипятят в пробирке. Минералы, содержащие тантал, дают при этом желтый осадок; содержащие ниобий — оранжевый или оранжево-красный. В слабо щавелевокислом растворе присутствие Fe не мешает течению реакции.
Теллур
а) Реакция с серной кислотой H2SO4. Концентрированную серную кислоту кипятят в фарфоровой чашечке для удаления воды, затем прибавляют порошок исследуемого теллурсодержащего минерала и полученный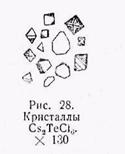 раствор нагревают, но не до кипения. Раствор окрашивается в карминово-красный цвет, который исчезает при кипячении или разбавлении водой.
раствор нагревают, но не до кипения. Раствор окрашивается в карминово-красный цвет, который исчезает при кипячении или разбавлении водой.
б) Получение кристаллов Cs2TeCl6. К солянокислому раствору теллура прибавляют кристаллик хлористого цезия, причем выпадают
лимонно-желтые прозрачные октаэдры Cs2TeCl6, которые разлагаются при прибавлении воды (рис. 28). От йодистого калия кристаллики моментально окрашиваются в черно-бурый цвет (в отличие от хлороплатмната цезия).
Титан
В природе титан чаще всего встречается в виде ильменита, сфена и окислов (рутила, анатаза и брукнта), реже перовскита. Соединения титана в кислотах не растворимы. В растворимое состояние титановые минералы переводятся путем сплавления с содой или кислым сернокислым калием. При сплавлении титановых минералов с бурой и оловом в восстановительном пламени перл становится по охлаждении фиолетовым.
Реакция с перекисью водорода. Минерал сплавляют с содой и обрабатывают равными объемами воды и серной кислоты, затем сплав кипятят в пробирке до растворения мути, К полученному раствору прибавляют 1—2 капли фосфорной кислоты и 2 капли перекиси водорода. При наличии титана раствор окрашивается, в зависимости от концентрации, в цвет светложелтый до густооранжевого. Церий с перекисью водорода также дает бледножелтую окраску, но никогда не дает оранжевой. Реакции мешают хроматы, ванадаты и молибдаты. Эта реакция весьма чувствительна и позволяет установить присутствие титана при наличии одного небольшого зерна титансодержащего минерала.
Фосфор
Из фосфорсодержащих шлиховых минералов наиболее распространенными являются апатит и монацит.
Осаждение молибденовокислым аммонием. Фосфорсодержащие минералы растворяют в азотной кислоте, а если минерал трудно растворим, его предварительно сплавляют с содой. К азотнокислому раствору прибавляют несколько зернышек молибденовокислого аммония. В присутствии фосфора образуется желтый тонкокристаллический осадок фосфорно-молибденовокислого аммония. Подобная реакция происходит и с мышьяковыми минералами, но при нагревании.
Хром
Главными из хромсодержащих минералов являются хромит и хромовые шпинели, не растворимые в кислотах.
а) Сухие реакции. При сплавлении с содой, которое следует производить в окислительном пламени, получается непрозрачный желтый сплав. Чувствительность реакции увеличивается от прибавления к сплаву селитры KN03 или перекиси натрия. Корольки же хрома с бурой н фосфорной солью имеют в холодном состоянии ярко-зеленый цвет, все равно — образовались ли они в окислительном, или в восстановительном пламени.
б) Получение хромовокислого серебра. При сплавлении с содой и селитрой или перекисью натрия (для лучшего окисления), хромсодержащие минералы разлагаются с образованием хромата натрия, который растворяется в воде. При прибавлении к нейтральному раствору хромовокислых солей азотнокислого серебра получается буро-красный осадок хромовокислого серебра (рис. 29).

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 |




