6) Реакция с йодистым калием. Подпетый калий окрашивает солянокислый раствор висмутового минерала в желтый или оранжевый цвет вследствие образования йодистого соединения висмута КBiJ4 (Сначала образуется черный осадок BiJ3 растворяющийся в избытке реактива).
в) Налет на угле. Смесь исследуемого порошка сплавляют с серой и йодистым калием в окислительном пламени. Вблизи от пробы образуется желтый налет окиси висмута и на некотором расстоянии — ярко-красный налет ВiJз. Пары аммиака переводят ярко-красную кайму налета висмута в оранжевую, а после некоторого стояния — в вишнево-красную.
г) Королек на угле. Смесь минерала с двойным объемом соды при нагревании в восстановительном пламени дает хрупкий металлический королек висмута и желтый налет Bi2О3. В отличие от свинцового королька, у висмутового королька отсутствует
ковкость и наблюдается розоватый оттенок в свежем изломе.
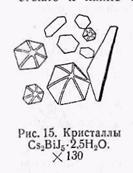 д) Получение кристаллов Сs2BiJ5 • 2,5Н2O. На предметном стекле к капле солянокислого раствора висмутового минерала прибавляют кристаллики йодистого калия и хлористого цезия. Выпадают красные кристаллы Сs2BiJ5 • 2,5Н2O гексагональной сингонии, чаще представленные равносторонними или слегка удлиненными шестиугольными пластинками, изотропными при скрещенных николях (рис. 15). Если пластинки ложатся наклонно или на ребро, то они ярко поляризуют. Реакция производится исключительно в солянокислой среде. В случае азотнокислого раствора висмутового минерала раствор выпаривают досуха и к сухому остатку прибавляют каплю соляной кислоты, а также вводят в сухом виде хлористый цезий и йодистый калий.
д) Получение кристаллов Сs2BiJ5 • 2,5Н2O. На предметном стекле к капле солянокислого раствора висмутового минерала прибавляют кристаллики йодистого калия и хлористого цезия. Выпадают красные кристаллы Сs2BiJ5 • 2,5Н2O гексагональной сингонии, чаще представленные равносторонними или слегка удлиненными шестиугольными пластинками, изотропными при скрещенных николях (рис. 15). Если пластинки ложатся наклонно или на ребро, то они ярко поляризуют. Реакция производится исключительно в солянокислой среде. В случае азотнокислого раствора висмутового минерала раствор выпаривают досуха и к сухому остатку прибавляют каплю соляной кислоты, а также вводят в сухом виде хлористый цезий и йодистый калий.
е) Получение кристаллов ЗК2SO4 • Вi2(SO4)3. Эта реакция удается с сильно концентрированной каплей испытуемого раствора, содержащего не меньше 0,2% азотнокислого висмута. К азотнокислому раствору висмутового минерала на предметном
стекле прибавляют каплю крепкой Н2SО4, после чего раствор
выпаривают почти досуха.
Остаток растворяют в капле Н2O, и на этом же стекле рядом с раствором помещают каплю К2SO4.Каплю висмутсодержащего раствора соединяют с каплей К2SO4 платиновой проволочкой. В месте соединения появляются кристаллы в виде изотропных шестиугольных пластинок. Иногда эти пластинки имеют темные полоски соединения двух вершин противоположных углов.
Вольфрам
Вольфрамовые соединения в природе представлены главным образом минералами шеелитовой и вольфрамитовой групп. Минералы первой группы значительно легче растворимы в кислотах, чем минералы второй. При разложении вольфрамовых соединений соляной кислотой получается осадок желтого цвета, что указывает на присутствие H2WO4. Вольфрамовая кислота H2WO4, очень хорошо растворима в едких щелочах, аммиаке и NaСО3.
а) Реакция с металлическим оловом. Эта реакция очень чувствительная: для нее достаточно одного небольшого зерна. При проверке минералов на вольфрам пользуются главным образом этой реакцией. Ход реакции несколько различен в случае растворимых (шеелит) и нерастворимых (вольфрамит, гюбнерит) в кислотах вольфрамсодержащих минералов.
В первом случае получают пленочную реакцию. В фарфоровой чашечке или тигельке помещают каплю крепкой НСl, зерно шеелита и зерно металлического олова и нагревают на пламени спиртовки. При этом зерно шеелита покрывается темносиней пленкой, а по краям раствора также появляется синяя каемка. Посинение происходит вследствие образования W2O5.
Во втором случае нерастворимые в соляной кислоте вольфрамовые минералы (вольфрамит, гюбнерит и ферберит) предварительно сплавляют с содой, чтобы получить NaWO4. Этот сплав при растворении в соляной кислоте дает осадок желтой вольфрамовой кислоты, которая при кипячении с металлическим оловом переходит в соединения пятивалентного вольфрама в виде синих хлопьев. Следует иметь в виду, что при этой реакции синяя окраска с зеленым оттенком может появиться и в присутствии ванадия и молибдена.
б) Восстановление вольфрама на алюминиевой пластинке. На алюминиевой пластинке помещают тонкоизмельченный порошок вольфрамового минерала и заливают соляной кислотой. В присутствии вольфрама после некоторого стояния появляется голубая окраска.
в) Получение кристаллов Тl2WO4. Минерал, содержащий вольфрам, при сплавлении с содой переходит в соединение Na2WO4. К нагретому слабо щелочному раствору Na2WO4 прибавляют кристаллик ТlNO3, и слегка концентрируют раствор подогреванием. После этого медленно вырастают просвечивающие бесцветные шестисторонние пластинчатые кристаллики Тl2WO4, реже появляются шестилучевые звезды, лучи которых направлены друг к другу под углами 60 и 120°. Подобные соединения получаются с молибденом (см. Молибден).
Железо
Важнейшими на минералов железа являются его окислы и сернистые соединения: гематит, магнетит, гыдроокислы железа, пирит и пирротин. Наряду с этим железо имеет широкое развитие в виде ильменита и хромита и в виде силикатов: пироксенов, амфиболов, гранатов и др. Карбонатные и фосфатные соединения железа наблюдаются значительно реже и представлены сидеритом и вивианитом. Все упомянутые соединения железа, за исключением ильменита и силикатов, растворимы в кислотах.
Железо образует соединения двоякого рода: закисные — соединения двухвалентного железа и офисные соединения трехвалентного. Те и другие относятся совершенно различно к ряду реактивов. Разбавленные растворы двухвалентного (закисного) железа бесцветны, концентрированные — окрашены в зеленоватый цвет, как, например, растворы сидерита и сернистого железа (пирротина). Растворы трехвалентного (окисного) железа имеют желтовато-бурый цвет.
а) Осаждение аммиаком. Из нейтральных растворов солей закисного железа аммиак осаждает зеленовато-белый гидрат закиси железа Fe(OH)2, но не полностью, так как Fe(OH)2 растворим в аммонийных солях. Из растворов солей окнсного железа аммиак полностью осаждает бурый студенистый гидрат окиси железа Fe(OH)3.
б) Реакции с роданистым калием KCNS и роданистым аммонием NH4CNS. С соединениями закисного железа эти реактивы не реагируют, растворы же соединений окисного железа окрашивают их в кроваво-красный цвет.
в) Реакции с железистосинеродистым калием K4[Fe(CN)6]. Из нейтральных или кислых растворов соединений окисного железа осаждается берлинская лазурь интенсивного синего цвета. С соединениями же закисного железа обычно образуется осадок
железистосинеродистого железа, который вследствие его частичного окисления бывает окрашен в светлоголубой цвет.
г) Реакция с железосинеродистым калием К3[Fе(CN)6]. С соединениями закисного железа образуется осадок темносинего цвета, называемый турнбулева синь. Этот осадок не растворим в кислотах, но разлагается едкими щелочами, В ходе последней реакции образуется смесь гидратов закиси и окиси железа. В отличие от закисного железа, окисное железо с железосинеродистым калием не образует синего осадка, но образует темнокоричневый раствор.
Золото
В природе встречается главным образом самородное золото, реже наблюдается теллурнстое золото. Золото бывает также связано с сульфидами железа, свинца и цинка в твердом растворе. Растворяется золото в царской водке; растворение происходит с образованием золотохлористоводородтой кислоты HAuCl4, при выпаривании которой получаются красные кристаллы.
а) Получение кассиева пурпура. Раствор золота в царской водке осторожно выпаривают досуха. Сухой остаток растворяют в небольшом количестве воды, и прибавляют каплю хлористого олова SnCl2, которое вызывает окрашивание раствора в пурпурно-красный цвет вследствие выделения коллоидального золота. При значительном количестве золота получается пурпурно-красный осадок (кассисв золотой пурпур), представляющий собой адсорбционную смесь коллоидального золота и гидрата окиси олова. Коагулированный золотой пурпур растворяется в аммиаке и в очень разбавленном растворе КОН с окрашиванием раствора в красный цвет.
б) Сухая реакция. Все соединения золота дают при сплавлении с содой на угле в восстановительном пламени металлический желтый королек, обладающий ковкостью и не растворимый в кислотах, но растворимый в царской водке.
в) Получение кристаллов TlAuCl4*5H2O. Раствор золота в царской водке выпаривают, и сухой остаток растворяют в воде. Получается нейтральный раствор, к которому прибавляют кристаллик азотнокислого таллия T1NO3: из раствора вырастает бахрома лимонно-желтых игл TlAuCl4*5H2O. Длина игл может быть более 100 микронов. Они имеют высокое двупреломление, положительное удлинение и угол угасания 28°. Следует указать, что в растворах хлорной ртути при прибавлении азотнокислого таллия появляются бесцветные иглы такой же формы и величины.
г) Получение кристаллов ZnAu(CNS)5. Роданистый аммоний образует в нейтральном растворе золота красный осадок, легко вырастающий в пушистые, очень характерные розетки. Если роданистого аммония было взято не очень много и если к осадку прибавить уксуснокислого цинка, осадок можно полностью растворить без нагревания. При стоянии из раствора выделяется ZnAu(CNS)5 в виде мелких удлиненных кристалликов ромбической сингонии ярко-желтого цвета. Одиночные кристаллики наблюдаются редко, чаще представлены их группы. При избытке раствора NH4CNS двойная соль ZnAu(CNS)5 не выкристаллизовывается.
Калий
а) Окрашивание пламени. От солей калия пламя окрашивается в фиолетовый цвет. Окраска пламени часто маскируется натрием, поэтому необходимо пользоваться синим кобальтовым стеклом, поглощающим желтый цвет.
б) Получение кристаллов K2PtCl6. К исследуемой капле нейтрального или слабо подкисленного соляной кислотой раствора при нагревании прибавляют стеклянной палочкой каплю 10%-ного раствора хлорной платины. Желателен избыток реактива. Если раствор не был слишком концентрирован, выпадают лимонно-желтые октаэдры неправильной формы (рис. 16). Если же раствор был очень концен трирован или содержал много кислоты, выпадают дендриты или появляется светложелтый мелкокристаллический осадок.
трирован или содержал много кислоты, выпадают дендриты или появляется светложелтый мелкокристаллический осадок.
Кристаллы хлороплатината калия обладают блеском и сильно преломляют свет; в отраженном свете они кажутся полуметаллическими. Вследствие сильного преломления свет, падающий па углы октаэдра, полностью отражается. Кристаллы (особенно мелкие) имеют поэтому неясные закругленные контуры и кажутся похожими больше на маленькие ядрышки, чем на хорошо образованные октаэдры. Этой реакции мешают аммоний, рубидий, цезий и таллий. Нерастворимые минералы калия следует в случае данной реакции сплавлять на угле, а не на платиновой проволочке.
Кальций
Кальций — очень распространенный элемент. Известны главным образом его углекислые соединения — кальцит и арагонит и сернокислые — гипс и ангидрит. Кальций встречается также в виде фтористого соединения — плавикового шпата. Он содержится, кроме того, в многочисленных силикатах, из которых наиболее важны волластонит, анортит, эпидот и др. Из фосфорных соединений кальция назовем апатит. Соединения кальция бесцветные или белые. В кислотах растворимы углекислые, сернокислые и фосфорные соединения кальция. Силикаты кальция в кислотах не растворимы. Флюорит разлагается серной кислотой.
а) Окрашивание пламени. Калийсодержащие хлористые растворы при прокаливании окрашивают пламя в кирпично-красный цвет.
б) Осаждение из аммиачных растворов. Из растворов кальция, содержащих небольшой избыток аммиака, кальций легко осаждается щавелевокислым аммонием (NH4)2CO3 или углекислым аммонием (NH4)2CO3 в виде белого кристаллического осадка СаС2О4 или СаСO3. Щавелевокислый аммоний осаждает кальций также и из слабокислых растворов.
в) Осаждение из солянокислых растворов. При растворении кальцита или другого кальцийсодержащего минерала на предметном стекле в соляной кислоте и прибавлении к раствору капли серной кислоты выпадает обильный тонкокристаллический белый
осадок. При сильном разбавлении раствора и кипячении осадок
растворяется, в отличие от ВаSО4 который при этих условиях
не растворим, и SrSO4 растворимость которого гораздо меньше. Это единственная реакция, которой можно пользоваться для открытия кальция в присутствии стронция и бария.
Осаждение кальция разбавленной серной кислотой или сернокислым натрием — обычная реакция при исследовании минералов на кальций. Кристаллы CaSO4 • 2Н2О лучше осаждаются из нейтральных или слабо кислых растворов, причем раствор приходится немного нагревать и концентрировать. Образование кристаллов происходит тогда по краям пробной капли. Кристаллы CaSO4 • 2Н2О выпадают в виде тонких призматических игл моноклинной сингонии с углом угасания 52°, слабым двупреломлением и серыми цветами интерференции. Такие игловидные кристаллы обычно образуются в виде пучков или веерообразных агрегатов. Кроме того, наблюдаются двойники с входящими углами, похожие на ласточкин хвост (рис. 17).
Кобальт
Кобальт встречается главным образом в виде сернисто-мышьяковистого и мышьяковистого соединений, причем наиболее важными из кобальтовых руд являются кобальтин CoAsS и шмальтин СоAs2. Из вторичных минералов кобальта наиболее известен кобальтовый цвет Со3(АsО4)2 • 8Н2O. Первые два кобальтовых минерала растворимы в HNO3 и перекиси водорода, а последний растворяется в НСl с окрашиванием раствора в розово-красный цвет и во всех минеральных кислотах.
а) Осаждение щелочами. Едкие щелочи (калий и натрий) осаждают синюю основную соль кобальта Со(ОН)С1, которая при нагревании разлагается и образует розово-красный гидрат закиси кобальта Со(ОН)2.
б) Получение кристаллов Co(CNS)2 •Hg(CNS)3. Характерная реакция на кобальт. В качестве реактива применяют (NH4)2Hg(CNS), для приготовления которого растворяют в 5 см3 воды при комнатной температуре 3 г хлорной ртути и 3,3 г роданистого аммония. Ход реакции следующий.
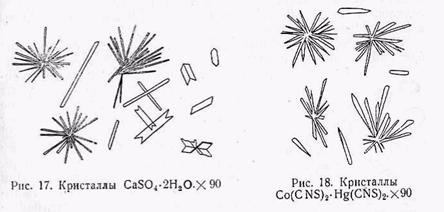
Берут каплю раствора кобальтового минерала и прибавляют каплю реактива. При взаимодействии капель происходит осаждение призматических кристаллов Co(CNS)2 •Hg(CNS)3. ромбической сингонии (рис. 18). Отдельные хорошо образованные кристаллы получаются редко. Большей частью они соединяются в неправильные группы или образуют шиловидные шарики. Кристаллы окрашены в прекрасный сними цвет, на толстых кристаллах синий цвет переходит в черный. В горячей поде они довольно хорошо растворяются, при охлаждении раствора снова выпадают по краям капли, Сильные кислоты быстро их разлагают и растворяют, поэтому рекомендуется производить реакцию в слабо кислых растворах.
в) Сухая реакция. Перлы буры и фосфорной соли как в окислительном, так и в восстановительном пламени солями кобальта окрашиваются в интенсивный синий цвет.
г) Королек на угле. При прокаливании с серой на угле соединения кобальта восстанавливаются до металла, притягиваемого магнитом. При выщелачивании содового сплава в воде остается черный порошок кобальта.
Кремний
Исключительно широкое распространение в природе имеют соединения кремния, называемые силикатами. Большая часть силикатов (полевые шпаты, пироксены, амфиболы, слюды и др.) обычно не растворимы в кислотах. Чтобы выделить из таких минералов кремнекислоту, нужно перевести их в растворимое состояние. Это достигается сплавлением их с углекислым натрием Na2CO3 или спеканием с хлористым аммонием и карбонатом кальция. При выпаривании с серной и плавиковой кислотами весь кремнезем улетучивается в виде SiF4. Сплавление силикатов с содой дает щелочные силикаты, растворимые в воде.
Некоторые силикаты непосредственно разлагаются кислотами. Сюда относятся главным образом цеолиты, которые разлагаются соляной кислотой при нагревании с образованием кремнекислоты в виде студня или порошка.
а) Получение кристаллов Na2SiF6. Минерал, содержащий кремний, сплавляют с содой на платиновой проволочке, и сплав растворяют в небольшом количестве воды. Прозрачный раствор концентрируют медленным выпариванием. На предметное стекло, покрытое коллодиумом, помещают рядом две капли разбавленной соляной кислоты: к одной прибавляют капельку раствора силиката, а к другой  — NH4F. Нагревают, и соединяют обе капли. При этом выпадают звездчатые или шестисторонние кристаллики Na2SiF6 гексагональной сингонии (рис. 19). Из мало разбавленных растворов выпадают нежные шестилучевые розетки (до 140 микронов) и очень редко маленькие ромбоэдры. Все эти кристаллы хорошо очерчены и окрашены в бледно-красноватый цвет. Реакция имеет тот недостаток, что многие фтористые соли, например титана-, оловянно, циркона - и борофтористые, дают с натрием кристаллы такого же вида и окраски.
— NH4F. Нагревают, и соединяют обе капли. При этом выпадают звездчатые или шестисторонние кристаллики Na2SiF6 гексагональной сингонии (рис. 19). Из мало разбавленных растворов выпадают нежные шестилучевые розетки (до 140 микронов) и очень редко маленькие ромбоэдры. Все эти кристаллы хорошо очерчены и окрашены в бледно-красноватый цвет. Реакция имеет тот недостаток, что многие фтористые соли, например титана-, оловянно, циркона - и борофтористые, дают с натрием кристаллы такого же вида и окраски.
б) Сухая реакция. При накаливании небольшого количества силиката в перле фосфорной соли металлические окислы растворяются, кремневая кислота же большей частью остается в перле, получая вид белой студенистой массы (кремневого скелета) во взвешенном состоянии. Но никогда не следует ограничиваться одной этой реакцией, ибо многие силикаты цеолитовой группы дают прозрачный перл фосфорной соли без скелета.
Литий
Литиевые соединения имеют ограниченное развитие в природе. Из литиевых минералов полезными являются сподумен и лепидолит. Другие литиевые минералы встречаются очень редко. Сподумен и лепидолит относятся к группе силикатов, не растворимых в кислотах, поэтому при анализе их сплавляют с содой, и сплав растворяют в соляной кислоте.
а) Получение фосфорнокислого лития. Из щелочного раствора хлористого лития фосфорнокислый натрий Na2HPO4 выделяет белый осадок фосфорнокислого лития Li3PO4. Если же нейтральный раствор лития после прибавления к нему фосфорнокислого натрия быстро нагреть до кипения, то осаждаются светлые прямоугольные таблички, имеющие высокое двупреломление и параллельное угасание.
б) Получение углекислого лития. Если к концентрированной капле раствора лития прибавить углекислого аммония, то выделяется белый порошкообразный осадок углекислого лития Li2CO3. Эта соль, в отличие от аналогичных углекислых солей калия, натрия и аммония, очень медленно растворяется в воде. В присутствии большого количества хлоридов щелочных металлов или хлористого аммония осадок углекислого лития не образуется. Из разбавленных растворов углекислый литий выпадает при подсыхании капли по ее краям в виде тонких призм и игл, похожих на кристаллы гипса.
в) Сухая реакция. Хлористые соли лития окрашивают пламя в карминово-красный цвет. В присутствии натриевых солей литиевая окраска маскируется, но при наблюдении через кобальтовое стекло красный цвет пламени становится видным.
Магний
Соединения магния очень распространены в природе. Важнейшие магниевые минералы: магнезит, доломит, карналлит, шпинель и соединения с алюминием и кремнием. Первые три минерала магния растворимы в кислотах. Шпинель и силикаты магния (пироксены, амфиболы, хлорит и др.) в кислотах не растворимы и поэтому предварительно сплавляются с содой.
а) Реакция с едкими щелочами КОН и NaOH. При прибавлении к раствору магния КОН или NaOH образуется белый студенистый осадок гидроокиси магния Mg(OH)2, растворимый в кислотах и аммонийных солях. Аммиак же почти не осаждает Mg(OH)2.
б) Получение кристаллов MgNH4PO4•6Н2O. К капле раствора магния прибавляют хлористый аммоний, и пересыщают раствор аммиаком. После прибавления аммиака следует раствор нагреть, чтобы получить хорошо образованные кристаллы. В нагретую каплю, выделяющую сильный запах аммиака, вносят кристаллик фосфорнокислого натрия. Из растворов, содержащих больше 10% магния, вначале выпадают иксобразные кристаллы, затем появляются хорошо образованные призматические кристаллики ромбической сингонии (рис. 20 и 21).
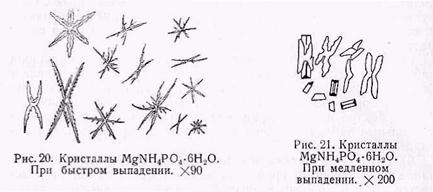
При избытке в растворе свободной соляной кислоты прибавляют сначала фосфорнокислого натрия, а затем, после нагревания, избыток аммиака. Вначале выпадает аморфный осадок, который быстро превращается в дендриты, особенно характерные для магния. Осадок MgNH4PO4 • 6Н2О хорошо растворим в кислотах, но стоит прибавить избыток аммиака, предварительно его нагрев, как снова образуется осадок MgNH4PO4 • 6Н2О. Присутствие щелочных металлов — натрия и калия не мешает этой реакции. Щелочноземельные металлы – кальций и стронций следует удалить серной кислотой или углекислым аммонием, чтобы они не мешали открытию магния. От осадка кальциевых солей раствор магния отфильтровывается по методу Геммеса.
в) Окрашивание раствором Co(NO3)2. Многие магнийсодержащие минералы не окрашены. При прокаливании и смачивании после прокаливания раствором Со(NO3)2 и при повторном сильном прокаливании неокрашенные минералы приобретают бледный мясо-красный цвет.
Марганец
Важнейшие марганцевые минералы: пиролюзит, браунит, манганит, родохрозит, гидроокислы марганца и родонит. Перечисленные марганцевые минералы, за исключением родонита и родохрозита, растворяются в соляной кислоте на холоду с окрашиванием раствора в характерный темный зелено-бурый цвет, При нагревании раствора выделяется хлор и раствор обесцвечивается, особенно сильно после разбавления водой: в этом случае марганец высшей валентности восстанавливается до двухвалентного. В родохрозите марганец двухвалентен, и поэтому его солянокислый раствор не окрашивается или имеет розовый цвет.
а) Получение Na2MnО4. При сплавлении всех марганцевых минералов с содой Na2СО3 или с едкой щелочью NaOH на платиновой проволоке в окислительном пламени, образуется Na2MnO4, который окрашивает сплав в голубовато-зеленый цвет. В восстановительном пламени Na2MnO4 не образуется и сплав имеет белый цвет. Для образования Na2MnO4 необходимо наличие свободного кислорода. При прибавлении к соде KNO3 реакция становится особенно чувствительной: получается более яркая и густая зеленая окраска сплава. При помощи этой реакции марганец открывается даже в количествах, исчисляемых долями миллиграмма.
б) Окрашивание перлов буры и фосфорной соли. Перлы буры и фосфорной соли при очень маленькой насадке порошка марганцевого минерала в окислительном пламени окрашиваются в фиолетовый цвет, в восстановительном же пламени они становятся совершенно бесцветными.
в) Реакция с двуокисью свинца PbO2 или суриком Pb3O4. Порошок марганцевого минерала помещают в пробирку, при бавляют 2—3 см3 азотной кислоты и кипятят. К раствору прибавляют затем порошковатой PbO2 или Pb3O4 и снова кипятят. При остывании цвет раствора от образования марганцевой кислоты HMnO4 становится фиолетово-красным или розовым.
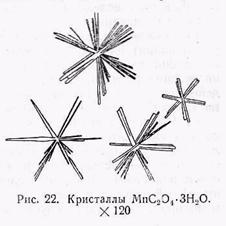
г) Получение кристаллов MnC2O4 • ЗН20. Реакцию лучше проводить в нейтральных растворах. Для этого необходимо каплю солянокислого раствора, содержащего марганец, выпарить на предметном стекле досуха и затем к охлажденному сухому остатку прибавить каплю воды и кристаллик щавелевокислого калия. При этом выпадают тонкие палочки, которые, звездообразно перекрещиваясь, соединяются в пучки (рис. 22). Угол угасания отдельных палочек прямой. Палочки двупреломляют. Присутствие больших количеств цинка, кобальта и никеля мешает образованию щавелевокислого марганца.
Медь
К типичным медным минералам относятся сульфиды, а также окислы, карбонаты и сернокислые соединения. Значительно реже встречается самородная медь. Из сульфидов меди наиболее известны халькозин и халькопирит, из окислов — куприт, а из карбонатов — малахит и медная синь. Перечисленные минералы растворимы в азотной и, за исключением сульфидов, в соляной кислоте. Растворы двухвалентной меди имеют голубей или зеленый цвет; при прибавлении аммиака цвет раствора изменяется в темно-синий вследствие образования комплексного аммиачно-медного соединения.
а) Осаждение щелочами. При действии едких щелочей (натрия и калия) на растворы двухвалентной меди образуется светло-голубой хлопьевидный осадок гидроокиси меди, которая при нагревании разлагается и дает черный осадок окиси меди. При действии же КОН на растворы одновалентной меди образуется на холоду желтый осадок гидрата закиси меди.

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 |




