Прозрачный цементный шлиф имеет некоторое сходство с петрографическим шлифом, так как при его изготовлении минералы шлифуются в различных сечениях, имеющих различную оптическую ориентировку. Поэтому для минералов, обладающих спайностью, можно наблюдать сечения, не только ориентированные по спайности, но и наклонные и перпендикулярные спайности. В последнем случае улавливаются следы спайности, относительно которых можно определять угол угасания. В случае наличия в минерале пересекающейся спайности устанавливается угол между плоскостями спайности. В иммерсионных препаратах последняя константа не определяется или с трудом улавливается по направлениям сколов.
Следует также отметить, что в иммерсионных препаратах обычно определяют отдельные минералы для подтверждения определений, полученных под бинокуляром. Прозрачные цементные шлифы используют не только для определения минералов, но и для установления количественных соотношений минералов во фракции или в пробе. Кроме того, в прозрачных цементных шлифах определяют, находятся ли минералы в свободном состоянии или в сростках, а также являются ли они чистыми или несут тонкие включения других минералов, незаметных под бинокуляром. Это особенно ценно при исследовании легкой и частично тяжелой неэлектромагнитной фракций, в которых преобладают бесцветные минералы.
В полированных цементных шлифах исследуют главным образом рудные непрозрачные и частично рудные прозрачные минералы с очень высокими показателями преломления, прячем исследование ведется таким же образом, как в полированных шлифах, изготовленных из штуфных образцов. В данном случае минералы определяют по цвету, отражательной способности, отношению к поляризованному свету {изотропный, анизотропный), к реактивам (к травлению). Травление возможно производить для зерен но меньше 0,05 мм, в противном случае захватывается цемент, который мешает реакции. В полированных цементных шлифах, так же как и в прозрачных, устанавливают количественное соотношение минералов во фракции или в пробе и состояние минерала: свободное, в сростках или с включениями. Исследование в отраженном свете особенно полезно для определения сульфидов и черных непрозрачных минералов: магнетита, гематита, лимонита, окислов марганца, вольфрамита, танталита и самородных металлов, которые под бинокуляром не всегда легко определяются.
Для изготовления прозрачных к полированных цементных шлифов из сыпучего материала служат зубной цемент, шеллак, бакелит и пластмасса. Зубной цемент, являясь двупреломляющей средой, имеет высокий показатель преломления. В этом случае высокопреломляющие и двупреломляющие минералы в очень тонких зернах трудно отличимы от зубного цемента и лучше применять изотропное вещество — шеллак или бакелит. Для полированных шлифов зубной цемент иногда также является неблагоприятной средой вследствие его зернистого строения и отражательной способности, равной отражательной способности нерудных минералов. Особенно неудобно им пользоваться при оценке количественного соотношения рудных и нерудных минералов. Нерудный минерал трудно отличить от зернистого зубного цемента. В этом случае следует употреблять аморфную однородную массу — шеллак или пластмассу.
5. ХИМИЧЕСКИЕ МЕТОДЫ
Наряду с оптическими методами в минералогическом анализе широко применяются химические методы. В большинстве случаев химические испытания производятся на отдельных минеральных зернах, реже химическими методами исследуется общая масса фракции или пробы. Установление качественного химического состава минерала способствует его определению.
Можно различать химические методы с полным разложением минерала и пленочные реакции, при которых на поверхности минерала образуется характерная пленка, способствующая его определению.
Методы с полным разложением минерала разделяются на мокрые и сухие. Принцип анализа мокрым путем состоит в том, что минерал растворяют в кислоте или в щелочи, и к раствору минерала прибавляют растворы известных веществ для получения реакции на исследуемые элементы. О присутствующих в минерале химических элементах судят по характеру растворения окраске раствора, выпадению осадка, выделению газовых пузырьков. В случае нерастворимых минералов их сплавляют с плавнями, например с содой, кислым сернокислым калием или щелочами, а полученные сплавы растворяют в воде или кислотах и открывают те или иные химические элементы в полученных растворах.
Преимущество мокрых реакций заключается в том, что они выполняются на предметном или часовом стекле с очень малым количеством вещества, выражаемым в тысячных долях грамма.
В группу сухих реакций входят методы определения минералов с паяльной трубкой: окрашивание пламени, получение окрашенных перлов на платиновой проволочке, налетов и металлических корольков на угле и возгонов на стеклянной трубке. В общем, эти методы менее однозначны и чувствительны и требуют значительно большего количества вещества.
Различные способы мокрых реакций зависят от того, какие элементы определяются, в каком количестве имеется испытуемое вещество и при каких условиях происходит наблюдение — простым глазом, под бинокуляром или под микроскопом. Чаще применяют простейшие качественные химические реакции, во время которых простым глазом или под бинокуляром наблюдают характер растворения минералов и образование характерных окрашенных растворов и осадков. Значительно реже приходится прибегать к более сложным микрокристаллоскопическим реакциям с получением осадков солей в хорошо образованных кристаллах. При помощи этих реакций определяют под микроскопом: цвет и оптические константы — изотропность или анизотропность, плеохроизм, угасание, показатели преломления, двупреломление и оптический знак, а также размер и форму кристаллов, и характер двойников.
Растворение минералов или их сплавов производят в часовых стеклах или в фарфоровых чашечках. Сплавление не растворимых в кислотах минералов производят на платиновой проволочке, ложечке или в маленьких платиновых чашечках (диаметром около 10 мм) перед пламенем спиртовки при помощи паяльной трубки.
Чтобы наблюдать характер растворения минералов, чаще применяют концентрированные минеральные кислоты (соляную и азотную), в которых быстрее происходит растворение или разложение минералов (в некоторых случаях трудно уловимое даже под бинокуляром)[4]. Растворение минералов может происходить спокойно или с выделением газовых пузырьков, т. е. может быть медленным или бурным с шипением или вскипанием. С выделением газовых пузырьков растворяются карбонаты. С шипением растворяются в соляной кислоте кальцит и базобисмугит, мелкие зерна которых при этом быстро двигаются в капле реактива.
При растворении минералов наблюдают также характер окраски раствора. Растворы различают бесцветные и окрашенные. Окрашенные растворы получаются при растворении минералов, содержащих красящие элементы (железо, марганец, медь, хром, никель, кобальт, ванадий). Кроме того, иногда при растворении минералов выпадают осадки. В этом отношении примером могут служить свинцовые минералы (вульфенит, ванадинит, пироморфит) и медный минерал куприт.
Обычно осадки выпадают при взаимодействии кислотных растворов вещества минералов с растворами минеральных солей или при непосредственном прибавлении к первым кристалликов солей. Осадки различают кристаллические и аморфные. Преобладают первые. Кроме того, осадки различают по цвету: белые и окрашенные. Окрашенные осадки и растворы наблюдают при растворении минералов, содержащих красящие элементы. Характер осадков лучше наблюдать под бинокуляром. Кристаллы солей, которые образуются при микрокристаллоскопических реакциях, нужно наблюдать под микроскопом, на предметных стеклах, что требует большей затраты времени. Эти реакции применяются значительно реже.
Во многих случаях раствор, полученный после растворения минерала или его сплава, требуется отфильтровать по способу Геммеса, который заключается в следующем: на часовое стекло, выше уровня жидкости, помещают вчетверо сложенный кусочек фильтровальной бумаги, один конец которой погружают в раствор, и бумага начинает всасывать раствор; устанавливают вертикально к бумаге и плотно прижимают к ней капиллярную трубочку или пипетку, в которую затягивают раствор осторожным вытягиванием из трубочки воздуха при помощи губ. Каплю чистого раствора капилляром переносят на чистое предметное стекло, и к ней прибавляют требуемый реактив для получения кристаллов солей.
Особо следует остановиться на методике получения пленочных реакций на минеральных зернах. Пленочные реакции применяют как для определения отдельных минеральных зерен, так и для количественной оценки содержания тех или иных минералов в шлихах и рудных концентратах. Различные виды пленочных реакций зависят от характера определяемого минерала и употребляемых при этом реактивов. Наиболее часто применяются следующие пленочные реакции: а) реакции восстановления при помощи цинковой пластинки или цинковой пыли; б) реакции, при которых на зернах образуются окрашенные пленки.
а) При помощи цинковой пластинки получают металлические
пленки на зернах касситерита и ряда свинцовых минералов из
зоны окисления: на зернах касситерита при этом образуется оловянная пленка; на свинцовых минералах, как церуссит, вульфенит, ванадинит и пироморфит — пленка металлического свинца. Ход этих реакций следующий. На цинковую пластинку помещают
каплю концентрированной соляной кислоты и в эту каплю погружают испытуемое минеральное зерно. Цинк растворяется в соляной кислоте с выделением водорода и образованием раствора хлористого цинка. Освобождающийся водород действует восстанавливающим образом на касситерит и указанные выше минералы свинца, на которых появляется соответствующая металлическая пленка.
При количественной оценке пробы на пластинку высыпают общую массу зерен и заливают соляной кислотой. Покрывшиеся пленкой зерна подсчитывают или отбирают под бинокуляром. В первом случае получают содержание полезного минерала в объемных процентах, а во втором, после взвешивания отобранного материала — в весовых процентах. Выделение зерен полезного минерала обычно производят для классов крупнее 0,5 мм, а подсчет — для классов мельче 0,5 мм.
б) Характерные окрашенные пленки получаются на минеральных зернах при обработке их кислотами, щелочами и растворами различных солей.
В результате действия соляной кислоты при комнатной температуре на минералах свинца (вульфените, пироморфите, чиллагите и др.) образуется белая пленка хлористого свинца. Этой реакцией пользуются как при определении отдельных зерен, помещая их на предметном стекле в каплю соляной кислоты, так ц при количественной оценке шлиха или рудного концентрата, помещая пробу на часовом стекле и заливая кислотой,
На антимоните в КОН появляется на холоду характерная оранжевая пленка.
При погружении минерала свинца (англезита, церуссита. вульфенита, ванадинпта, пироморфита, крокоита н др.) в водный раствор подпетого калия (5%), на нем получается окрашенная пленка. При этом реакция англезита с раствором йодистого калия происходит на холоду с образованием золотисто-желтой пленки двуиодистого свинца. Церуссит, вульфенит, ванадинит и пироморфит подвергают предварительной обработке на холоду серной кислотой (1 : 1), чтобы 'получить на них пленку сульфата свинца: в водном растворе йодистого калия последняя, как и англезит, образует золотисто-желтую пленку двуиодистого свинца. Крокоит является еще более устойчивым минералом: чтобы получить на нем пленку сульфата свинца, его несколько минут кипятят в разведенной серной кислоте (1 : 10), а затем уже на него действуют раствором йодистого калия.
Для получения подобных же пленок на сульфидах свинца берут насыщенный раствор иода в 5%-ном растворе йодистого калия: при кипячении в этом растворе галенита, буланжерита, а также и металлического свинца на них образуется желтовато-зеленая пленка.
При обработке на холоду раствором подпетого калия (5%) в серной кислоте (1:10) минералы висмута (базобисмутит, бисмит, бисмутит и др.) окрашиваются в черно-бурый цвет с образованием пленки йодистого висмута; последняя обесцвечивается при действии аммиака. Хинин (или цинхоиин) образует на базобисмутите пленку оранжевого цвета.
На шеелите при кипячении его в концентрированной соляной кислоте с металлическим оловом получается синяя пленка.
Минералы молибдена (вульфенит, чиллагит, молибдит и др.) при кипячении в соляной кислоте с оловом образуют зеленовато-синюю пленку, но большая растворимость делает эту пленку неустойчивой и она быстро исчезает. При кипячении в насыщенном растворе фенилгидразина в разведенной серной кислоте (1:10) вульфенит получает синевато-серую окраску. Повеллит и молибдит, находясь в этом реактиве на холоду в течение 5 —10 мин., приобретают чистую синюю окраску.
Минералы ванадия (ванадинит, деклуазнт и др.) в солянокислом растворе солянокислого анилина образуют черную пленку, При кипячении танталита и колумбита в фарфоровом тигле с крепкой серной кислотой до появления белых паров, на поверхности этих минералов получается сетчатая пленка Ta2O5 и Nb2O5 белесого или желтовато-белого цвета. Образование сетчатой пленки происходит в этом случае по двум системам трещин спайности, пересекающимся под прямым углом. Ильменит при таких же условиях приобретает тонко-шероховатую поверхность равномерно серой с фиолетовым оттенком окраски.
На зернах вольфрамита и молибденита при обработке их смесью хлористого кальция и хлористого натрия могут быть получены соответственно пленки СаWО4 и СаМоО4. Эту смесь расплавляют в фарфоровом тигле на пламени газовой горелки, и помещают в нее испытуемые зерна вольфрамита или молибденита на 5—10 мин. Прекратив нагревание, сплав выщелачивают водой для удаления хлористых соединений. Полученная на вольфрамите пленка СаWO4 в катодных лучах дает яркое голубое свечение, пленка же СаМоО4, полученная на молибдените, в катодных лучах дает желтоватое или зеленовато-желтое свечение.
Кроме химических испытаний на свободных минеральных зернах производят поверочные реакции в полированных цементных шлифах. При этом выявляется характер травления минеральных зерен общепринятыми с минераграфических исследованиях реактивами. Нередко производят также микрохимические реакции непосредственно на шлифе.
Ниже приводится описание микрохимических реакций, главным образом для металлов и значительно меньше для металлоидов.
Элементы, для которых приводятся реакции, расположены в алфавитном порядке.
Алюминий
Алюминий принадлежит к числу широко распространенных элементов. Обычно он встречается в форме силикатов, которые не растворимы в кислотах и щелочах. К нерастворимым силикатам относятся полевые шпаты, слюды, пироксены, роговые обманки, топаз, гранаты и водные алюмосиликаты. Нерастворимы и собственно алюминиевые минералы — шпинели и корунд. К легко растворимым минералам алюминия относится алунит. Чистые соединения алюминия (без марганца и железа) бесцветны или имеют белый цвет. Наиболее употребительная реакция на алюминий производится сухим путем.
а) Сухая реакция. При нагревании порошка алюминнйсодержащего минерала с содой на угле или платиновой проволоке образуетсябелая неплавкая окись алюминия, которая,при смачивании раствором азотнокислого кобальта, переходит в синюю неплавкую массу (тенарова синь).
 б) Осаждение аммиаком. В растворимое состояние алюминий содержащие минералы обычно переводятся путем сплавления с кислым сернокислым калием. Полученный сплав содержит алюминий в виде сернокислого алюминия Аl2(SО4)3, растворимого в воде. Поэтому, обработав сплав водой и прибавив аммиака, получают белый, слегка сероватый аморфный осадок гидроокисиалюминия Аl(ОН)3, растворимый в соляной кислоте.
б) Осаждение аммиаком. В растворимое состояние алюминий содержащие минералы обычно переводятся путем сплавления с кислым сернокислым калием. Полученный сплав содержит алюминий в виде сернокислого алюминия Аl2(SО4)3, растворимого в воде. Поэтому, обработав сплав водой и прибавив аммиака, получают белый, слегка сероватый аморфный осадок гидроокисиалюминия Аl(ОН)3, растворимый в соляной кислоте.
в) Получение кристаллов (NН4)3АlF6. Фтористый аммоний,
прибавленный к капле раствора солей алюминия, осаждает
мельчайшие бесцветные прозрачные хорошо образованные октаэдры, наблюдаемые под микроскопом (рис. 11).
Барий
Важнейшим бариевым минералом является барит ВаSО4. Который в кислотах и щелочах не растворим. В растворимое состояние барий переводят путем сплавления с содой, выщелачивания сплава в воде для удаления ионов SО42- и растворения остатка в соляной кислоте.
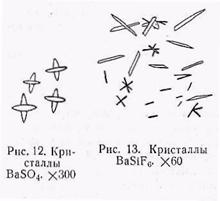
а) Осаждение Ва§О4. Из растворов барий легко осаждается серной кислотой. К капле раствора бария прибавляют каплю серной кислоты и получают обильный тонкокристаллический осадок сернокислого бария, не растворимый - в кислотах (рис. 12).
 б) Окрашивание пламени. Солянокислый раствор бария при прокаливании на платиновой проволочке окрашивает пламя в желто-зеленый цвет.
б) Окрашивание пламени. Солянокислый раствор бария при прокаливании на платиновой проволочке окрашивает пламя в желто-зеленый цвет.
в) Получение кристаллов ВаSiF6. Этой реакцией можно пользоваться в присутствии стронции и кальция. К слабо кислому раствору бариевого минерала прибавляют кремнефтористоводородного аммония. При этом образуются кристаллы кремнефторнстоводородного бария, представляющие собой хорошо образованные палочки (рис. 13), частично скошенные на конце, с прямым угасанием и слабым двупреломлением. Реакцию следует вести со слабо нагретым раствором.
Бериллий
а) Осаждение углекислым аммонием. Из бериллийсодержащих минералов наиболее важным является берилл Ве3А12(SiO3)6, не растворимый в кислотах. Силикаты бериллия предварительно сплавляют с содой и обрабатывают соляной кислотой. Из растворов бериллий осаждается углекислым аммонием; выпадает белый осадок, легко растворяющийся в избытке реактива (в отличие от глинозема).
б) Реакция с хинализарином. Осадок гидрата окиси бериллия, полученный осаждением аммиаком, обрабатывают теплым раствором NaOH. К фильтрату прибавляют несколько капель щелочного раствора хинализарина. Даже при небольшом количестве бериллия фиолетовая окраска хинализарина переходит в васильково-сннюю. Реакция очень чувствительная и характерная, нолишь при отсутствии магния, циркония, тория, неодима, празеодима, церия и лантана. Алюминий не мешает.
в) Сухая реакция. Минералы бериллия, смоченные раствором азотнокислого кобальта, при прокаливании на угле или на платиновой проволочке с содой дают серую массу.
Ванадий
Из ванадиевых минералов наиболее часто встречается ванадинит Рb5(VО4)3С1, хорошо растворимый в соляной кислоте с окрашиванием раствора в красновато-бурый цвет.
 а) Получение надванадиевой кислоты. Прибавляя к солянокислому раствору перекись водорода, получают надванадиевую кислоту НVО4, которая окрашивает раствор в розоватый цвет (цвет портвейна). При выпаривании солянокислого раствора ванадиевого минерала образуется сухой остаток зеленого цвета. Ванадимит также хорошо растворим в азотной кислоте. Многие другие ванадиевые соединения тоже растворимы в кислотах, но их раствор имеет желтый цвет. Сернистые соединения ванадия растворимы в (NH4)2SO4. Нерастворимые соединения ванадия лучше сплавляются с. перекисью натрия.
а) Получение надванадиевой кислоты. Прибавляя к солянокислому раствору перекись водорода, получают надванадиевую кислоту НVО4, которая окрашивает раствор в розоватый цвет (цвет портвейна). При выпаривании солянокислого раствора ванадиевого минерала образуется сухой остаток зеленого цвета. Ванадимит также хорошо растворим в азотной кислоте. Многие другие ванадиевые соединения тоже растворимы в кислотах, но их раствор имеет желтый цвет. Сернистые соединения ванадия растворимы в (NH4)2SO4. Нерастворимые соединения ванадия лучше сплавляются с. перекисью натрия.
б) Сплавление с пиросульфатом калия. При сплавлении соединений ванадия с пиросульфатом калия получают желто-красный сплав, растворимый в воде, с окрашиванием раствора в зеленоватый цвет, переходящий после прибавления карбоната натрия в более интенсивный зеленый.
в) Образование кристаллов ванадиевскислого аммония NH4VO3. Минералы сплавляют с перекисью натрия Na2O2 на платиновой проволоке, а затем сплав выщелачивают водой на часовом стекле и отфильтровывают по методу Геммеса. К раствору прибавляют твердый NН4С1, после чего выпадают кристаллы метаванадата аммония в виде чечевицы с сильным двупреломлением и косым угасанием (рис. 14).
Висмут
Висмут встречается большей частью в виде висмутового блеска, самородного висмута и базобисмутита, растворимых в кислотах. Особенно бурно растворяются (со вскипанием) самородный висмут и базобисмутит в азотной кислоте. Растворы висмутовых соединений бесцветны.
а) Получение хлорокиси висмута. Прибавляя воду к солянокислому раствору висмутовых соединений, получают белый осадок хлорокиси висмута, растворимой в разбавленной соляной кис юте.

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 |




