В стандартных условиях культивирования, в клеточной модели НВЕ in vitro, одновременно с уменьшением экспрессии Cx43 происходит статистически значимое снижение экспрессии CD38 и SLC1A5 на нейронах, CD38, SLC1A5 и EAAT2 на астроцитах и CD38 на эндотелиоцитах. Уменьшение CD38 может быть связано со снижением доступности субстратов (НАД+, АТФ), которые доставляются из клеток в клетки или во внеклеточное пространство посредством коннексинов. С учетом полученных результатов и данных литературы, логично предположить, что при этом наблюдается уменьшение накопления внутриклеточного кальция, снижение потери клетками НАД+, снижение активности NMDA-каналов, уменьшение секреции нейронами глутамата во внеклеточное пространство. А уменьшение концентрации глутамата во внеклеточном пространстве, приводит к уменьшению транспортеров глутамата (EAAT2) на астроцитах. Вследствие снижения поступления субстрата для глутаминсинтетазы, ее активность в астроцитах уменьшается, происходит уменьшение биосинтеза глутамина из глутамата, который в нормальных условиях поступает в нейроны (Lehmann С. et al., 2009). Уменьшение секреции астроцитами глутамина вызывает уменьшение экспрессии транспортеров глутамина (SLC1A5) на нейронах и астроцитах.
Блокирование коннексина-43 на клетках НВЕ проявляется в снижении экспрессии Cx43 и CD38 на всех клетках НВЕ, транспортера глутамина на нейронах, транспортера глутамата на астроцитах, а также усилении экспрессии Рgp на эндотелиоцитах, культивируемых в условиях нормоксии. В условиях гипоксии под действием блокатора Cx43 регистрируется угнетение экспрессии Сх43 и CD38, отсутствует увеличение экспрессии глутаминовых и глутаматных транспортеров, характерное для астроцитов.
В свете выявленных в ходе исследования изменений и механизмов межклеточных коммуникаций и энергетического сопряжения нейроваскулярной единицы огромное значение имеет возможность того, что транспортеры глутамата и глутамина могут быть терапевтической мишенью на различных этапах клинического течения перинатального ГИП.
Основываясь на особенностях функционирования НВЕ и результатах, полученных в ходе выполнения исследования, разработана следующая схема реализации механизмов межклеточной коммуникации и метаболического сопряжения в НВЕ при ГИП. В физиологических условиях нейрон-глиальный показатель, характеризующий число астроцитов, функционально связанных с одним нейроном, равен 1:2-1:3. В условиях недостаточности кислорода и субстратов происходит изменение соотношения нейронов и астроцитов, развивается астроглиоз, а часть астроцитов обеспечивают репаративный нейрогенез. Для этого в астроцитах увеличивается экспрессия СD38 и Cx43 (обеспечение транспорта и метаболизма НАД+, утилизация НАД+, высвобождающегося из разрушенных клеток, обеспечение функционирования астроглиального синцития, контроль пуринергических механизмов регуляции активности клеток), SLC1A5 и EAAT2 (регуляция обмена глутамина и глутамата, ограничение эксайтотоксичности, обеспечение метаболических потребностей активно пролиферирующих клеток). Одновременно с этим в нейронах изменяется экспрессия СD38, SLC1A5, Pgp, а клетки эндотелия отвечают изменением экспрессии Сх43 и P-гликопротеина. Такие скоординированные процессы определяют степень повреждения и восстановления клеток НВЕ, что можно зарегистрировать по изменению уровней нейрон-, астроцит - и эндотелиоцит-специфических белков-маркеров в периферической крови. Кроме того, выраженность изменений в клетках НВЕ влияет на характер повреждения мозговых структур и состояние ликвородинамики. Но при длительном воздействии гипоксии-ишемии происходит вынужденная гибель нейронов вследствие истощения компенсаторных возможностей, что, в целом, может быть приспособительной реакцией ГМ при гипоксическом воздействии, так как имеются указания о возможности астроцитов трансформироваться в нейроны или выполнять их функции (Gonzalo-Gobernado R. et al., 2013). Основываясь на полученных в ходе исследования результатов, представлена предполагаемая схема, характеризующая взаимосвязь полученных клинических и экспериментальных данных, при перинатальном ГИП ЦНС (рисунок 3).
Можно предположить участие следующего механизма в регуляции ответа клеток НВЕ на гипоксическое повреждение: гипоксия активирует астроциты за счет высвобождения глутамата из нейронов и инициирует многократное увеличение экспрессии Cx43 и функционально сопряженной молекулы CD38 на поверхности клеток астроглиальной природы, что обеспечивает быстрый транспорт НАД+ во внеклеточное пространство коннексинами, где он становится субстратным лигандом для CD38. Метаболическая конверсия НАД+ посредством функционирования НАД+-гликогидролазы/CD38 приводит к истощению уровня этого кофермента в клетках и тормозит процессы гликолиза, обеспечивающего энергетические потребности астроцитов.
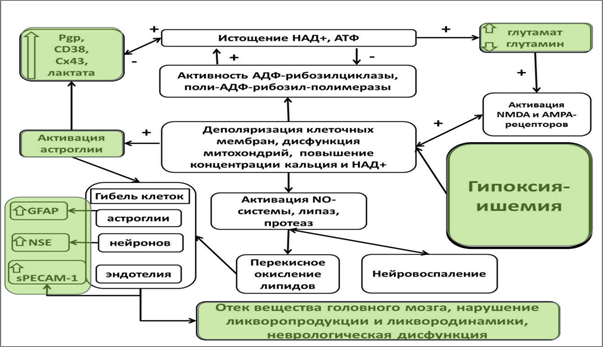
Рисунок - 3 Молекулярно-клеточные изменения при гипоксически-ишемическом поражении ЦНС («+» - стимулирующее влияние, «-» - ингибирующее влияние), цветом выделены собственные исследования
Снижение уровня НАД+ в астроцитах может приводить к уменьшению ферментативной конверсии глутамата в альфа-кетоглутарат и глутамин, что одновременно является следствием снижения захвата глутамата астроцитами. В таком случае, обнаруженное подавление экспрессии транспортера глутамата EAAT2 в астроцитах на фоне значительного увеличения экспрессии транспортера глутамина SLC1A5 приводит к преобладанию выведения (эффлюкса) глутамина над захватом глутамата из внеклеточного пространства астроцитами. Параллельное увеличение экспрессии транспортера глутамина SLC1A5 в нейронах, контактирующих в астроцитами в пределах НВЕ, вероятно, отражает стимуляцию процессов захвата глутамина и синтеза глутамата, а также гамма-аминомасляной кислоты в нейронах, поврежденных гипоксией, что усугубляет нарушения глутамат-глутаминового обмена между нейронами и астроцитами. В таком случае, зафиксированное при гипоксии подавление экспрессии CD38 на фоне не измененной экспрессии Cx43 в нейронах отражает, вероятнее всего, снижение уровня НАД+ во внеклеточном пространстве вследствие усиленной экспрессии CD38 астроцитами. Так как в физиологических условиях транспорт глутамата из нейронов в астроциты сопряжен с увеличением в астроцитах концентрации НАДН и активацией гликолиза за счет увеличения активности глутаматдегидрогеназы, конвертирующей НАД+-зависимым способом глутамат в альфа-кетоглутарат, нарушение этого механизма в нейрон-астроглиальном метаболическом сопряжении при гипоксии дополнительно подавляет гликолитическую продукцию АТФ в астроцитах и усугубляет энергетическую недостаточность клеток.
Таким образом, полученные в ходе клинического и экспериментального исследования результаты позволяют сформулировать принципиально новые представления о механизмах повреждения клеток ЦНС, связанных с изменениями активности и экспрессией CD38, Cx43, транспортных систем, нарушением метаболизма НАД+ в клетках НВЕ, а также о вкладе повреждения клеток нейрональной и глиальной природы в указанные события в физиологических условиях и при гипоксически-ишемическом воздействии. Эти результаты должны быть учтены при разработке протоколов доклинического тестирования препаратов с нейротропной активностью при оценке их транспорта через ГЭБ, а также при разработке подходов к направленной регуляции проницаемости ГЭБ для достижения фармакотерапевтического эффекта при перинатальном ГИП ЦНС.
ВЫВОДЫ
1. К наиболее значимым особенностям антенатального анамнеза, причастным к формированию перинатального поражения мозга гипоксического генеза, отнесены анемический синдром во время беременности и хроническая фетоплацентарная недостаточность, которые являются управляемыми факторами развития внутриутробной гипоксии; в раннем неонатальном периоде прогностически наиболее неблагоприятными клиническими проявлениями поражения ЦНС следует считать мышечную гипотонию, гипо - и арефлексию, а также нарушение сознания и судороги.
2. По данным нейросонографического исследования, при ЦИ 2 и 3 степени значимыми структурными изменениями ЦНС являются умеренно-выраженные отечные изменения в корковых, подкорковых структурах и перивентрикулярных отделах; при этом ЦИ 3 степени характеризуется увеличением доли пациентов с расширением размеров боковых и IV желудочков и сужением субарахноидального пространства с выраженным отеком коры и ПВП в раннем неонатальном периоде, а также нарастанием числа новорожденных, имеющих выраженные отечные изменения корковых структур, в позднем неонатальном периоде.
3. Гипоксически-ишемическое поражение ЦНС новорожденных разной степени тяжести характеризуется разнонаправленными изменениями уровней маркеров повреждения клеток нейрональной, астроглиальной природы и эндотелиальной дисфункции: наиболее высокие концентрации NSE, sPECAM-1 и глутамата в сыворотке крови зарегистрированы у детей с ЦИ 3 степени, а также на фоне выраженной неврологической симптоматики (нарушения сознания, судорожный синдром, арефлексия, гипорефлексия, нарушения мышечного тонуса) и значительных структурных изменениях ЦНС (расширение ликворной системы, выраженный отек коры головного мозга); повышение GFAP сопутствует ЦИ любой степени тяжести с максимально высокими концентрациями на фоне тяжелых неврологических нарушений (нарушение сознания, судорожный синдром, необходимость ИВЛ) и сочетается с уменьшением размеров ликворной системы и выраженным отеком головного мозга.
4. Гипоксическое поражение ЦНС у новорожденных сопровождается повреждением клеток нейроваскулярной единицы с резким увеличением концентрации нейроспецифических белков (NSE, GFAP), sPECAM-1 и глутамата в периферической крови, которые обусловливают клинические особенности патологии (необходимость ИВЛ, наличие судорог, нарушения сознания, нейро-мышечные расстройства) и отражают последующие структурные изменения головного мозга; отеку головного мозга сопутствует увеличение содержания в сыворотке крови всех изучаемых маркеров повреждения НВЕ (r=0,5-0,95), расширение ликворопроводящих путей сопровождается преимущественным увеличением уровней нейронспецифической енолазы (r=0,53-0,82), sPECAM-1 (r=0,5-0,95) и глутамата (r=0,75-0,95), а сужение желудочковой системы коррелирует с повышением уровня глиального фибриллярного кислого белка (r=0,5-0,68).
5. В динамике раннего постнатального периода относительное количество астроцитов, экспрессирующих НАД+-гликогидролазу/CD38, но не Cx43, прогрессивно уменьшается. У экспериментальных животных в течение 72 часов после перенесенного перинатального гипоксически-ишемического повреждения головного мозга происходит изменение экспрессии CD38 и Cx43, в основном, в клетках астроглиальной природы, что характеризует процессы активации астроцитов, изменение метаболизма НАД+, аналогичные изменения характерны для эффектов острой гипоксии в оригинальной модели НВЕ in vitro. Блокирование функции Cx43 in vitro проявляется в снижении экспрессии Сх43 и CD38 на всех клетках НВЕ, транспортера глутамина на нейронах, транспортера глутамата на астроцитах в физиологических условиях, а в условиях гипоксии вызывает угнетение экспрессии Сх43 и CD38 и предотвращает увеличение глутаминовых и глутаматных транспортеров при гипоксии, что приводит разобщению межклеточной коммуникации и метаболического сопряжения клеток НВЕ.
6. Астроциты НВЕ характеризуются высоким уровнем экспрессии Cx43 и транспортеров глутамата EAAT2 на фоне низкого уровня экспрессии НАД+-гликогидролазы/CD38 и транспортера глутамина SLC1A5; пребывание в условиях гипоксии индуцирует в астроцитах НВЕ значительное увеличение экспрессии Cx43, CD38, SLC1A5 в 2-15 раз, но снижение экспрессии EAAT2 в 1,5 раза; нейроны, входящие в состав клеточной модели НВЕ in vitro, демонстрируют высокий уровень экспрессии CD38, но низкий уровень экспрессии Cx43 и SLC1A5; пребывание в условиях гипоксии индуцирует в нейронах НВЕ уменьшение экспрессии CD38 в 15 раз и увеличение экспрессии SLC1A5 в пять раз; эндотелиоциты НВЕ характеризуются стабильным уровнем экспрессии Cx43, который практически не меняется при действии гипоксии in vitro; подавление активности Cx43 карбеноксолоном взывает снижение экспрессии CD38, Cx43, SLC1A5 в нейронах, контактирующих с астроцитами, а также снижение экспрессии CD38, Cx43 и EAAT2 в астроцитах НВЕ.
7. Изменения, наблюдаемые при перинатальном гипоксически-ишемическом повреждении в клетках нейроваскулярной единицы головного мозга, свидетельствуют о нарушении межклеточных взаимодействий, сопровождаются изменением структурной и функциональной целостности ГЭБ и появлением в крови нейроспецифичных белков (NSE, GFAP), sPECAM-1 и повышением уровня глутамата. Вызванные гипоксией изменения экспрессии CD38, Cx43, Pgp, SLC1А5 в клетках НВЕ определяют характер нарушения механизмов нейрон-астроглиального метаболического сопряжения, структурно-функциональной целостности ГЭБ, повреждения клеток и реактивного астроглиоза в развивающемся головном мозге.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. Изменения маркеров повреждения нейронов и астроцитов в сыворотке периферической крови новорожденных детей рекомендуется применять в качестве дополнительного диагностического критерий для верификации гипоксически-ишемического поражения ЦНС, а также определения степени тяжести.
2. Определение уровня sPECAM-1 в сыворотке периферической крови новорожденных детей предлагается использовать как прогностический показатель развития тяжелого состояния (выраженного отека головного мозга, нарушений сознания, судорог, гипертонуса, гипорефлексии, расширения ликворной системы).
3. Направленная модуляция экспрессии и активности Р-гликопротеина может быть рекомендована для управляемой нейропротекции и доставки лекарственных веществ в очаг поражения.
4. Направленная модуляция экспрессии и активности Сх43 может быть полезна для разработки новой стратегии терапии перинатального гипоксически-ишемического поражения ЦНС.
5. Транспортные молекулы нейронов, астроцитов и эндотелиоцитов участвуют в механизмах развития гипоксического повреждения НВЕ и могут рассматриваться в качестве молекул-мишеней для фармакологической коррекции перинатального гипоксически-ишемического поражения головного мозга.
Список основных работ, опубликованных по теме диссертации
Статьи в журналах, рекомендованных ВАК на соискание ученой степени доктора наук
1. Проницаемость гематоэнцефалического барьера в норме, при нарушении развития головного мозга и нейродегенерации / , , // Журнал неврологии и психиатрии им. C. C. КорсаковаТ. 113, № 4. - С. 80-85.
2. Межклеточные взаимодействия в развивающемся гематоэнцефалическом барьере / , , // Педиатрия. Журнал им. Т. 92, № 2. - С. 155-159.
3. Маркеры апоптоза и нейроспецифические белки в диагностике перинатальных поражений центральной нервной системы у новорожденных детей / , , // Сибирское медицинское обозрение.- 2013.- № 3.- С.3-10.
4. Современные представления о патогенезе перинатального ишемического повреждения клеток нейроваскулярной единицы головного мозга: молекулы-мишени для нейропротекции / , , // Вестник РАМН№ 12. - С. 26-35.
5. Молекулярные механизмы нарушения развития мозга в пре - и неонатальном периоде / , , , // Вопросы современной педиатрииТ. 11, № 6. - С. 15-20.
6. НАД+-конвертирующие ферменты в клетках нейрональной и глиальной природы: CD38 как новая молекула-мишень для нейропротекции / , , // Вестник РАМН№ 10. - С. 29-37.
7. Моргун, функции гематоэнцефалического барьера / // Сибирский медицинский журнал (г. Иркутск)Т. 109, № 2. - С. 5-8.
8. Модели гематоэнцефалического барьера in vitro: современное состояние проблемы и перспективы / , , // Анналы клинической и экспериментальной неврологииТ. 6, № 4. - С. 42-50.
9. Клинико-метаболические особенности церебральной ишемии у доношенных новорожденных с анемией / , , // Педиатрия. Журнал им. Т. 90, № 1. - С. 23-29.
10. Перинатальное гипоксически-ишемическое поражение головного мозга вызывает нарушение глутаматергической сигнальной трансдукции, сопряженной с активностью АДФ-рибозилциклазы в нейронах / , , , // Бюллетень экспериментальной биологии и медициныТ. 150, № 11. - С. 512-516.
11. Уровни белков нейрональной и глиальной природы в крови новорожденных при церебральной ишемии / , , // Педиатрия. Журнал им. Т. 89, № 1. - С. 25-30.
12. Изменение экспрессии и активности CD38 в клетках астроглиальной природы при нарушениях нейрон-глиальных взаимодействий при перинатальном гипоксически-ишемическом поражении головного мозга / , , // НейрохимияТ. 26, № 3. - С. 237-244.
13. НАД+-зависимые механизмы нарушения жизнеспособности клеток головного мозга в остром периоде гипоксически-ишемического перинатального поражения / , , // НейрохимияТ. 25, № 3. - С. 247-254.
14. Перинатальное гипоксически-ишемическое поражение центральной нервной системы вызывает изменение экспрессии коннексина 43, CD38 и активности АДФ-рибозилциклазы в клетках головного мозга / , , // Бюллетень экспериментальной биологии и медициныТ. 146, № 12. - С. 641-645.
15. Маркеры повреждения нейронов и астроцитов в плазме крови новорожденных при церебральной ишемии разной степени тяжести / , , // Сибирское медицинское обозрениеТ. 50, № 2. - С. 27-31.
16. Профилактика постишемического неврологического дефицита путем модуляции экспрессии АДФ-рибозилциклазы в клетках головного мозга (экспериментальное исследование) / , , , // Общая реаниматологияТ. 3, № 5-6. - С. 109-113.
17. Развитие апоптоза и изменение активности АДФ-рибозилциклазы при ишемическом повреждении головного мозга / , , , // Сибирское медицинское обозрениеТ. 41, № 4. - С. 22-27.
Патент

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 |




