В то же время в контрольной группе наблюдалась умеренная неврологическая симптоматика - 2,5±0,5 баллов. В дальнейшем отмечалось улучшение неврологического статуса у животных опытной группы и на 10 сутки после ГИП (Р17) сумма баллов по шкале NSS составила 5,6±0,5 (умеренное повреждение) против 1,2±0,2 баллов в контрольной группе и была статистически значимо выше (р=0,001).
Особенности экспрессии CD38 в клетках головного мозга экспериментальных животных
Экспрессия CD38 регистрировалась равномерно по всей цитоплазме, а также перинуклеарно (рисунок 1). Установлено, что на фоне ГИП ЦНС изменяется экспрессия CD38 в клетках головного мозга.
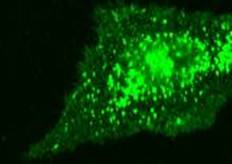
Рисунок - 1 Внутриклеточная локализация антигена CD38 в клетках НВЕ (астроцит) у животных с моделью перинатального гипоксически-ишемического поражения х1000
Изменения носят динамический характер. В контрольной группе количество CD38+ клеток практически не меняется и остается достаточно стабильным в течение 17 суток постнатального развития и равен 4-5,3% (4,7±0,7%) у 10-ти суточных животных. Статистически значимое снижение зафиксировано лишь в возрасте 28 суток - 2±0,7%.
При перинатальном ГИП ЦНС происходит волнообразное изменение экспрессии CD38 в клетках НВЕ (таблица 9). Через 4 часа экспрессия CD38 уменьшается, а через 8 часов усиливается, превышая контрольные показатели. Постепенное усиление экспрессии происходит до 72 часов после поражения (Р10), после чего отмечается постепенное снижение показателя экспрессии и нормализация к 10 суткам с момента ГИП (Р17). В клеточной модели НВЕ in vitro, как и в исследовании in vivo, при гипоксии происходит увеличение экспрессии CD38 на астроцитах (в 15 раз), с одновременным снижением экспрессии СD38 на нейронах (в 15 раз) (таблица 11).
Для определения клеток, которые обеспечивают усиление экспрессии CD38 при перинатальном ГИП изучены динамические изменения экспрессии GFAP, а также соэкспрессия CD38 и GFAP при ГИП (таблица 9). У интактных животных экспрессия GFAP практически не изменилась с ростом и развитием животных, оставаясь в пределах 5,3-7,8%. Наибольшая, однако статистически не отличающаяся от других подгрупп, экспрессия CD38 характерна для 10 суток постнатального развития. При этом наблюдается стойкое динамическое снижение соэкспрессии GFAP и СD38. И с 17 суток постнатального развития экспрессия CD38 на астроцитах статистически ниже, чем в предыдущие возрастные периоды. Таким образом, в динамике раннего постнатального периода относительное количество астроцитов, экспрессирующих НАД+-гликогидролазу/CD38, прогрессивно уменьшается.
Иная картина характерна для опытной группы. Произошло постепенное увеличение экспрессии GFAP через 8 часов после гипоксии-ишемии, с максимальным показателем через 72 часа (Р,8±1,9%, с последующим постепенным снижением и достижением контрольных показателей к 28 дню постнатального развития (5,8±0,9%). Наряду с этим, после перенесенного перинатального ГИП произошло усиление экспрессии CD38 на астроцитах, по сравнению с контролем (таблица 9). Во всех подгруппах опытных животных, начиная с 4 часов (Р7`) после поражения, количество клеток, экспрессирующих GFAP и CD38, увеличивается, достигая максимума на 10 сутки после ГИП, постепенно уменьшаясь к 28 суткам постнатального развития, оставаясь выше контрольных значений (p<0,05).
Итак, после перенесенного ГИП ЦНС развивается астроглиоз и подавляющее количество астроцитов НВЕ экспрессирует НАД+-гликогидролазу/CD38. Во всех подгруппах опытных животных, начиная с 4 часов после поражения, соэкспрессия GFAP/CD38 статистически значимо повышается, достигая максимума на 10 сутки после ГИП. С 28 суток постнатального развития соэкспрессия GFAP/CD38 уменьшается, но остается выше контрольных значений в 2,5 раза (р<0,05).
Таким образом, при перинатальном ГИП ЦНС у животных, происходят разнонаправленные изменения экспрессии CD38: в первые часы - снижение с последующим увеличением экспрессии к 72 часам после поражения и нормализацией к 10 суткам. Отмечается уменьшение NSE+-нейронов, экспрессирующих CD38, с одновременным увеличением количества GFAP+-астроцитов (вероятно, вследствие реактивного астроглиоза или интенсификации процесса нейрогенеза), экспрессирующих исследуемый маркер. К 28 дню постнатального развития количество астроцитов уменьшается, но по-прежнему остается высоким количество клеток астроглиальной природы, экспрессирующих CD38.
Экспрессия коннексина-43 в клетках НВЕ экспериментальных животных
Для определения роли Cx43 в патогенезе перинатального ГИП проведено определение соэкспрессии CD38 и Cx43 в клетках НВЕ (таблица 9). При определении доли клеток, экспрессирующих Сх43 в опытной и контрольной группах, установлено, что в первые 4-8 часов разница между группами отсутствует. Увеличение доли Сх43+-клеток отмечается с 3 суток эксперимента (Р10), с продолжающимся увеличением к 10 суткам (Р17) до 15±1,2%, что в 1,7 раза больше показателей контрольной группы. К 28 суткам жизни содержание клеток экспрессирующих Сх43 начинает снижаться, оставаясь значительно более высоким, чем в контрольной (р<0,05). При анализе соэкспрессии Cx43 и CD38 установлено, что у животных различного возраста обе молекулы экспрессируются одинаково часто в обеих группах.
Для определения клеток, которые экспрессируют коннексин-43, проведена регистрация соэкспрессии Cx43 с маркером астроцитов (GFAP) и эндотелиоцитов (CD31) (таблица 9). Усиление экспрессии Сх43 после перенесенного повреждения происходит за счет астроцитов, так как количество Сx43/GFAP-иммунопозитивных клеток после перинатального гипоксически ишемического поражения увеличивается (р<0,05). Через 8 часов количество Cx43+ астроцитов увеличивается, достигая максимума к 72 часам после гипоксии-ишемии и начинает уменьшаться через 10 дней, достигая контрольных значений к 28 суткам постнатального развития.
Иная картина экспрессии Cx43 наблюдается на эндотелиоцитах в опытной группе, где происходит 1,5-кратное уменьшение количества клеток, содержащих коннексин 43. Через 72 часа отмечается минимальная экспрессия Cx43 на эндотелиоцитах, с последующим медленным восстановлением до контрольных цифр к 28 суткам постнатального периода.
Подобные особенности экспрессии Cx43 установлены и в клеточной модели НВЕ in vitro (таблица 11). Отмечается высокая экспрессия Сх43 на астроцитах и эндотелиоцитах в контрольной культуре. При гипоксии происходит увеличение экспрессии Сх43 на астроцитах (р<0,05), без значимых изменений на эндотелиоцитах.
Эти изменения свидетельствуют о том, что реактивный астроглиоз сопровождается возрастанием функционального сопряжения астроцитов, а также скоординированной экспрессии Cx43 и CD38, участвующих в поддержании внутриклеточного гомеостаза НАД+ и регулирующих процессы его конверсии в кальций-мобилизующий вторичный посредник, что может быть необходимым компонентом активации и миграции клеток астроглиальной природы. Сопутствующее снижение экспрессии Cx43 на эндотелиоцитах, вероятно, отражает процессы дизрегуляции барьерогенеза и нарушение целостности ГЭБ. Обнаруженное значительное количество (до ¾) клеток одновременно экспрессирующих CD38 и Cx43 может свидетельствовать о функциональном сопряжении этих двух молекул на астроцитах. При этом коннексин-43 регулирует доступность субстратов (НАД+, АТФ) для взаимодействия с CD38, которая обеспечивает превращение НАД+ в цАДФР, мобилизующую кальций из внутриклеточных депо в цитозоль, что актуально для активации астроцитов и их миграции в очаг повреждения. Также посредством CD38/Cx43-опосредованных межклеточных взаимодействий может достигаться и влияние астроцитов на нейроны, путем изменения концентрации внутриклеточного кальция и изменением высвобождения глутамата и гамма-аминомасляной кислоты. Обнаруженное увеличение экспрессии CD38 в астроцитах маркирует собой не только проявления феномена глутамат-зависимой эксайтотоксичности, но и нарушения межклеточного транспорта глутамата. Действительно, в ходе исследования, в экспериментах in vitro, зарегистрировано изменение экспрессии глутаматных транспортеров в астроцитах после перенесенной «химической гипоксии».
Однако, роль таких изменений еще не до конца ясна. Есть работы, свидетельствующие о нейропротективном действии Сх43, который ограничивает выраженность астроглиоза (Theodoric N. et al., 2012). С другой стороны, одновременное увеличение экспрессии коннексинов и CD38 может обеспечивать развитие «кальциевой волны» и глутаматной эксайтотоксичности, усиливая гипоксически-ишемические повреждения. На рисунке 2 представлена схема молекулярного сопряжения клеток НВЕ посредством CD38 и Cx43.
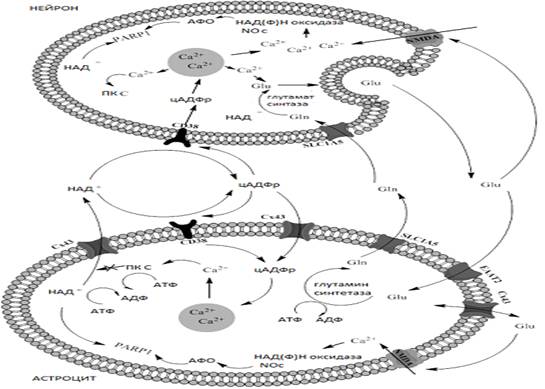
Рисунок - 2 Схема внутриклеточных молекулярных взаимодействий с участием CD38 и Сх43 (АФО-активные формы кислорода, Glu-глутамат, Gln-глутамин, ПКС-протеин киназа С, NOс - NO-синтаза), цАДФР - цАДФ-рибоза
Таким образом, изменение экспрессии CD38 и Cx43 на клетках ГМ является маркером нарушения межклеточной коммуникации НВЕ при перинатальном поражении ЦНС. В целом, полученные результаты свидетельствуют о новых механизмах нарушения структурной и функциональной целостности НВЕ/ГЭБ при ГИП ГМ, что и стало предметом изучения на следующем этапе работы, для проведения которого была использована разработанная нами оригинальная модель НВЕ in vitro.
Экспрессия белков-транспортеров гидрофобных молекул,
глутамина и глутамата в клетках НВЕ
Для оценки роли белков-транспортеров в регуляции процессов межклеточной коммуникации при перинатальном ГИП ЦНС были изучены: экспрессия Р-гликопротеина (Pgp) - транспортера гидрофобных ксенобиотиков и белка SLC1A5 - транспортера глутамина - на нейронах, астроцитах и эндотелиоцитах. Для этого фенотипировали клетки НВЕ по экспрессии белков-маркеров нейронов, астроцитов и эндотелиоцитов и соэкспрессии Pgp и SLC1А5. Полученные данные представлены в таблице 10.
Среди нейронов контрольной группы клеток, экспрессирующих Pgp, не было обнаружено. У животных, перенесших перинатальную гипоксию-ишемию ЦНС, отмечалось увеличение количества нейронов, экспрессирующих Pgp, в сравнении с контролем: уже через 4 часа с момента начала действия гипоксии-ишемии началось, а через 8 часов продолжилось увеличение числа Pgp+ нейронов (р<0,05). На 3 сутки после ГИП, в подгруппе (Р10), нарастания количества нейронов с Pgp-позитивной меткой не отмечалось. На 10 сутки ишемического повреждения (Р17) количество Pgp+ нейронов уменьшилось в два раза (р<0,01) и продолжало снижаться до 28 суток постнатального развития.
В группе контрольных животных количество астроцитов и эндотелиоцитов, экспрессирующих Pgp, практически не изменялось в этот период онтогенеза и оставалось в пределах 0,6-2,8% для астроцитов и 1,5-4,3% - для эндотелиоцитов.
У животных опытной группы после перенесенной перинатальной гипоксии-ишемии количество Pgp+ астроцитов и эндотелиоцитов существенно превышало показатели контрольной группы. Увеличение количества Pgp+ клеток зафиксировано через 4 часа: количество Pgp+ астроцитов увеличилось в 9,5 раз, эндотелиоцитов - 2,6 раза. Через 8 часов дополнительно увеличилось количество Pgp+ позитивных астроцитов и эндотелиоцитов (р<0,05), практически в 2 раза, по сравнению с предыдущей временной подгруппой и в 4 раза по сравнению с контрольной группой (р<0,01). С третьих суток отмечается постепенное снижение числа Pgp+ астроцитов, которое, однако, к 21 дню после гипоксически-ишемического воздействия (Р28) оставалось в 5,3 раза выше чем в контрольной группе (р<0,01).
Иная ситуация наблюдалась с эндотелиоцитами. Через 72 часа после ГИП продолжается увеличение числа Pgp+ клеток до максимальных цифр среди всех подгрупп и больше чем в контрольной группе в 7,7 раз (р<0,01). В дальнейшем, зафиксировано постепенное уменьшение количества эндотелиоцитов, экспрессирующих изучаемый белок, которое на 21 сутки после перенесенной гипоксии-ишемии оказалось в 4,7 раз выше, чем в контрольной группе (р<0,01).
Таблица 10 - Результаты регистрации экспрессии белков-транспортеров гидрофобных молекул, глутамина, глутамата в клетках НВЕ у животных опытной и контрольной групп (%)
Подгруппа | Маркер | Нейроны | Астроциты | Эндотелиоциты | |||
Опыт | Контроль | Опыт | Контроль | Опыт | Контроль | ||
Р7` | Pgp | 11,3±3,4* | 0 | 16,3±4,9* | 1,7±1,1 | 8,7±2,7* | 3,3±0,8 |
SLC1А5 | 2,4±1,1 | 2,1±0,6 | 5,8±0,3 | 5,2±0,1 | н/э | н/э | |
EAAT2 | н/э | н/э | 24,6±3,8* | 50,3±5,6 | н/э | н/э | |
Р7 | Pgp | 16,7±4,3* | 0 | 17,1±3,5* | 1,5±0,9 | 16±2,1* | 3,9±0,4 |
SLC1А5 | 20,0±8,0* | 2,5±0,3 | 9,0±1,0* | 4,5±0,5 | н/э | н/э | |
EAAT2 | н/э | н/э | 23,0±5,5* | 46,8±6,3 | н/э | н/э | |
Р10 | Pgp | 18,0±5,5* | 0 | 13,7±3,1* | 2,1±0,4 | 20,8±1,7* | 2,7±1,2 |
SLC1А5 | 23,0±5,0* | 1,5±0,1 | 22,0±6,0* | 4,8±0,3 | н/э | н/э | |
EAAT2 | н/э | н/э | 65±4,1* | 52,7±3,8 | н/э | н/э | |
Р17 | Pgp | 9,1±2,1* | 0 | 12,1±4,2* | 1,4±0,6 | 16,0±2,7* | 2,5±0,7 |
SLC1А5 | 0,4±0,2* | 2,2±0,8 | 18,0±4,0* | 4,7±0,2 | н/э | н/э | |
EAAT2 | н/э | н/э | 72,1±4,2* | 48,8±7,2 | н/э | н/э | |
Р28 | Pgp | 7,6±1,4* | 0 | 10,1±2,6* | 1,9±0,5 | 15,1±1,8* | 3,2±0,6 |
SLC1А5 | 0,3±0,1* | 1,8±0,4 | 4,8±0,4 | 5,1±0,2 | н/э | н/э | |
EAAT2 | н/э | н/э | 54,1±2,6 | 52,1±6,2 | н/э | н/э |
Примечания: * - уровень значимостимежду группами р<0,05, критерий Манна-Уитни; н/э - не экспрессируется клетками

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 |




