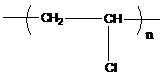![]() (13.1)
(13.1)
Т. к. N0=2M0, a Nt=2Mt, (13.2)
то получаем:
![]() (13.3)
(13.3)
Учитывая, что 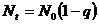 (13.4)
(13.4)
получаем следующее выражение:
![]() (13.5)
(13.5)
- уравнение Карозерса, оно устанавливает связь между степенью полимеризации и степенью превращения.
13.1. Классификация процессов ПК
В основу классификации процессов поликонденсации могут быть положены различные признаки – структура образующихся продуктов, число и характеристика мономеров, участвующих в реакциях и т. д. В линейной поликонденсации участвуют бифункциональные мономеры, приводящие к получению линейных полимеров. Для проведения сетчатой (трехмерной) поликонденсации необходимо использование мономеров с тремя или большим числом функциональных групп. В этом случае образуются пространственно сшитые полимеры. Выделяют также циклополиконденсацию, приводящую обычно к получению лестничных полимеров, имеющих структуру двух параллельных цепей, соединенных поперечными связями.
Поликонденсацию, в которой участвуют бифункциональные мономеры одного типа, называют гомополиконденсацией. Типичным примером гомополиконденсации является синтез полиэфиров из оксикислот:
Поликонденсация, в которой участвуют мономеры различных типов, т. е. мономеры, содержащие функциональные группы, реагирующие только с функциональными группами другого мономера, называют гетерополиконденсацией (например, синтез полигексаметиленадипамида из гексаметилендиамина и адипиновой кислоты):

К сополиконденсации относят процессы с участием двух или большего числа мономеров, каждый из которых способен образовать собственный полимер. Например, по реакции сополиконденсации осуществляется синтез смешанного полиамида аминокопроновой и аминоэнантовой кислот:
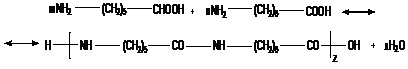
Интерсополиконденсация протекает с одновременным участием трех мономеров:
 ,
, ,
,  ;
;
у первых двух, называемых сомономерами, группы «a» и «b» между собой не взаимодействуют, а взаимодействуют только с функциональной группой «с» интермономера. Примером такой реакции может служить поликонденсация двух диаминов и дикарбоновой кислоты:
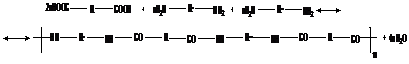
13.2. Полимеры, получаемые ПК
1. Полиэфиры получаются реакциями двухатомных спиртов с дикарбоновыми кислотами или их эфирами:
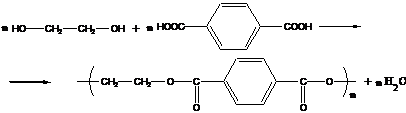
пример – получение полиэтилентерефталата (является одним из термостойких полимеров: tпл≈265°С).
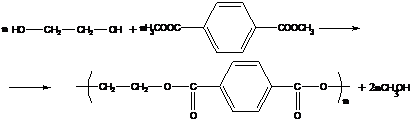
2. Полиамиды - получаются реакциями диаминов с дикарбоновыми кислотами:
Пример:
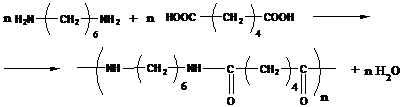
- реакция проводится в расплаве и получается полимер Nylon-66 (первая цифра - количество метиленовых групп в диамине, вторая – количество атомов углерода в дикарбоновой кислоте).
Для проведения реакции полиамидирования в более мягких условиях используют мономеры с «активированными» карбоксильными группами:
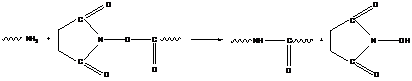
- «активированный» гидроксисукцин имидный эфир карбоновой кислоты

- хлорангидрид карбоновой кислоты
Для получения термо - и теплостойких полимеров реакцию поликонденсации проводят в несколько стадий.


3. Поликарбонаты

4. Полисульфоны
Пример: поликонденсация бис-фенола А и дихлордифенилсульфона
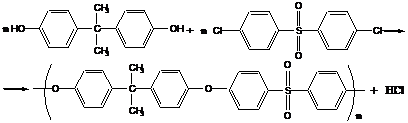
образующийся в процессе хлороводород связывают гидроксидом натрия, который добавляется в реакционную смесь.
5. Полисилоксаны
Пример: получение полидиалкилсилоксанов
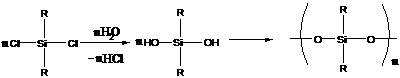
Большинство полисилоксанов обладают высокой термостойкостью.
6. Получение сетчатых (трехмерных) полимеров поликонденсацией (для этого необходимо присутствие полифункциональных мономеров)
Пример – получение фенолформальдегидных смол.

Эта реакция, открытая в 1909 г. Бакеландом, лежит в основе первого промышленного процесса получения пластмасс и композитов (резины, бакелит) и до сих пор находит широкое практическое применение.
7. Эпоксидные смолы

Благодаря тому, что реакция «отверждения» эпоксидных композиций происходит при умеренных температурах, без выделения низкомолекулярных продуктов и практически без усадки, ее широко используют для получения высокопрочных армированных композитов.
8. Полиуретаны
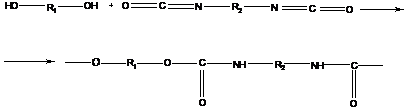
В реакцию «отверждения» в качестве гликолей обычно вводят олигомеры с М ~ 103 – 104 с концевыми гидроксильными группами на основе полиоксиэтилена, полибутадиена, полистирола и др. (олигомерная технология). Тем самым, получают целую серию материалов с широким спектром физико-механических свойств, гидрофильно-гидрофобного баланса, биосовместимости.
9. Продукты окислительной полимеризации
Это особый вид неравновесных поликонденсационных процессов, в которых непосредственное участие принимает окислитель.
Рассмотрим два важных примера:
Полифениленоксид
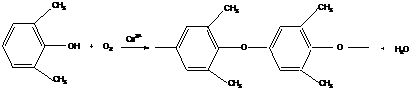
Продуктом является инженерный термопластик с высокими физико-механическими свойствами и теплостойкостью. При использовании незамещенных фенолов получают сшитые полимеры, не поддающиеся переработке.
10. Полианилин
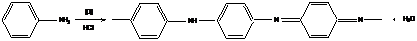
Полианилин – это интенсивно окрашенный (синий или зеленый) полимер с высокой электропроводимостью.
13.3. Механизм и кинетические закономерности ПК
Принцип Флори – реакционная способность функциональных групп не зависит от длины молекулярной цепи, от вязкости реакционной среды.
Рассмотрим процесс линейной поликонденсации:
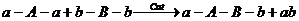
Пусть мономеры взяты в эквимольных количествах: са=сb, получаем:
![]() (13.3.1)
(13.3.1)
![]() (13.3.2)
(13.3.2)
![]() (13.3.3)
(13.3.3)
Отсюда получаем:
![]() , (13.3.4)
, (13.3.4)
таким образом, степень полимеризации линейно зависит от времени проведения процесса.
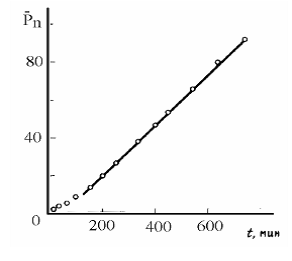
Рис.13.3.1. Зависимость среднечисловой степени полимеризации от времени реакции при поликонденсации адипиновой кислоты и этиленгликоля.
13.4. Реакции ограничения роста цепи (степени полимеризации) в процессах ПК
· Введением избытка одного из реагирующих веществ возможно регулирование ММ получаемых полимеров. Больших значений степени полимеризации можно достигнуть, если брать строго стехиометрические соотношения реагирующих веществ. Если в реакционной системе присутствует избыток одного из реагентов, то происходит превалирование одних функциональных групп, степень превращения q уменьшается, степень полимеризации увеличивается.
ca<cb, введем величину
![]() , тогда получим:
, тогда получим:
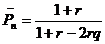 (13.4.1)
(13.4.1)
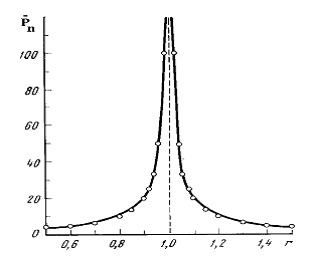
Рис.13.4.1. Влияние стехиометрического соотношения бифункциональных реагентов на степень полимеризации Pn при поликонденсации.
при r=0.91 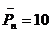 ;при r=0.99
;при r=0.99 ![]() ;при r=0.999
;при r=0.999 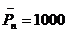
· Концентрация функциональных групп определенного типа может быть уменьшена за счет протекания побочных процессов их разложения (например, процесс декарбоксилирования при повышенных температурах), присоединение функциональных групп к концу растущей цепи приводит к образованию нереакционноспособных макромолекул.
· На степень поликонденсации влияет наличие монофункциональных примесей в исходных реагентах. Желательно, чтобы исходные вещества были чистыми, иначе трудно точно регулировать ММ получаемого полимера.
· Для регулирования ММ полимера иногда добавляют специальные вещества – стабилизаторы молекулярных масс.
· Если процесс поликонденсации равновесный, то, регулируя константу равновесия (К) и молярную долю низкомолекулярного продукта (υ), можно влиять на ММ получаемого полимера:
![]() (13.4.2)
(13.4.2)
![]() (13.4.3.)
(13.4.3.)
таким образом, уменьшая концентрацию низкомолекулярного продукта, можно получить высокомолекулярный полимер.
Удаление низкомолекулярного продукта можно производить различными способами – химическим связыванием, разложением, вакуумированием и т. д.
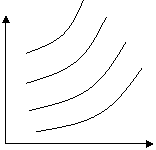 Pn
Pn
1
2
3
4
K
ν1<ν2<ν3<ν4
Рис. 13.4.2. Зависимость степени полимеризации от константы равновесия и количества низкомолекулярного продукта (υ)
· При наличии равновесия «линейный полимер-цикл» процесс нужно проводить при термодинамических условиях, исключающих образование циклов.
· Уменьшением активности функциональных групп при возрастании вязкости системы (это связано с диффузионными ограничениями из-за пространственного удаления функциональных групп у больших молекул).
· Понижение активности функциональных групп за счет исчерпания катализатора, понижения температуры. При введении новой порции катализатора или повышении температуры поликонденсация возобновляется.
13.5. Методы проведения ПК
1. Проведение ПК в расплаве
Если исходные мономеры и полимер устойчивы при температуре плавления (обычно 200 – 300 ◦С); для уменьшения вероятности протекания побочных реакций (окисление, деструкция) процесс проводят в атмосфере инертного газа и заканчивают обычно в вакууме для более полного удаления низкомолекулярных веществ, выделяющихся при ПК.
2. Проведение ПК в растворе
Возможность использования более низких температур, что имеет особое значение, когда мономеры или полимер неустойчивы при температуре плавление. Однако при введении растворителя скорость ПК уменьшается и возрастает вероятность циклизации. Кроме этого возникает проблема удаления из полимера растворителя и его регенерации.
3. Проведение ПК на границе раздела фаз
Исходные мономеры растворяют раздельно в двух несмешивающихся жидкостях. Как правило, в качестве одного из компонентов смеси используется бифункциональный галогенангидрид, растворенный в бензоле или хлороформе; второй компонент – бифункциональное соединение, содержащее подвижные атомы водорода, например, диамин или фенол, растворенное в воде (с добавкой соды или щелочи). Выделяющийся при реакции HCl растворяется в водной фазе, где связывается щелочью. Полимер образуется на границе раздела фаз в виде пленки и непрерывно извлекается (вытягивается) из реакционной среды. Иногда для увеличения скорости реакции проводят энергичное эмульгирование органической фазы в воде. Образующийся при этом полимер выпадает в виде хлопьев и коагулирует в комочки. Получаемые этим способом полимеры имеют высокую молекулярную массу.
Вопросы для самостоятельной проработки:
1. Какой процесс называют поликонденсацией?
2. Перечислите основные различия между полимеризационными и поликонденсационными процессами.
3. Классификация процессов поликонденсации.
4. Приведите примеры полимеров, получаемых процессом поликонденсации.
5. Как связана средняя степень ПК с глубиной превращения. Поликонденсационное равновесие и молекулярная масса полимеров.
6. Зависимость средней степени ПК (Р) от соотношения бифункциональных мономеров.
7. Как влияют добавки монофункциональных соединений на Рn?
8. Кинетика ПК.
9. Какие факторы влияют на реакции ограничения цепи (степени превращения) в процессах поликонденсации?
10. Основные способы проведения ПК.
Задачи для самостоятельного решения
3. Методы получения и структура основных типов полимеров
3.7. Ступенчатые процессы синтеза полимеров
Вопросы 7501 – 7503, 7512 – 7515, 7404 – 7407, 7416 – 7420, 7308 – 7311, 7321 – 7325
Раздел № 14. Химические превращения и модификации полимеров
Химические превращения полимеров рассматриваются в 2 аспектах: изучение свойств полимера в процессе его эксплуатации (старение) и изучение взаимодействия полимера с различными низкомолекулярными соединениями (модификация).
Одной из задач химической модификации полимеров является получение новых модификаций на основе уже существующих природных ВМС, т. е. получение искусственных полимеров, либо модификация синтетических полимеров.
Выделяют 3 основных типа химических превращений:
1. превращения, в которых степень полимеризации не меняется, главная цепь не удлиняется и не укорачивается; реакции идут по функциональным группам (к таким реакциям относятся полимераналогичные и внутримолекулярные);
2. превращения, в которых происходит увеличение степени полимеризации:
а) процессы сшивания макромолекул (получение сшитых полимеров),
б) процессы получения привитых и блоксополимеров;
3. превращения, в которых происходит уменьшение степени полимеризации (процессы деструкции, разложения полимеров).
Принцип Флори: механизм и скорости реакций функциональных групп полимеров близки к соответствующим низкомолекулярным аналогам.
Однако существуют определенные особенности взаимодействия функциональных групп в макромолекуле по сравнению с соответствующим низкомолекулярным аналогом, это в некоторых случаях необходимо учитывать.
Пример: сравним реакцию этерификации низкомолекулярного спирта и высокомолекулярного соединения, содержащего гидроксильные группы, карбоновой кислотой
в первом случае имеем:
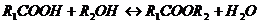 - идет обратимая реакция этерификации, а молекулы, участвующие в реакции, либо прореагировали, либо не вступили в реакцию. Продукт реакции может быть отделен от исходных молекул.
- идет обратимая реакция этерификации, а молекулы, участвующие в реакции, либо прореагировали, либо не вступили в реакцию. Продукт реакции может быть отделен от исходных молекул.
В случае этерификации, например, поливинилового спирта реакция протекает по-другому: получаются макромолекулы с различной степенью этерификации, возрастающей по ходу процесса, т. е. образуется набор макромолекул, существенно отличающихся друг от друга по свойствам. Разделить прореагировавшие и не прореагировавшие группы на одной макромолекуле невозможно, а сама макромолекула имеет «химическую память» о тех процессах, в которых она участвовала.
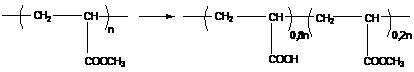
Невыполнение принципа Флори обуславливается рядом эффектов:
1) Эффект цепи
полимеры могут вступать в реакции, не имеющие прямых аналогий с реакциями НМС; они обусловлены наличием длинной цепочки однородных звеньев. К таким реакциям относят реакции деполимеризации, внутримолекулярной циклизации, превращения полимеров с образованием протяженной системы с чередованием сопряженных связей и др.
Пример:
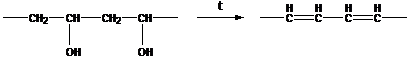
2) Конфигурационные эффекты
"Эффект соседа" – заключается в изменении кинетики и механизма реакций полимеров с низкомолекулярными соединениями, обусловленных влиянием соседних звеньев полимерной цепи.
Рассмотрим следующие случаи:
а) ни одна группа в окружении выделенной группы Х не прореагировала с молекулой А (группа Х способна вступать во взаимодействие с молекулой А с образованием группы Y):
![]() N0, k0
N0, k0
(k – константа реакции, N – количество вещества)
б) одна группа в окружении выделенной группы Х прореагировала с молекулой А:
![]() N1, k1
N1, k1
в) две группы в окружении выделенной группы Х прореагировали с молекулой А:
 N2, k2
N2, k2
в данном случае, учитывая возможность существования различных случаев (а)-(в), получаем следующую кинетическую зависимость:
![]()
Можем получить 3 случая:
1) Если k0=k1=k2, то "эффект соседа" отсутствует.
2) Если k0>>k1>>k2, то происходит замедление взаимодействия Х и А (введение одной или двух функциональных групп приводит к снижению скорости реакции).
Пример подобного случая – щелочной гидролиз полиметакриламида:
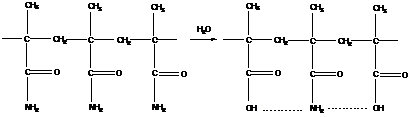
из-за образования водородной связи реакция третьей функциональной группы становится менее вероятной.
3) Если k2>>k1>>k0, то наблюдается ускоряющий "эффект соседа"
Примером реакции, протекающей с проявлением ускоряющего «эффекта соседа», может быть гидролиз поли-п-нитрофенил метакрилата, скорость которого в 104 раз больше скорости гидролиза низкомолекулярного п-нитрофенилового эфира изомасляной кислоты. Это обусловлено изменением механизма реакции: в полимере гидролиз эфирных групп протекает не под действием «внешних» ионов ОН-, а под влиянием соседних ионизованных карбоксильных групп:

и скорость данной реакции возрастает в 10000 раз.
В этом случае группа, обладающая каталитическим действием, находится в самой цепи, что и обуславливает увеличение скорости процесса.
Таким образом, можно получать различные варианты кинетического проявления «эффекта соседа»:
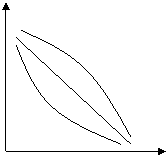 |
[X]
3- 1- 2-
T
Рис. 14.1. Кинетическое проявление «эффекта соседа»
Это проявляется в изменении направления и завершенности реакции вследствие наличия соседнего звена того ил иного химического строения или пространственной конфигурации, которое создает стерические затруднения (происходит блокировка функциональных групп, находящихся в цепи, что приводит к уменьшению степени завершенности реакций).
3) Конформационные эффекты
Существует два вида конформационных эффектов, влияющих на химическое превращение полимеров.
Первый тип предполагает необходимость сближения функциональных групп данной макромолекулы, разделенных большим числом звеньев, для осуществления какой-либо реакции, т. к. вероятность протекания реакции зависит от вероятности реализации необходимой для этого конформации и от времени ее существования. Эффекты такого рода вызывают изменение скорости реакции в 104-106 раз.
Второй тип конформационных эффектов связан с изменением конформации макромолекулы в процессе химического превращения, поскольку при этом меняются химический состав, энергия внутри - и межмолекулярного взаимодействия, потенциальные барьеры внутреннего вращения звеньев в полимерной цепи и т. д. При этом может происходить замедление или ускорение реакции.
Пример реакции данного типа – гидролиз ПВА:
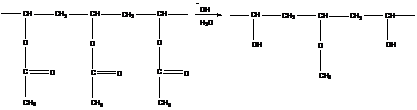
Эта реакция протекает с увеличением скорости в ходе процесса.
Ускорение реакции объясняется следующим: поливинилацетат плохо растворим в среде ацетон-вода, молекулы имеют конформацию плотного клубка; реакция вначале идет медленно, т. к. доступны только функциональные группы, находящиеся на поверхности. Образующийся поливиниловый спирт хорошо растворим в данной среде, происходит разворачивание клубка, он набухает. Таким образом, изменение конформации влияет на скорость реакции.
4) Концентрационные эффекты
Эти эффекты заключаются в изменении скорости реакции, протекающей с участием полимера в связи с изменением локальных концентраций реагирующих групп вблизи макромолекул.
Полимерные молекулы в растворе обычно имеют конформацию клубка, при этом концентрация функциональных групп высока внутри клубка и практически равна нулю с внешней стороны. Например, при рассмотрении 1 % - ного раствора ПВА с молекулярной массой 106 общая концентрация ацетатных групп равна 0.11 М, а локальная концентрация может быть выше в 50 раз. Поэтому может быть и различна скорость взаимодействия данного полимера с низкомолекулярным соединением.
5) Надмолекулярные эффекты
Эти эффекты обусловлены изменением доступности функциональных групп при различных способах укладки (расположения друг относительно друга) макромолекул.
У кристаллических и аморфных полимеров доступность групп различна.
Методы химического превращения полимеров
1. Полимераналогичные реакции
Полимераналогичные превращения – это химические реакции боковых (в основном функциональных) групп или атомов основной цепи, протекающие без разрыва химических связей в макромолекуле и не приводящие к изменению строения его скелета.
Можно выделить два основных направления использования полимераналогичных реакций:
а) для получения полимеров, которые не могут быть напрямую синтезированы из соответствующих мономеров. Примером данной реакции может служить реакция гидролиза поливинилацетата с образованием поливинилового спирта (см. ниже).
Ограничения, описанные выше, могут накладываться при протекании реакции, поэтому получается серия сополимеров с различным содержанием ацетатных групп (полного замещения обычно не происходит).
б) для химической модификации мономеров с целью устранения каких-либо нежелательных свойств и придания им новых свойств.
Примерами реакций этого класса служат:
Химические модификации целлюлозы, получение полиацеталей и ряда других продуктов из поливинилового спирта; внутримолекулярные реакции дегидратации ПВС, дегидрохлорирования ПВХ; реакции внутренней циклизации.
Рассмотрим несколько практически важных реакций синтеза полимеров методом полимераналогичных реакций:
1). поливинилацетат 
поливиниловый спирт
|
|



|
|

поливинилбутираль поливинилен
2). полихлорфозфазен (гидролитически нестоек)

огнестойкий огнестойкий водорастворимый
волокнообразующий эластомер биоразложимый
полимер полимер
3). целлюлоза
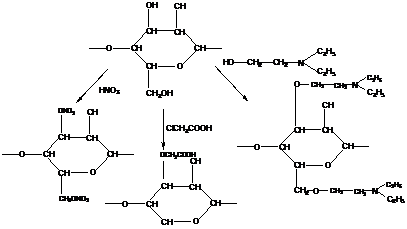
нитроцеллюлоза карбоксиметилцеллюлоза диэтиламиноэтилцеллюлоза
(первые искусственные (катионообменник) (анионообменник)
пластмасса, пленки, волокна)
4). Циклизация полиакрилонитрила:

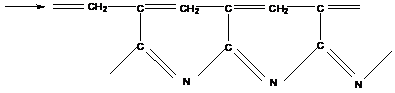
термостойкий полупроводник
2. Межмолекулярные реакции
К данным процессам относятся привитая и блок-сополимеризация, сшивание макромолекул.
Сшивание эластомеров называют реакцией вулканизации:
а) серная вулканизация:
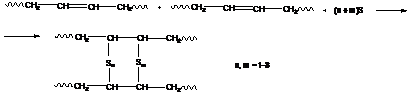

 б) оксидная вулканизация
б) оксидная вулканизация
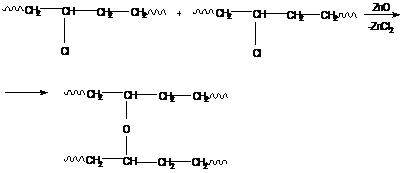
Вопросы для самостоятельной проработки:
1. Перечислите три основных типа химических превращений.
2. В чем сущность принципа Флори, чем обусловлено невыполнение этого принципа для полимеров?
3. Влияние «эффекта соседа» на механизм реакций полимеров с низкомолекулярными соединениями.
4. Опишите конформационные эффекты, влияющие на химические превращения полимеров.
Раздел № 15. Старение и стабилизация полимеров
Сразу же после синтеза и далее в процессе эксплуатации полимеры начинают разрушаться или «стареть» под действием самых разных внешних воздействий. К их числу относятся:
1. Механические воздействия и деформации.
2. Термическое воздействие.
3. Действие различных по своей природе химических веществ (жидких и газообразных).
4. Действие излучений высокой энергии, включая солнечный свет.
На практике, как правило, при деструкции полимеров одновременно действует несколько видов воздействия.
Результатом таких воздействий может быть разрыв макромолекул и падение молекулярной массы, изменение химического строения макромолекул без изменения степени полимеризации и возникновение трехмерно-сшитых и разветвленных структур. Практически во всех случаях такие неконтролируемые изменения приводят к ухудшению комплекса эксплуатационных свойств полимера и (или) возможности его переработки в изделия.
Защита полимеров от действия агрессивных факторов позволяет существенно продлить как время их жизни, так и ужесточить режим эксплуатации полимеров, что эквивалентно значительному уменьшению расхода полимерных материалов с соответствующими экономическими и экологическими последствиями.
Кратко рассмотрим особенности различных видов деструкции.
1. Механическая деструкция.
|
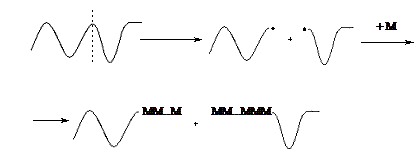
При длительной механической нагрузке происходит процесс накопления повреждений с участием теплового движения (тепловых флюктуаций) с последующим разрушением материала. Зависимость долговечности материала, находящегося под нагрузкой, от напряжения и температуры выражается уравнением Журкова:
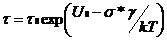
где τ – долговечность, т. е. время от момента приложения силы до разрыва образца;
U0 – энергия активации разрыва химической связи в полимере;
σ – приложенное напряжение;
γ – структурно-чувствительный коэффициент;
τ0 – время тепловых колебаний.
Как видно из уравнения, с ростом приложенной нагрузки долговечность материала падает.
2. Тепловая деструкция (пиролиз).
Скорость термической деструкции сильно зависит от химической структуры полимера.
Например
Полимер | Тразл., ◦С |
| 320 |
| 310 |
| 150 |
| 220 |
| 400 |
| 450 |
Видно, что термостойкость виниловых полимеров, построенных из C, H, O, Cl, относительно невысока, но значительно возрастает при замене H на F или при переходе к полиароматическим структурам.
Механизм термодеструкции также сильно зависит от химической структуры полимера, в частности, от его термодинамической устойчивости. Для полимеров с достаточно низкими верхними предельными температурами (полиметилметакрилат, поли-α-метилстирол, полиформальдегид) (Тпр < 100 – 150 ◦С) при повышенных температурах полимер становится термодинамически неустойчивым, и термический распад полимера может проходить по цепному механизму деполимеризации (см. разделы 5 и 6). В отсутствие процессов передачи цепи практически единственным продуктом деструкции является мономер:
Pn∙ → nM
Для стабилизации термодинамически неустойчивых полимеров в условиях эксплуатации:
1) ингибируют стадию инициирования цепной реакции деполимеризации;
2) обрывают развитие цепи деполимеризации путем введения на стадии синтеза в макромолекулы термодинамически неустойчивого полимера звеньев более термодинамически устойчивого полимера.
В случае полиформальдегида первую задачу решают путем ацетилирования концевых ОН-групп полимера:

Вторую задачу решают путем сополимеризации формальдегида, например, с диоксоланом. Полученный полимер, имеющий структуру

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 |