В случае α-метилстирола - ![]() ≈ 8,5 ккал/моль.
≈ 8,5 ккал/моль.
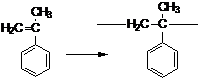
Снижение значения теплового эффекта происходит из-за стерического взаимодействия СН3
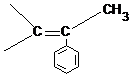 групп в соседних звеньях и из-за потери энергии сопряжения с группой
групп в соседних звеньях и из-за потери энергии сопряжения с группой  в мономере.
в мономере.
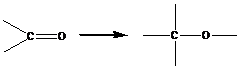
(полимеризация формальдегида, ацетальдегида).
![]() ≈2-3 ккал/моль, реакция также экзотермическая, но тепловой эффект небольшой.
≈2-3 ккал/моль, реакция также экзотермическая, но тепловой эффект небольшой.
Изменение энтропии при полимеризации:
![]() , где Sпол – абсолютная энтропия полимера, Sмон – абсолютная энтропия мономера, Sпот – потеря поступательной энтропии молекул мономера.
, где Sпол – абсолютная энтропия полимера, Sмон – абсолютная энтропия мономера, Sпот – потеря поступательной энтропии молекул мономера.
Полимеризация сопровождается уменьшением энтропии, а ΔSпол мало зависит от природы мономера.
В реакциях полимеризации этилена, метилметакрилата, формальдегида ΔH<0, ΔS<0, область полимеризации ограничивается верхней предельной температурой.
Для равновесной концентрации мономера при расчете верхней предельной температуры получаем:
при полимеризации этилена верхняя предельная температура равна 20000/25=800К=527˚С, термодинамические ограничения не влияют на проведение процесса;
при полимеризации α-стирола верхняя предельная температура равна 8500/25=340К=67˚С, реакция идет при температурах ниже 67˚С;
при полимеризации формальдегида верхняя предельная температура равна 3000/25=120К=-153˚С, реакция в растворе возможна только в условиях низких температур.
2. Полимеризация с раскрытием цикла
![]() (5.14)
(5.14)
Пример реакции полимеризации с раскрытием цикла:
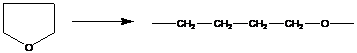
- раскрытие трехчленного цикла:
![]() -углы в цикле сильно деформированы (60˚, валентный - 119˚28΄), цикл является плоским.
-углы в цикле сильно деформированы (60˚, валентный - 119˚28΄), цикл является плоским.
при раскрытии трехчленного цикла освобождается энергия напряжения валентных углов в цикле, изменение энтропии отрицательно, Qпол>0 – реакция экзотермическая;
- раскрытие четырехчленного цикла:
![]() углы в этом цикле менее деформированы, чем в трехчленном, но реакция по-прежнему экзотермическая;
углы в этом цикле менее деформированы, чем в трехчленном, но реакция по-прежнему экзотермическая;
- раскрытие пятичленного цикла:
при раскрытии этого цикла также освобождается энергия деформации валентных углов, выделяется тепло, но тепловой эффект реакции очень мал, т. к. величины углов в цикле близки с равновесным углом в тетраэдре, т. к. углы в этом цикле почти равновесны:
При раскрытии цикла энергия практически не выделяется (Qпол ≈ 0);
- раскрытие шестичленных циклов:
 из-за образования устойчивых неплоских конформаций «ванна» (а) или «кресло» (б) углы в этом цикле очень близки к равновесным валентным.
из-за образования устойчивых неплоских конформаций «ванна» (а) или «кресло» (б) углы в этом цикле очень близки к равновесным валентным.

а б
нет выигрыша энергии при разрушении цикла, Q≈0;
- раскрытие семичленных циклов:
 появляются дополнительные напряжения в цикле за счет пространственных затруднений расположения заместителей, тепловой эффект снова возрастает.
появляются дополнительные напряжения в цикле за счет пространственных затруднений расположения заместителей, тепловой эффект снова возрастает.
В результате получаем следующие зависимости термодинамических параметров реакции от числа звеньев в цикле:
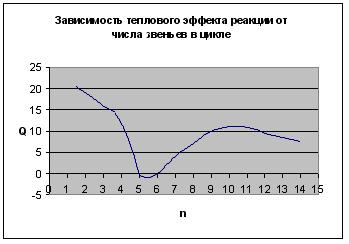
Рис. 5.5. Зависимость теплового эффекта реакции от числа звеньев в цикле
ΔS
25
энтр.
ед.
10 11 n
Рис. 5.6. Зависимость изменения энтропии при раскрытии различных циклов
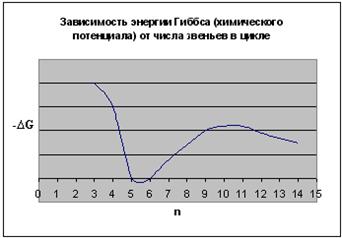
Рис. 5.7. Зависимость изменения энергии Гиббса (химического потенциала) при раскрытии различных циклов:
Таким образом, термодинамическая устойчивость циклов существенно зависит от их размера. Наиболее устойчивыми оказываются 5- и 6-членные циклы. При уменьшении и при увеличении размера циклов их склонность к полимеризации возрастает. Указанная закономерность была проиллюстрирована на примере ациклических систем. При введении одного или немногих атомов O, S, N в цикл рассмотренные закономерности сохраняются.
Вопросы для самостоятельной проработки:
1. Какими факторами определяется возможность протекания реакции полимеризации?
2. Что такое верхняя предельная температура полимеризации?
4. Что такое нижняя предельная температура полимеризации?
5. Как определить среднюю степень полимеризации?
6. Как влияют термодинамические ограничения на различные виды полимеризации?
7. Охарактеризуйте зависимость изменения энтропии при полимеризации.
Раздел №6. Термодинамические условия проведения реакций синтеза макромолекул (продолжение предыдущей лекции)
Внедрение гетероатомов в систему цикла атомов углерода мало влияет на общую термодинамическую картину, но активирует реакцию раскрытия циклов.
Трехчленные гетероциклы легко вступают в реакции полимеризации.
![]()
![]()
Четырехчленные гетероциклы также способны вступать в реакции полимеризации.
Пятичленные гетероциклы труднее вступают в реакции полимеризации (появляются термодинамические ограничения).
 -тетрагидрофуран
-тетрагидрофуран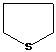 - тетрагидротиофен
- тетрагидротиофен
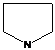 - тетрагидропиррол
- тетрагидропиррол
Шестичленные гетероциклы не способны вступать в реакции полимеризации.
Семичленные гетероциклы легко вступают в реакции полимеризации:
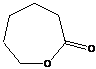 ε - капролактон
ε - капролактон
(также способен полимеризоваться: Qпол = -ΔH= -3.3 ккал/моль, ΔS = -2.5 энт. ед, Тпред ≈ 1300К).
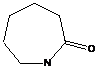 - капролактам
- капролактам
(способен полимеризоваться: Qпол = -ΔH = 3,3 ккал/моль, ΔS = -4 энт. ед, Тпред ≈ 830К).
Более крупные циклы с включением гетероатомов легко полимеризуются:
 - гексаметилциклооктасилоксан
- гексаметилциклооктасилоксан
(легко полимеризуется: Qпол = -ΔH = -1,5 ккал/моль, ΔS = 46 энт. ед, полимеризация разрешена во всей области температур).
Термодинамически возможная степень превращения мономера в полимер рассчитывается по формуле:
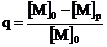 , (6.1)
, (6.1)
где [M]p – равновесная концентрация мономера, [M]0 – начальная концентрация мономера
Если [M]p=[M]0, то мономер полимеризоваться не будет; если [M]p >[M]0, то реакция не пойдет образующийся полимер будет термодинамически нестабильным.
Итак, выяснено, что существует область, в которой возможно протекание реакции, которая ограничивается предельными температурами (верхней или нижней). Следует также учесть, что мономеры и полимеры могут находиться в разных фазовых состояниях, это будет также влиять на термодинамические ограничения. Помимо этого полимеризация может проводиться в растворе, это также влияет на диапазон температур, в котором может проводиться полимеризация.
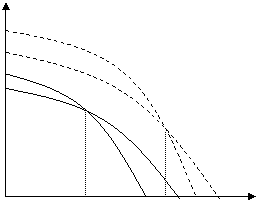 Μ Мж
Μ Мж
Пж
(Мж)р
(Пж)р
Тпр (в р-ре) Тпрр (в массе) Т
Рис. 6.1. Зависимость термодинамического потенциала от температуры при растворении
При растворении термодинамические потенциалы как мономера, так и полимера понижаются (самопроизвольные процессы). При этом точка пересечения кривых μ = f(T), т. е. Тпр может понизиться.
Влияние различных факторов на возможность протекания полимеризации:
1) Влияние давления на протекание полимеризации определяется зависимостью:
 , (6.2)
, (6.2)
где![]() - парциальный мольный объем
- парциальный мольный объем
Рассматривая эту зависимость для мономера и полимера, можно получить зависимость предельной температуры от давления, которая имеет вид (аналог уравнения Клаперона-Клаузиуса):
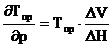 (6.3)
(6.3)
Где ∆V – разность объемов мономера и полимера, ∆Н – разность соответствующих энтальпий.
Таким образом, изменяя давление, можно изменить значение предельной температуры. Однако, требуется значительное изменение давления, чтобы существенно изменить предельную температуру.
В случае α-метилстирола при переходе от давления в 1 до 6500 бар Тпр возрастает от 61 ◦С до 170 ◦С.
2) Влияние кристаллизации полимера:
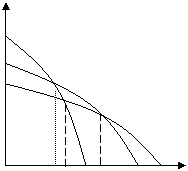 Μ
Μ
М
Пам
Пкр
Тпр Тпркр Тппл Т
Рис. 6.2. Зависимость термодинамического потенциала от температуры при кристаллизации полимера
При кристаллизации изменение энтропии отрицательно и в соответствии со схемой Тпр повышается. Благодаря этому фактору удается осуществлять полимеризацию формальдегида при умеренных температурах, т. к. образующийся полиформальдегид кристаллизуется.
Для определения величин ΔHпол и ΔSпол можно использовать различные приемы, простейший путь основан на измерениях равновесной концентрация мономера в зависимости от предельной температуры:
 , (6.4)
, (6.4)
откуда 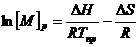 (6.5)
(6.5)
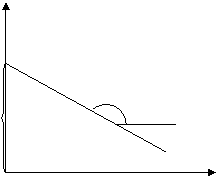 |
ln[M]p
-ΔS/R
ΔH/R
1/Tпр
Рис. 6.3. Зависимость ln[M]p от 1/Tпр
Таким образом, из зависимости ln[M]p от 1/Tпр можно определить величины ∆Нпол и ∆Sпол.
6.1. Термодинамика поликонденсации
В процессе поликонденсации происходит химическое взаимодействие низкомолекулярных молекул a-R-b (группы a и b взаимодействуют между собой), приводящее к образованию удлиненных цепочек, т. е. к образованию олигомерных или полимерных молекул. Кроме того, могут образовываться циклы. Процесс поликонденсации часто происходит с выделением низкомолекулярного продукта (w).
Реакцию поликонденсации можно записать в виде:
![]() n a-R-b a-(R-X)n-1-R-b + (n-1)w
n a-R-b a-(R-X)n-1-R-b + (n-1)w
Поликонденсация может также быть бимолекулярной, когда конденсируются молекулы типа a-R-a или b-R-b.
Правило Ругли-Циглера:
Если процесс поликонденсации протекает при повышенных концентрациях мономера, то образуются линейные полимеры; при малых концентрациях мономера образуются циклы.
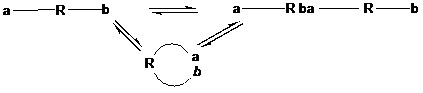
При достижении равновесного превращения мономера, состояние систем можно рассматривать как равновесие: линейный продукт↔циклический продукт конденсации (т. е. полимеризационное равновесие цикл – цепь). При этом равновесное содержание циклических форм можно определить как qцикл= [M]равн/[M]0. С уменьшением [M]0 qцикл растет и стремиться к 1 при [M]0→[M]равн.
Рассмотрим поликонденсацию с образованием линейных цепей:
![]() a-R-b + a-R-b a-R-ba-R-b + w
a-R-b + a-R-b a-R-ba-R-b + w
![]() M2 + a-R-b M3 + w
M2 + a-R-b M3 + w
………………………………….
![]() Mn-1 + a-R-b Mn + W
Mn-1 + a-R-b Mn + W
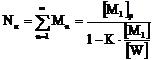 (6.1.1)
(6.1.1)
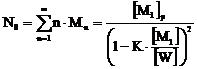 (6.1.2)
(6.1.2)
Получаем:
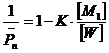 , (6.1.3)
, (6.1.3)
если n>>1, то ![]() (6.1.4)
(6.1.4)
В это уравнение также как и в уравнение для полимеризационно-деполимеризационного равновесия входят концентрации только низкомолекулярных веществ, а концентрация полимера не входит. Характер равновесия процесса поликонденсации - квазигетерогенный.
Химия образования макромолекул
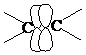 - имеется молекула с кратной связью, рассмотрим возможные пути активации для ее раскрытия.
- имеется молекула с кратной связью, рассмотрим возможные пути активации для ее раскрытия.
Пути активации:
1. активация с помощью свободных радикалов:
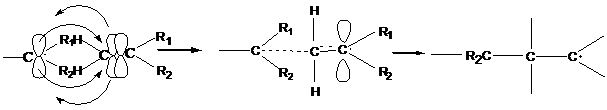 |
образуется промежуточный квазиаллильный радикал
На рисунке 6.1.1. изображена зависимость потенциальной энергии от расстояния: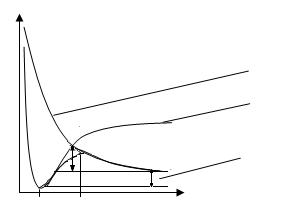
U
- кривая отталкивания
- кривая притяжения
Еа - Qпол (тепловой эффект)
r0 r* r
Рис. 6.1.1. Зависимость потенциальной энергии от расстояния
Еа – энергия, необходимая для образования переходного состояния («квазиаллильного» радикала) – энергия активации, r* - переходный комплекс.
2. активация с помощью карбкатиона:
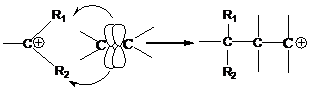
3. активация с помощью карбаниона:
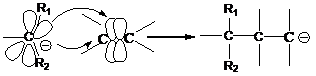
Итак, получаем, что существует 3 типа воздействия на кратную связь:
· воздействие свободных радикалов (радикальная полимеризация);
· воздействие катионов (катионная полимеризация);
· воздействие анионов (анионная полимеризация).
Вопросы для самостоятельной проработки:
Как влияет наличие гетероатома в циклах, состоящих из атомов углерода, на реакцию полимеризации? Как рассчитывается термодинамически возможная степень превращения полимера в мономер? Какие существуют факторы, влияющие на возможность протекания полимеризации? В чем заключается правило Ругли-Циглера для процесса поликонденсации? Какие пути образования макромолекул известны в настоящее время?Задачи для самостоятельного решения
3. Методы получения и структура основных типов полимеров
3.2. Термодинамика полимеризации
Вопросы 2501 – 2505, 2406 – 2409, 2310 – 2313
Раздел №7. Радикальная полимеризация
Радикальная полимеризация – полимеризация, инициированная свободными радикалами, генерируемыми в реакционной среде.
Элементарные реакции радикальной полимеризации:
1. Инициирование радикалов
2. Рост цепи
3. Бимолекулярный обрыв цепи
4. Передача цепи
5. Ингибирование
7.1. Мономеры, способные вступать в реакции радикальной полимеризации
В реакции радикальной полимеризации способны вступать мономеры винилового ряда (идет раскрытие связи С=С):
1) ![]() - этилен
- этилен
2) монозамещенные этилена:

в качестве радикала R могут быть различные группировки:
-Cl, - Br, - F, - Ph, - CN, - COOH, COOR, - CНO, 
- C(O)NH2 и некоторые другие группы.
3) дизамещенные этилена:
![]()
в качестве R1 и R2 могут быть те же группы атомов, что и в случае (2)
4) тризамещенные этилена:
![]()
радикальная полимеризация данных мономеров обычно происходит сложно из-за возникающих стерических затруднений
5) четырехзамещенные этилена:
![]()
полимеризация затруднена, она может и не происходить.
К гомополимеризации способны мономеры с малыми по размерам заместителями (например, тетрафторэтилен полимеризуется хорошо).
Кроме того, все, в том числе трех - и четырехзамещенные, мономеры в реакциях сополимеризации могут вступать как сомономеры.
6) некоторые циклические структуры:
обычно вступают в реакции как сомономеры, гомополимеризации обычно не происходит.
Пример:
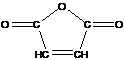 - ангидрид малеиновой кислоты не способен к гомополимеризации, но легко сополимеризуется.
- ангидрид малеиновой кислоты не способен к гомополимеризации, но легко сополимеризуется.
7) мономеры диенового ряда (бутадиен и его производные):
![]() -бутадиен
-бутадиен
Может происходить 1,2-, 3,4- и 1,4-присоединение мономера.
 -изопрен
-изопрен
1,2- и 3,4- связи в этом случае неравноценны.
Кроме этого, возможно 1,4-присоединение. В этом случае образуются 2 типа структур – цис - и транс-структуры. Существенно расширяются возможности синтеза разнообразных соединений, селективность реакции невысока.
8) некоторые соединения, содержащие несопряженные двойные связи:
![]() - дивиниловый эфир
- дивиниловый эфир
Полимеризация диметилаллиламмоний хлорида идет с образованием цикла:
9) раскрытие радикалами связей С=О, C=S, ![]() не происходит.
не происходит.
10) в процессах радикальной полимеризации также редко происходит раскрытие циклов, исключение составляют системы:
а) в циклах, где двойная связь сопряжена со связью в напряженном цикле:

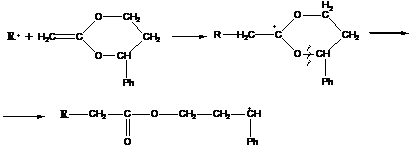
идет разрыв связи, сопряженной с фенильной группой в цикле, образовавшийся радикал атакует далее следующий мономер по концевой CH2- группе.
б) с очень неустойчивыми циклами:
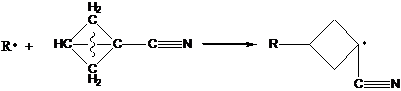
11) соединения ацетиленового ряда практически не участвуют в реакциях радикальной полимеризации.
7.2. Инициирование (образование свободных радикалов)
Стадия инициирования – это стадия образования свободных радикалов.
В общем виде стадию инициирования представляют следующим образом:
![]()
Соединения, способные образовывать свободные радикалы:
1. Перекисные соединения (пероксиды):
![]()
т. е. имеющие в своем составе пероксидную группу
Примеры инициаторов этого класса:
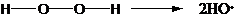 - пероксид водорода
- пероксид водорода
Распад идет при температурах выше 60˚С.
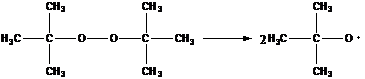
- третбутилпероксид
распад идет при температурах, больших 100˚С.
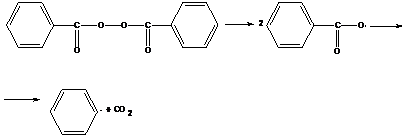
-перекись бензоила
распад идет при 60˚С
Бензоильный радикал может дальше распадаться с образованием фенильного радикала.
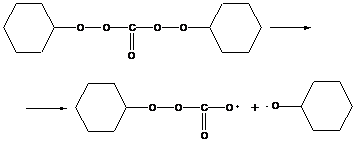
- дициклогексилпероксодикарбонат
распад идет выше 30˚С
сложный радикал циклогексилпероксокарбоната распадается далее с выделением CO2
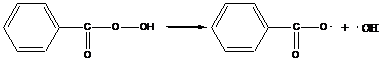
- гидроперекись бензойной кислоты
далее идет распад образовавшегося радикала:
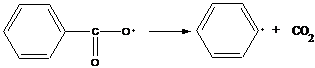
2. Соединения, имеющие в своем составе азогруппу
Распад протекает по схеме:
![]()
т. е. распад протекает необратимо, в этом процессе выделяется азот.
Примеры инициаторов этого класса:
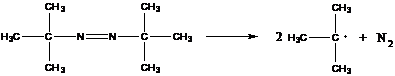
- динитрил азоизомасляной кислоты
распад идет при 50-60˚С
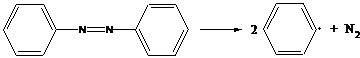
- азобензол
соединение термически устойчиво и распад происходит фотохимически.
7.3. Скорость инициирования. Факторы, влияющие на скорость инициирования
Скорость инициирования представляет собой скорость распада с учетом эффективности инициирования:
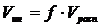 , (7.3.1)
, (7.3.1)
где f – эффективность инициирования – выражается в долях (т. е. 0<f<1)
Инициатор считается хорошим, если f > 0.5.
Скорость распада, в свою очередь, зависит от концентрации инициатора:
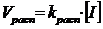 , (7.3.2)
, (7.3.2)
поэтому выражение для скорости инициирования принимает вид:
 (7.3.3)
(7.3.3)
7.4. Влияние температуры на ход процесса. Эффект клетки.
Константа скорости распада зависит от температуры по уравнению Аррениуса:
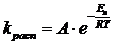 (7.4.1)
(7.4.1)
Повышение температуры увеличивает скорость инициирования, поэтому часто имеем дело с активацией инициаторов путем создания определенной температуры (происходит термический распад инициатора).
Однако скорость распада не должна быть слишком большой, чтобы вести процесс в изотермических условиях, т. к. происходит выделение тепла как при распаде инициатора (распад является экзотермическим процессом), так и при реакции роста цепи. Из-за этого обстоятельства концентрация инициатора не должна быть слишком большой.
Энергия активации термического распада обычно высокая (~30 ккал/моль), поэтому интервал температур, при которых распад инициаторов происходит с удобными скоростями, довольно узок и оптимальная температура определяется природой инициатора.
Обратным процессу распада является процесс рекомбинации образовавшихся в системе радикалов.
Рекомбинация может протекать в окружении молекул мономера, образовавшегося полимера или растворителя. Это явление называется эффектом клетки. Радикалы, находящиеся внутри клетки, могут выйти из нее путем диффузии через стенку клетки, либо присоединиться к стенке. Если среда вязкая, то стенки клетки будут прочнее, молекуле труднее выйти за ее пределы. Если стенка клетки образована молекулами полимера, то необходимо повысить температуру, чтобы реакция протекала лучше.
Кроме того, повышение температуры благоприятствует процессу диффузии, что также улучшает ход реакции.
Таким образом, повышение температуры благоприятствует протеканию процесса инициирования в любом случае. Однако при высоких температурах полимеры часто разрушаются, поэтому применение высоких температур ограничено. Обычно стараются процесс радикальной полимеризации проводить в интервале температур 0÷100˚С.
7.5. Окислительно-восстановительные реакции инициирования
Окислительно-восстановительные реакции (ОВР) часто используют для улучшения протекания образования свободных радикалов. ОВР позволяют снизить энергию активации и проводить процесс полимеризации при пониженных температурах.
Примеры использования ОВР:
а)
![]() (1)
(1)
![]() (2)
(2)
![]() (3)
(3)
ион Fe2+ инициирует цепной распад Н2О2
Однако, в присутствии мономера, являющегося сильным акцептором радикала, реакции (2) и (3) подавляются.
![]()
Энергия активации инициирования при использовании ОВР (по сравнению с термораспадом инициатора) снижается примерно в 2-5 раз, реакции при умеренных температурах идут существенно быстрее.
Кроме того, в данном процессе образуется 1 радикал, а не 2, вероятность рекомбинации снижается, а эффект клетки отсутствует.
б)
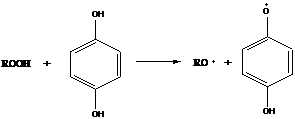
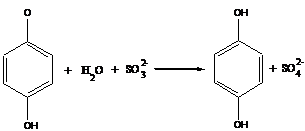
в приведенном процессе гидрохинон возвращают в цикл с помощью сульфит-ионов, это позволяет снизить количество гидрохинона, добавляемого в систему.
7.6. Инициирование под действием различных излучений
Под действием различных излучений некоторые вещества способны распадаться, образуя свободные радикалы.
· Радиационная химия:
![]() - может идти инициирование под действием γ-излучения.
- может идти инициирование под действием γ-излучения.
· Фотохимия:
Инициирование осуществляется при облучении видимым или ультрафиолетовым светом:
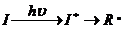
Энергия излучения, при которой происходит образование радикалов, должна быть больше энергии разрыва связей.
Разрыв связи дает только тот квант, который поглощен молекулой. Таким образом, молекула должна поглощать излучение данной области спектра.
Скорость инициирования в этом случае зависит от интенсивности падающего света:
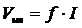 , (7.6.1)
, (7.6.1)
где I – интенсивность излучения.
Есть группа соединений, не имеющих связей, способных к разрыву, но, поглотив энергию, они передают ее другим соединениям, сами при этом не распадаясь. Эти соединения называются сенсибилизаторами.
Общая схема действия сенсибилизаторов:
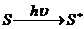
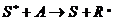
идет перенос энергии с образованием свободных радикалов и таким образом осуществляется акт инициирования.
Пример сенсибилизатора:
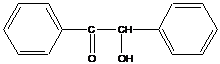 бензоин
бензоин
Энергия активации фото - и радиационного инициирования равна 0.
Вопросы для самостоятельной проработки:
1. Назовите элементарные реакции радикальной полимеризации.
2. Какие мономеры способны вступать в реакцию радикальной полимеризации?
3. Какие вещества способны образовывать свободные радикалы на стадии инициирования? Приведите примеры.
4. Перечислите факторы, влияющие на скорость инициирования.
5. В чем заключается «эффект клетки»?
6. Каковы преимущества применения окислительно-восстановительного инициирования?
7. Как виды излучений применяют для инициирования радикальной полимеризации?
Задачи для самостоятельного решения
3. Методы получения и структура основных типов полимеров
3.1. Виды полимеризации. Инициирование и ингибирование полимеризации
Вопросы 1502 – 1505, 1411 – 1412, 1314 – 1315
Раздел №8. Радикальная полимеризация
8.1. Рост цепи
Рост цепи протекает по следующей схеме:
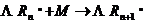
1) Присоединение растущей цепи к мономеру может осуществляться различными способами:
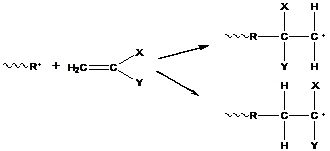
X, Y – заместители
В приведенном случае большое значение имеет сопряжение концевой группы R с атомами водорода или заместителями. В первом случае возможны стерические затруднения, если заместители и концевая группа имеют достаточно большой объем. Во втором случае присоединения происходит больший выигрыш энергии.
Из-за приведенной выше причины присоединение по типу "голова-хвост-голова-хвост" идет предпочтительней, чем "голова-голова-хвост-хвост". Только в случае, когда имеем маленькие заместители (или сопряжение мало) возможно образование структур "голова-голова-хвост-хвост". Подобное присоединение обнаруживается в случае мономеров с мало сопряженными и не создающими стерических затруднений заместителями (например, винилацетат). 
Структура «голова-голова» и в поливинилацетате и в получаемом из него поливиниловом спирте являются химическими дефектами, ухудшающими свойства полимера. Их количество в цепях растет с повышением температуры полимеризации.
2) При наличии нескольких мономеров может происходить сополимеризация, т. е. полимеризация, в результате которой образуется полимер, состоящий как из звеньев, образованных одним мономером, так и из звеньев, образованных другими мономерами.
3) Стереорегулярность.
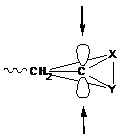 Как исходный мономер, так и концевое звено (конец растущего радикала) имеют плоскую конформацию, т. е. не имеют определенной пространственной конфигурации. При присоединении следующей молекулы мономера, т. е. при удлинении цепочки в этом звене создается псевдоасимметрический атом углерода.
Как исходный мономер, так и концевое звено (конец растущего радикала) имеют плоскую конформацию, т. е. не имеют определенной пространственной конфигурации. При присоединении следующей молекулы мономера, т. е. при удлинении цепочки в этом звене создается псевдоасимметрический атом углерода.
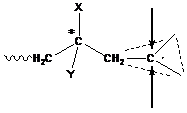 Как это происходит? Мономер может "атаковать" радикал с любой стороны, и при этом образуются или R - или S- стереоизомеры. Если бы радикал присоединял мономер только с «одной стороны», то образовывался полимер стереорегулярного строения. В этом случае образуются изотактические полимеры со строго упорядоченной структурой RRRRRR или SSSSSS.
Как это происходит? Мономер может "атаковать" радикал с любой стороны, и при этом образуются или R - или S- стереоизомеры. Если бы радикал присоединял мономер только с «одной стороны», то образовывался полимер стереорегулярного строения. В этом случае образуются изотактические полимеры со строго упорядоченной структурой RRRRRR или SSSSSS.
Если атака мономера реализуется регулярно то с одной, то с другой стороны, то образуется синдиотактический полимер, т. е. полимер с чередующимся строением RSRSRS.
Если присоединение происходит хаотично, то и звенья R - и S - входят в цепь беспорядочно, и образуются атактические полимеры RSRRSSRSSR.
Рассмотрим радикальную полимеризацию дивинилового мономера.
При атаке молекулы радикалом образуется следующая структура:
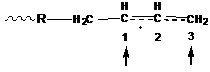
Эта структура является аллильным радикалом, в котором электронная плотность неспаренного электрона распределена примерно поровну между 1 и 3 атомами углерода. В зависимости от направления атаки (1 или 3 атом углерода) и строения переходного комплекса осуществляется 1,2-присоединение и 1,4-присоединение, образование цис - и транс-структур, изо-, синдио - или атактических полимеров.
Чаще всего полимеры, полученные радикальной полимеризацией, нестереорегулярны.
8.2. Обрыв цепи
Обрывом цепи называется реакция гибели активного центра.
Обрыв цепи может происходить по различным механизмам.
1. Бимолекулярный обрыв цепи
Бимолекулярный обрыв цепи – это реакция взаимодействия двух растущих макрорадикалов между собой:
 - рекомбинация
- рекомбинация
или
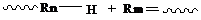
Скорость реакции обрыва зависит от концентрации радикалов в системе:
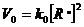 (8.2.1)
(8.2.1)
Рассмотрим факторы, влияющие на константу обрыва.
Скорость процесса определяется диффузией, т. е. в отличие от других реакций радикальной полимеризации, которые являются кинетически контролируемыми реакциями, реакции бимолекулярного обрыва являются диффузионно-контролируемыми. Макрорадикалам нужно сблизиться и развернуться в нужном направлении (2 стадии).
 |
Лимитирующей стадией является не поступательная диффузия клубка, а диффузия конца цепи. Таким образом, константа обрыва в разбавленных растворах полимера не зависит от длины цепи.
Суммарная скорость реакции обрыва выражается следующим образом:
 (8.2.2)
(8.2.2)
Константа обрыва является большой величиной: k0≈107÷108, реакция протекает быстро.
В области высоких конверсий, когда реакционная среда фактически является концентрированным раствором полимера, скорость бимолекулярного обрыва резко падает и становится зависящей от длины макрорадикала.
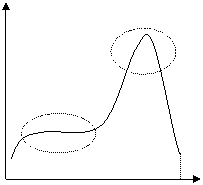
При этом наблюдается резкое ускорение полимеризации, получившее название гель-эффекта:
![]()

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 |




