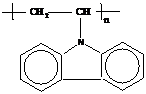![]() Vp М
Vp М
 - область гель-эффекта
- область гель-эффекта
 |
![]() - период стационарной скорости
- период стационарной скорости
100 q, %
q – степень превращения
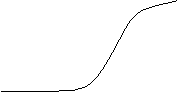
Рис. 8.2.1. Гель-эффект
При этом существенно возрастает и молекулярная масса образующегося полимера. Интенсивность гель-эффекта зависит от физико-химических свойств концентрированных растворов полимеров в собственном мономере.
2. Ингибирование
В этом случае обрыв происходит в результате взаимодействия растущего радикала с низкомолекулярным соединением:
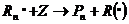
Низкомолекулярное соединение, которое, взаимодействуя с макрорадикалами, приводит к их гибели, называется ингибитором.
К ингибиторам могут относиться следующие классы веществ:
а) стабильные радикалы
Примеры:
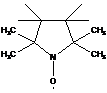 -N-оксидный радикал (в этом случае важно, чтобы объемные группы защищали от соединения двух N-оксидных радикалов).
-N-оксидный радикал (в этом случае важно, чтобы объемные группы защищали от соединения двух N-оксидных радикалов).
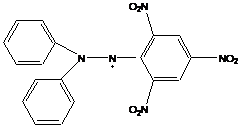
- дифенилпикрилгидразин
б) ароматические многоядерные молекулы
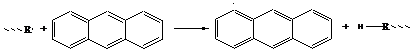
-образуется малоактивный радикал
в) хиноны

г) нитросоединения
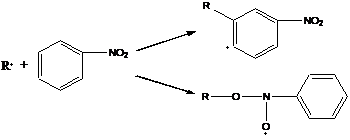
д) нитрозосоединения
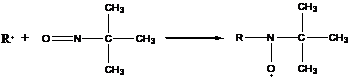
образовавшийся в результате реакции аддукт очень стабилен.
е) ионы переменных валентностей, образованные атомами в высоких степенях окисления (Fe3+, Cu2+).
![]()
![]()
ж) некоторые элементы
О2, S, J2
Кислород:
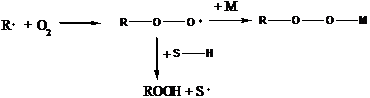
В последнем случае реакция может пойти в двух направлениях: может идти реакция с отрывом водорода и может идти реакция присоединения мономера к R-O-O• радикалу, если мономер достаточно активен. В этом случае получаются полимерные перекиси, образуется нестабильный полимер (по этой причине реакции радикальной полимеризации желательно проводить без доступа воздуха – работать либо в среде инертного газа, либо под вакуумом). В некоторых процессах кислород используется в строго дозирующихся количествах, например, в производстве полиэтилена для инициирования процесса и регулирования ММ образующегося полимера.
Сера:
Под действием радикала сера способна раскрывать свой цикл
![]()
образуется сополимер, содержащий серу
Йод:
![]()
образуются йодалкилы и радикалы йода, которые могут далее атаковать мономер или рекомбинировать.
8.3. Передача цепи
Передача цепи происходит по следующему механизму:
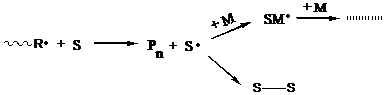
Далее может идти реакция гибели радикалов (рекомбинации), либо в присутствии мономера реакция, называемая реакцией передачи цепи (на схеме – верхняя реакция).
В результате скорость процесса не меняется, т. к. количество радикалов в системе не меняется, но происходит снижение молекулярной массы полимера; этим методом можно уменьшать (регулировать) молекулярные массы образующихся полимеров.
Примером соединений, способных к передаче цепи, являются соединения, имеющие подвижные атомы водорода:
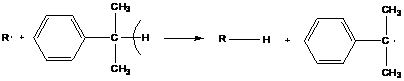
- происходит отщепление атомов водорода с образованием устойчивых радикалов.
В роли подобных соединений могут выступать и сами мономеры:
|
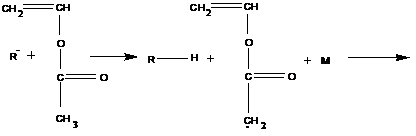
активный радикал
|

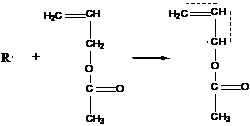 - происходит образование стабильного аллильного радикала. Образующийся радикал (1) далее вступает в реакцию (самопередача цепи). Если же, как, например, в случае аллилацетата (2), радикал малоактивен и практически не вступает в реакцию с новой молекулой мономера. Это называется деградационной передачей цепи.
- происходит образование стабильного аллильного радикала. Образующийся радикал (1) далее вступает в реакцию (самопередача цепи). Если же, как, например, в случае аллилацетата (2), радикал малоактивен и практически не вступает в реакцию с новой молекулой мономера. Это называется деградационной передачей цепи.
Передача цепи идет и в реакции с меркаптанами:
![]()
Эта реакция идет с высокой эффективностью, и, введением малых количеств передатчика удается понижать (регулировать) молекулярную массу полимеров.
С помощью некоторых передатчиков цепи можно синтезировать новые соединения с определенными концевыми группами (теломеры). Примером служит полимеризация в присутствии ССl4:
![]()
Далее радикалы вступают в реакцию, получаем олигомеры (теломеры) состава CCl3(M)nCl, длину которых можно варьировать. Гидролизом полученных соединений можно получать ценные продукты состава
![]() .
.
Таким образом, можно получать соединения с определенными концевыми группами и имеющими определенную длину.
8.4. Кинетика реакций радикальной полимеризации
Скорость процесса радикальной полимеризации представляет собой скорость роста цепи:
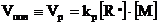 (8.4.1)
(8.4.1)
Непосредственно концентрацию радикалов измерить сложно, т. к. она очень мала. Поэтому необходимо выразить скорость процесса через другие величины.
Скорость цепного процесса равна:
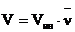 , (8.4.2)
, (8.4.2)
где Vин – скорость инициирования, а ![]() - длина кинетической цепи, т. е. количество молекул мономера, присоединенных к радикалу в единицу времени
- длина кинетической цепи, т. е. количество молекул мономера, присоединенных к радикалу в единицу времени

ν = kp ∙ [M] ∙ τ (8.4.3)
τ – время жизни радикала, оно обратно пропорционально скорости его гибели:
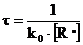 (8.4.4)
(8.4.4)
Получаем:
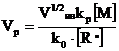 (8.4.5)
(8.4.5)
Выразим концентрацию радикалов из соотношения (8.4.1) и подставим в (8.4.5):
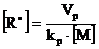 (8.4.6)
(8.4.6)
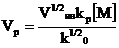 (8.4.7)
(8.4.7)
Это выражение для стационарной начальной скорости радикальной полимеризации. Уравнение для молекулярной массы получаемого полимера аналогично получаем в виде:
![]()
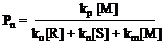 (8.4.8)
(8.4.8)
Комбинируя эти выражения, получаем основное уравнение стационарной радикальной полимеризации:
![]()
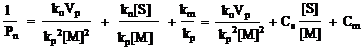 (8.4.9)
(8.4.9)
где СS и СМ – константы передачи цепи на растворитель и мономер.
Построив зависимость:
![]() (8.4.10)
(8.4.10)

![]()
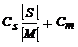
![]()
Рис. 8.4.1. График зависимости 1/Pn от V/[M]2
по тангенсу наклона получаем величину:
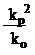 ,
,
а по отрезку на оси ординат – параметры процессов передачи цепи.
Вопросы для самостоятельной проработки:
1. Назовите особенности реакции роста цепи при радикальной полимеризации.
2. Чем определяется стереорегулярность полимеров, полученных радикальной полимеризацией?
3. Какие механизмы обрыва цепи существуют?
4. Каким фактором определяется скорость реакции обрыва цепи при радикальной полимеризации?
5. Что такое гель эффект?
6. Дайте определение понятия ингибитор. Приведите примеры.
7. В чем заключается реакция передачи цепи при радикальной полимеризации?
8. Как можно определить степень полимеризации из кинетических данных?
Задачи для самостоятельного решения
3. Методы получения и структура основных типов полимеров
3.1. Виды полимеризации. Инициирование и ингибирование полимеризации
Вопросы 1501, 1408 – 1410,1313, 1319
3.3. Основное уравнение радикальной полимеризации
Вопросы 3501 – 3505, 3406 – 3412, 3313 – 3317
Раздел №9. Ионная полимеризация. Катионная полимеризация.
Ионная полимеризация – реакция полимеризации, инициаторами которой являются ионы или поляризованные частицы. Ионную полимеризацию подразделяют на анионную и катионную, инициаторами которых являются, соответственно, анионы или катионы. Кроме того, существует координационно-ионная полимеризация.
Схематически ионную полимеризацию можно изобразить следующим образом:
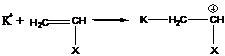 - катионная полимеризация
- катионная полимеризация
 - анионная полимеризация
- анионная полимеризация
9.1. Общие черты у радикальной и ионной полимеризации
И те и другие процессы протекают по цепному механизму:
Имеется стадия инициирования цепи
![]() ,
,
стадия роста цепи
![]()
…………………….
и стадия обрыва цепи
![]()
Во многих случаях реакции ионной полимеризации могут протекать и без стадии обрыва цепи.
9.2. Особенности ионной полимеризации по сравнению с радикальной полимеризацией
1. Избирательность мономеров к процессам ионной полимеризации
Существует определенная избирательность мономеров: некоторые мономеры способны вступать в реакции и катионной и анионной полимеризации, некоторые только в одну из этих реакций.
Избирательность мономеров объясняется влиянием группы Х при двойной связи – возможен положительный индуктивный эффект (если заместитель электронодонорный) и отрицательный индуктивный эффект (если заместитель электроноакцепторный).
Если заместители электронодонорные, то соединение будет взаимодействовать с катионами, возможен процесс катионной полимеризации
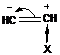
Если заместители электроакцепторные, то соединение будет взаимодействовать с анионами, возможен процесс анионной полимеризации
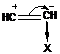
Так, виниловые эфиры активны в катионной полимеризации (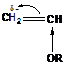 ), а акрилонитрил в анионной полимеризации (
), а акрилонитрил в анионной полимеризации (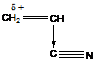 ). Стирол (
). Стирол (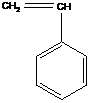 ) оказывается активным и в катионной, и анионной полимеризации.
) оказывается активным и в катионной, и анионной полимеризации.
Активность мономера определяется также стабилизационным (резонансным) эффектом заместителя.
Т. о. избирательность полимеризации мономера зависит от типа заместителя, его влияния на двойную связь, распределения электронной плотности (табл.9.2.1).
Таблица 9.2.1.
Примеры полимеризации различных ненасыщенных мономеров
Мономер | Тип инициирования | ||
Радикальный | Анионный | Катионный | |
1. Этилен | + | + | + |
2. 1-Алкилолефины (α-олефины) (пропилен) | - | - | + |
3. 1,1-Диалкилолефины (изобутилен) | - | + | * |
4. Диены-1,3 (бутадиен, изопрен) | + | + | + |
5. Стирол, α-метилстирол | + | + | + |
6. Галогениро-ванные олефины (винилхлорид, винилиденхлорид) | + | - | - |
7. Сложные виниловые эфиры (винилацетат CH2 = CHOCOR) | + | - | - |
8. Акрилаты, метакрилаты | + | + | - |
9. Акрилонитрил, метакрилонитрил | + | + | - |
10. Акриламид, метакриламид | + | - | - |
11. Простые виниловые эфиры (винилэтиловый эфир) | - | - | + |
12. N-Винилкарбазол
| + | - | + |
13. N-Винилпирролидон
| + | - | - |
14. Альдегиды, кетоны | - | + | + |
2. Активные центры (ионы) могут существовать в процессах ионной полимеризации в различных формах:
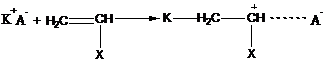
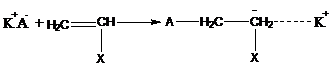
на конце наряду с ионом находится противоион, образуется ионная пара – (карбкатион + анион) или (карбанион + катион).
Могут существовать различные варианты взаимодействия карбкатиона и аниона. Если взаимодействие сильное, то образуется ионная пара: К+А-
При введении полярного растворителя можем получить сольватно-разделенную ионную пару или разделенные ионы:
![]() - сольватно-разделенная пара
- сольватно-разделенная пара
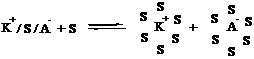 - разделенные ионы
- разделенные ионы
![]()
![]()
![]()
![]()
![]()

![]()
![]()
где S – молекула растворителя,
![]()
![]() - поляризованная связь,
- поляризованная связь,
![]() - контактная ионная пара,
- контактная ионная пара,
![]() - сольватно-разделенная ионная пара,
- сольватно-разделенная ионная пара,
![]()
![]() - свободные ионы.
- свободные ионы.
В реакциях радикальной полимеризации рост цепи не зависит от инициирующего радикала, а зависит только от реакционной способности мономера и радикала, в ионной полимеризации на протекание процесса влияет как реакционная способность молекулы мономера, так и состояние активного центра роста цепи.
Ионная полимеризация обычно протекает очень быстро (иногда реакция может пройти за несколько секунд). Это является как следствием высокой константы роста цепи, так и высокой концентрации активных центров вследствие отсутствия бимолекулярного обрыва цепи.
3) Инициаторы ионной полимеризации не только формируют активные центры, но и оказывают существенное влияние на константы роста цепи, на строение цепей, на обрыв цепи.
4) Кинетика ионной полимеризации и строение образующихся полимеров сильно зависят от природы среды. Обычно чем больше полярность среды, тем выше скорость процесса.
В радикальной полимеризации среда практически не влияет на скорость полимеризации, влияет лишь на ММ образующегося полимера.
Ионная полимеризация может протекать как в полярной, так и в неполярной среде.
Многие реакции ионной полимеризации протекают без обрыва кинетической и материальной цепи, могут образовываться т. н. "живые" полимеры.
При этом можно получать полимеры с узким ММР, количество цепей определяется количеством добавленного катализатора. Таким образом, возможно получение практически монодисперсных полимеров. Добавлением другого мономера можно получать блок-сополимеры.
5) Энергия активации обычно ниже, чем для радикальной полимеризации. Многие реакции имеют отрицательный температурный коэффициент (т. е. с понижением температуры скорость реакции может увеличиваться).
6) Для многих процессов ионной полимеризации характерно образование полимеров, имеющих регулярное и стереорегулярное строение.
9.3. Катионная полимеризация
В процессе катионной полимеризации инициатором процесса являются катионы. Поэтому в процесс вступают мономеры с кратной связью С=С, имеющие избыточную электронную плотность на двойной связи,
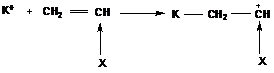
Образующийся катион стабилизируется электронодонорным действием заместителя и сопряжением с ним. Поэтому активными мономерами в катионной полимеризации будут:
изобутилен

стирол
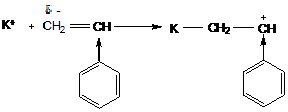
α-метилстирол
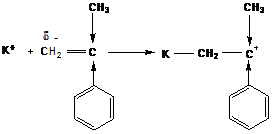
виниловые эфиры
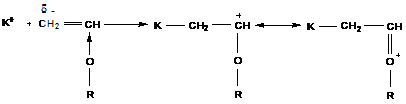
Не полимеризуются мономеры с электроно-акцепторными заместителями  ,
, ![]() ,
,  или в тех случаях, когда атака катиона направляется не на двойную связь, а на другую группу, например
или в тех случаях, когда атака катиона направляется не на двойную связь, а на другую группу, например
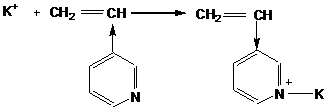
В процесс катионной полимеризации также вступают соединения с кратными связями ![]() ,
, ![]() ,
, 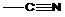 .
.
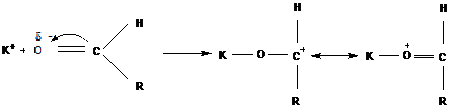
Образующийся катион стабилизируется вследствие наличной резонансной структуры «ониевого»
типа
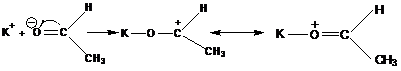
Не полимеризуются  ,
, 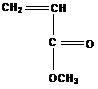
В катионную полимеризацию вступают большое количество циклических мономеров.
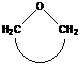
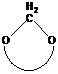
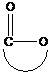
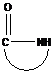

окиси циклически ацетали лактоны лактамы имины циклические амины
циклические эфиры
Могут существовать различные варианты атаки катиона на молекулу мономера:
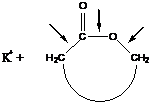
Чтобы определить место атаки катиона, необходимо сравнить стабильность образующихся продуктов. Это поможет определить строение получающегося полимера.
В случае лактона местом атаки является атом ![]() .
.
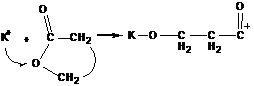
После раскрытия цикла образуется стабильный катион, способный атаковать следующие молекулы мономера с раскрытием цикла.
В случае циклических ацеталей:
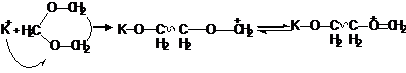
Стабилизация катиона, получаемого после раскрытия цикла, согласно вышеприведенной схеме, осуществляется благодаря тому, что его можно рассматривать как оксониевый ион.
В случае циклических эфиров и окисей олефинов, тиоэфиров и циклических иминов:
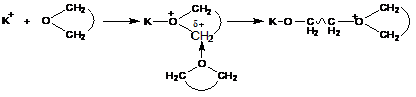

Стабилизированной формой является ониевый (оксониевый) или аммониевый катион. Рост цепи осуществляется при его атаке следующей молекулой мономера с регенерацией ониевого катиона.
Полимеризуются по катионному механизму и полициклические мономеры.
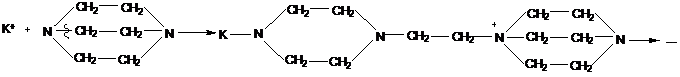

9.3.1. Инициаторы (катализаторы) катионной полимеризации
1. Протонные кислоты: H2SO4, H3PO4, CF3COOH, HCl, НСlO4;
2. Кислоты Льюиса: BF3, AlCl3, AlBr3, SnCl4, ZnCl2; - при этом используют сокатализаторы: H2O, ROH, RCl;
3. Галогены и межгалогенные соединения: J2, JBr, JCl, ...
4. Ониевые соли: R3O+X-,  .
.
Рассмотрим, как будет идти процесс полимеризации при использовании различных кислот.
а) Протонные кислоты:
HBr, HFSO3, H2SO4, HClO4
Сила кислот в приведенном ряду возрастает от бромоводородной к хлорной кислоте.
Критерием, по которому сравнивают влияние различных кислот на ход процесса, является эффективное отношение константы роста к константе обрыва:
Таблица 9.3.1.1.
Значения эффективного отношения константы роста к константе обрыва
для различных кислот
Кислота | HBr | HFSO3 | H2SO4 | HClO4 |
(Кр/Ко)эф | 30 | 500 | 800 | 20000 |
С увеличением силы кислоты или с уменьшением нуклеофильности аниона вероятность обрыва цепи значительно снижается.

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 |