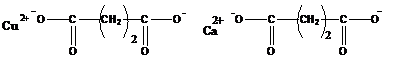· органические полимеры (в состав входят органогенные элементы – С, N, O, P, S).Делятся на гомоцепные (в основной цепи содержатся только атомы углерода) и гетероцепные (в состав основной цепи входят другие атомы) К этому классу полимеров относятся биополимеры.
· элементоорганические полимеры (в составе основной цепи наряду с атомами углерода находятся атомы Si, Al, Ti, Ge, B).
· неорганические полимеры (в основной цепи не содержатся атомы углерода, например силиконы).
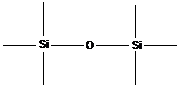
Вопросы для самостоятельной проработки:
1. Перечислите виды номенклатуры полимеров.
2. Как формируется номенклатура, основанная на названии мономеров?
3. Приведите примеры названий полимеров по номенклатуре, основанной на химической структуре полимерной цепи.
4. Назовите виды классификации полимеров. Приведите примеры.
5. Какие существуют виды сополимеров?
6. Каким образом осуществляется химическая классификация полимеров?
Задачи для самостоятельного решения*
2. Классификация и структурные формулы основных полимеров
2.1 Классификация полимеров
Вопросы2501 – 2502, 2403 – 2406, 2307
2.2. Структурные формулы основных полимеров
Вопросы 3501, 3402, 3303 – 3309
*Здесь и в дальнейшем задачи приведены из « Сборника тестовых заданий для тематического и итогового контроля по дисциплине «Химия и физика полимеров», ,М.,МИТХТ, 2009г.
Раздел №3. Основные характеристики макромолекул
Макромолекулы характеризуются 4 основными параметрами:
1. Молекулярная масса (ММ), молекулярно - массовое распределение (ММР);
2. Конфигурация макромолекулы;
3. Конформация макромолекулы;
4. Топология (линейные, разветвленные).
· ММ позволяет определить длину, размеры макромолекул;
· Конфигурация определяет химическое строение макромолекул;
· Конформация определяет форму макромолекул.
3.1. Молекулярная масса (ММ), молекулярно-массовое распределение (ММР)
Основные отличия понятия ММ для ВМС и НМС:
ММ является мерой длины молекулы для линейных полимеров и может быть выражена через ММ низкомолекулярных составных повторяющихся звеньев:
![]()
![]() Mn = m0·Pn (3.1.1.)
Mn = m0·Pn (3.1.1.)
![]() m0 – молекулярная масса составного повторяющегося звена;
m0 – молекулярная масса составного повторяющегося звена;
Pn – степень полимеризации
Большинство синтетических полимеров не являются индивидуальными соединениями, а состоят из смеси молекул разного размера, но одинакового состава.
Это приводит к тому, что:
· у полимеров эффективная молекулярная масса представляет собой среднюю величину из-за полидисперсности – разброса макромолекул по величине ММ;
· у большинства полимеров концевые группы отличаются от состава звеньев полимерной цепи;
· в макромолекулах могут существовать определенные боковые ответвления, это также различает макромолекулы друг от друга;
· большинство биополимеров – индивидуальные соединения (каждый конкретный полимер – уникален по составу, строению и молекулярной массе).
Причины полидисперсности:
1. из-за статистического характера процесса получения полимера: в процессе синтеза получаются макромолекулы различной длины;
2. из-за протекания процессов частичной деструкции макромолекул, например, в ходе эксплуатации материала;
3. из-за различия концевых групп у молекулы полимера;
4. из-за наличия у некоторых полимеров ответвлений в различных местах и различной химической структуры.
3.1.1. Способы усреднения молекулярных масс
1) Усреднение по числу молекул
Среднечисловая ММ:
Мn=∑(Ni ·Mi)/∑Ni (3.1.1.1)
Учитывается число молекул данной молекулярной массы. Мn определяют, используя криоскопию, эбулиоскопию, осмометрию, хроматографию, метод концевых групп.
2) Усреднение по весу
Средневесовая ММ:
Мw=∑(Ni Mi2)/∑(NiMi) (3.1.1.2)
Учитывается масса фракции данной молекулярной массы.
Mw определяют при помощи методов хроматографии, ультрацентрифугирования, светорассеивания.
![]()
![]() Mn<Mw - в подавляющем большинстве случаев
Mn<Mw - в подавляющем большинстве случаев
Коэффициент полидисперсности:
Kn=Mw/Mn (3.1.1.3)
Для монодисперсных (биологических) полимеров Kn=1.
При узком распределении Kn=1,01÷1,05.
В промышленности чаще всего получают полимеры с Kn=3÷10.
3) Средневязкостная ММ:
Mŋ=((∑NiMi)1+α/∑(NiMi))1/α, 0<α<1 (3.1.1.4)
![]()
3.1.2. Молекулярно - массовое распределение (ММР)
Наиболее полной характеристикой молекулярных масс полимеров являются функции распределения по молекулярным массам.
Существуют дифференциальные и интегральные функции распределения.
Их, в свою очередь, подразделяют на числовые и весовые.
Дифференциальное распределение - описывает долю от общего числа молекул (рис.3.1.2.1) или от общего веса макромолекул с ММ в интервале от Мi до Mi+dM.
Интегральное распределение (рис.3.1.2.2) – долю от общего количества/веса вещества, приходящуюся на молекулы с ММ в интервале от массы мономера до Мi (массы полимера на i-степени превращения).
Числовая ММР – отношение числовой доли dn молекул, имеющих массу М в интервале M+dM, к значению этого интервала:
ρn (M)=dn/dM (3.1.2.1)
Аналогично, весовая ММР:
ρw (M)=dw/dM (3.1.2.2)
Условие нормировки:
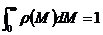 (3.1.2.3)
(3.1.2.3)
 ρn (M)
ρn (M)
 |
Мn Мw М
Мη
Рис. 3.1.2.1. Дифференциальное распределение (числовое), где Δ – полуширина пика
Δ – коррелируется с коэффициентом полидисперсности (Kn)
 qn (M)
qn (M)
 |
Mi М
Рис. 3.1.2.2. Интегральное распределение (числовое)
3.2. Конфигурация макромолекулы
Конфигурация – порядок расположения химических связей, соединяющих атомы или атомные группы в макромолекуле.
Конфигурация формируется в процессе синтеза и не может быть нарушена иным образом, как разрушением химических связей.
Виды конфигурационной изомерии:
1. Локальная изомерия (изомерия положения).
Возникает из-за возможности присоединения мономеров к растущей цепи полимера в процессе синтеза по различным вариантам:
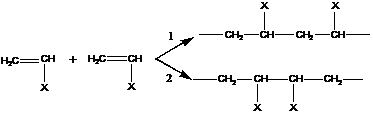
1 – соединение по типу голова-хвост (г-х)
2 – соединение по типу голова-голова (г-г) или хвост-хвост (х-х)
Наиболее распространенная конфигурация – голова-хвост, вследствие селективности в реакции присоединения мономера, например, из-за возможных стерических затруднений в случае близкого расположения боковых групп.
Изомерия, возникающая в результате различного раскрытия кратной связи:
Характерна для группы полимеров, имеющих две сопряженные двойные связи.
Пример:
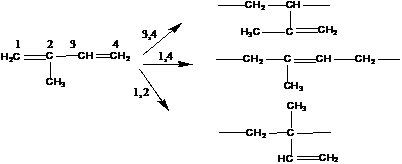
2. Цис-транс изомерия
Характерна для группы полимеров, имеющих в цепи двойные связи.
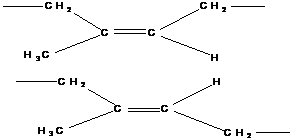 Цис-изомер
Цис-изомер
Транс-изомер
Локальная и цис-транс изомерии являются химическими видами изомерии.
3. Оптическая изомерия (стереоизомерия)
Характерна для полимеров, имеющих (псевдо)асимметрические атомы углерода.
Возможны различные варианты расположения заместителей относительно проекции вытянутой цепи полимера:
Изотактический полимер:
Х Х Х Х Х Х
 |
Синдиотактический полимер:
Х Х Х
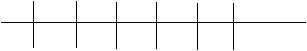 |
Х Х Х
Атактический полимер:

![]()
![]()
![]()
![]()
![]() Х Х Х
Х Х Х
 |
Х Х Х
3.3. Конформация макромолекул
Конформация – это форма, которую приобретают макромолекулы данного конфигурационного состава под действием теплового движения или физических полей.
Виды конформации:
· Конформация транс-зигзага
Представляет собой вытянутую цепь:

Возможно вращение вокруг связей по образующим конуса с углом при вершине 109˚28΄; движение ограничено, т. к. повернуть целый хвост за счет теплового движения трудно. При этом происходят частичные переходы транс-конформаций в свернутые (гош-конформации), а вытянутая цепь скручивается и переходит в конформацию “статистического клубка”.
· Конформация "клубок"
Представляет собой хаотично свернутую цепь:
 |
Клубок постоянно меняет свою форму за счет теплового движения.
Эта конформация может реализовываться и в растворе и в твердом теле.
Содержание полимера в клубке мало (около 5%), т. е. он является рыхлым (в промежутках находится растворитель или фрагменты других макромолекул)
Клубки имеют размер около 300-500 А˚.
· Конформация "глобула"
Представляет собой плотно заполненную атомами частицу, образующими в ней макромолекулу. Содержание полимера значительно выше, чем в клубке:
 |
Полимерные образования в "хорошем" растворителе (т. е. в котором взаимодействие между частицами растворителя и полимером больше, чем между частицами растворителя) находятся в виде набухших клубков, в "плохом" – степень набухания клубков уменьшается.
· Конформация "спираль"
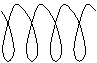 |
Представляет собой вытянутую спираль,
Характерна для биополимеров и для многих полимеров в кристаллическом состоянии.
Вопросы для самостоятельной проработки:
1. Какими основными параметрами характеризуются макромолекулы полимеров?
2. Назовите причины полидисперсности полимеров.
3. Какие существуют способы усреднения молекулярных масс макромолекул полимеров?
4. Чем отличается дифференциальное молекулярно-массовое распределение от интегрального распределения?
5. Перечислите виды конфигурационной изомерии макромолекул.
6. Какие виды конформации макромолекул полимеров Вы знаете?
Задачи для самостоятельного решения
1. Основные понятия и определения химии и физики полимеров
1.3. Понятие о конфигурации. Виды конфигурационной изомерии макромолекул
Вопросы 3501 – 3505, 3516 – 3520, 3406 – 3411, 3421 – 3423, 3312 – 3315, 3324 – 3326
1.4. Молекулярно-массовые характеристики полимеров
Вопросы 4501 – 4503, 4518 – 4521, 4404 – 4405, 4411 – 4413, 4416, 4422 – 4423, 4306 – 4310, 4314 – 4315, 4317
1.5. Дифференциальные и интегральные функции ММР
Вопросы 5501 – 5506, 5407 – 5414, 5
Раздел №4. Элементы, способные к образованию полимеров
Молекула полимера состоит из ряда связанных в цепь атомов:
![]()
Рассмотрим, какие элементы Периодической системы (ПС) способны к образованию полимерных цепей.
4.1. Кислород, сера, селен
Атомы кислорода не способны к образованию длинных линейных цепочек; они способны образовывать лишь перекиси в виде 2-4 атомов кислорода,
Rn – O – O – Rm, соединенных в единую цепь, но и эти соединения являются малоустойчивыми.
Однако, единичные атомы кислорода могут встраиваться в цепи, образованные атомами других элементов (C, P, S, Si) (см. ниже).
Атомы серы способны соединяться между собой в протяженные линейные цепи, особенно при повышенных температурах, но эти цепи при охлаждении разрушаются.
Этот эффект давно известен как обратимый переход ромбической серы в пластическую серу.
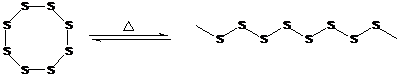
ромбическая сера пластическая сера
При понижении температуры пластическая сера превращается в кристаллическую (ромбическую) серу.
Полимеры, содержащие в главной цепи только атомы серы, не устойчивы и не имеют практического значения. Серосодержащие фрагменты с 1, 2 или несколькими атомами серы устойчивы и входят в состав ряда полимеров.
Аналогичными свойствами облают Se и Te.
4.2. Азот, бор, алюминий
Эти элементы не образуют длинных линейных цепочек и не способны к образованию собственных полимеров.
Азот способен к образованию азосоединений с участием лишь двух атомов азота −N=N−.
Азот, бор, алюминий могут быть элементами макромолекулярных цепочек в других составных частях полимерной структуры, либо входить как гетероатомы в основную цепь.
4.3. Углерод
Обладает высокой склонностью к образованию прочных ковалентных связей, как между собственными атомами, так и с другими атомами.
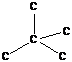 - структура алмаза
- структура алмаза
Это жесткая, разветвленная, 3-х мерная структура, полностью лишенная свойств, присущих линейным макромолекулам.
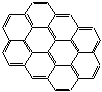 - двухмерная углерод-углеродная структура графена, графита и сажи
- двухмерная углерод-углеродная структура графена, графита и сажи
Возможно получение и линейной цепи из атомов углерода:
 - структура карбина
- структура карбина
или

При нагревании он превращается в графит.
Гораздо большие возможности по построению линейных макромолекул из атомов углерода открываются, когда 1 или 2 валентности углерода насыщаются другими атомами или группами.
Примеры:
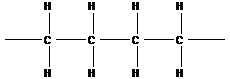 - полиэтилен
- полиэтилен
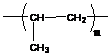 - полипропилен
- полипропилен
![]() - политетрафторэтилен
- политетрафторэтилен
Также в составе основной цепи могут находиться различные группировки, содержащие гетероатомы:
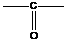 - карбонильная группировка
- карбонильная группировка
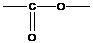 - сложно-эфирная группировка
- сложно-эфирная группировка
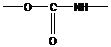 - уретановая группировка
- уретановая группировка
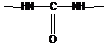 - карбамидная ( мочевинная) группировка
- карбамидная ( мочевинная) группировка
 - простая эфирная или ацетальная группировка
- простая эфирная или ацетальная группировка
В составе цепи могут находиться и атомы металлов:
4.4. Кремний
Атомы кремния способны образовывать полимерные цепи:
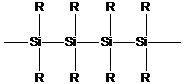
Но они химически не очень устойчивы и при окислении кремний связывается с кислородом, образуя очень прочные связи кремний-кислород.
В природе кремний встречается в виде кварца:
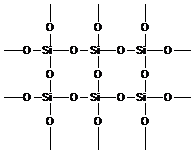
Это жесткая трехмерная структура, не проявляющая «полимерных» свойств линейных макромолекул. Линейные макромолекулы получают, заместив две валентности у каждого атома кремния на органические радикалы (CH3-, C2H5- и т. д.). При этом появляются кремний-органические полимеры.
Можно синтезировать кремнийсодержащие полимеры:
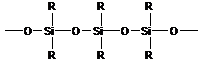 - полисилоксаны
- полисилоксаны
В цепь могут встраиваться атомы Al, B, Ti, Zn и некоторые другие.
4.5. Фосфор
Атомы фосфора могут образовывать полимеры, но в состав основной цепи должны входить и другие атомы (чаще всего кислород):
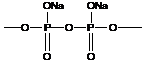 - полифосфаты
- полифосфаты
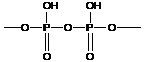 - полифосфорная кислота
- полифосфорная кислота
Остатки ортофосфорной кислоты входят в природные полимеры (нуклеиновые кислоты, ДНК и РНК):
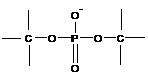
Таким образом, двух или поливалентные атомы (C, O, P, N, S, Si, Al, B и некоторые другие) могут находиться в виде элементов основной цепи макромолекул или находиться в боковых фрагментах; одновалентные атомы (H, F, Cl, J, Br и некоторые другие) могут выстраиваться только в качестве заместителей.
![]()
Химия полимеров построена на базе этих элементов.
4.6. Виды полимеров
Полимеры получают либо синтетически, либо извлекают из живых организмов (биополимеры), или же обработкой уже выделенных природных полимеров.
Далее будут рассмотрены синтетические способы получения полимеров.
Часть синтетически созданных полимеров существует в природе. Полимеры получаются из мономеров – низкомолекулярных веществ или в результате превращений готовых полимеров (синтетических или природных) – полимераналогичные превращения.
Примеры:
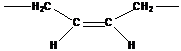
- 1,4-цис-полибутадиена в природе не существует, получают синтетически из бутадиена.
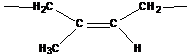
- 1,4-цис-полиизопрен существует в природе (натуральный каучук), но в природе синтезируется из глюкозы и других веществ (но не из изопрена, как в промышленности)
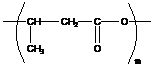
- этот полиэфир можно получить конденсацией поли-β-гидроксибутирата, в то же время он синтезируется и рядом бактерий.
Синтезы биополимеров в данном курсе рассматриваться не будут.
Многие природные полимеры очень сложно получить синтетически. Они получаются в живых организмах в результате протекания сложных биохимических реакций.
Важнейшие природные полимеры:
· Целлюлоза (является строительным материалом клеток всех растений)
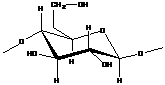
Молекула построена из соединенных между собой глюкозидными связями остатков глюкозы, образуется при фотосинтезе в растениях.
· Молекулы белков построены из соединенных между собой пептидными связями остатков 20 различных α-аминокислот. Порядок расположения аминокислотных звеньев определяется генетическим кодом.
Например:
· Белки

фенилаланин триптофан
· Нуклеиновые кислоты
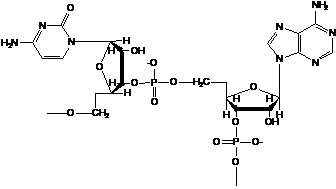
Молекулы построены из соединенных фосфорэфирными связями остатков сахаров (рибозы или дезоксирибозы) с химически присоединенными азотистыми основаниями. Порядок чередования оснований задает генетический код.
4.7. Реакции синтеза макромолекул
1. Полимеризация с раскрытием кратных связей
В реакциях этого типа способны вступать мономеры, содержащие кратные связи:
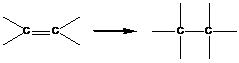
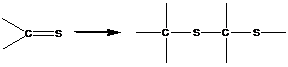
![]()
![]()
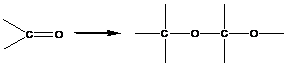
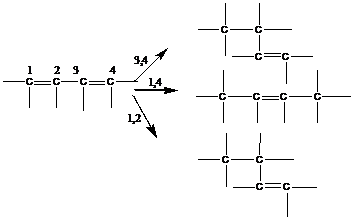
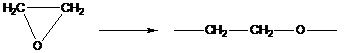
2. Полимеризация с раскрытием цикла
В реакции этого типа способны вступать мономеры, имеющие термодинамически неустойчивые циклы – состоящие из 3,4 или > 6 атомов углерода, обычно содержащие гетероатом.
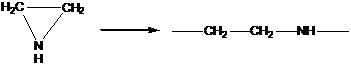
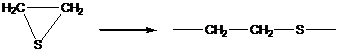
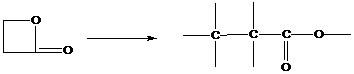
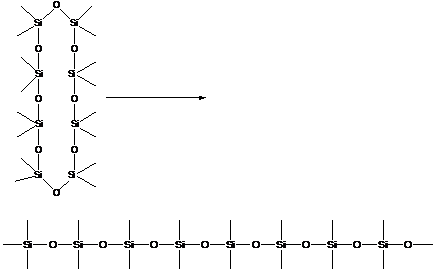
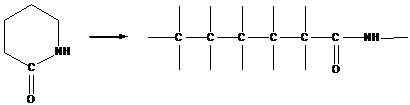

3. Поликонденсация и полиприсоединение
Поликонденсация - это процесс синтеза высокомолекулярных соединений, в котором рост макромолекул происходит путем химического взаимодействия исходных молекул друг с другом, с реакционноспособными группами n-меров, накапливающихся в ходе реакции, а также молекул n-меров между собой.
Согласно этому определению схему реакции поликонденсации можно представить следующим образом:
~Mi + ~Mj > ~M i+j
где - ~Mi, ~Mj и ~Mi+j - соответственно, i, j и i+j—меры, причем i и j могут быть любым числом, в том числе и единицей.
Для получения макромолекул путем поликонденсации может быть, в принципе, использована любая реакция конденсации или присоединения, известная в органической химии. Как правило, при реакциях конденсации наблюдается выделение низкомолекулярных веществ (воды, спирта, аммиака, хлористого водорода и т. д.).
Примерами могут служить реакции полиэтерификации:
HO-R-COOH + HO-R-COOH > HO-R-COO-R-COOH + H2O и т. д.
полиамидирования:
H2N-R-NH2 + ClOC-R'-COCl > H2N-R-NHCO-R'-COCl + HCl и т. д.
При этом в отличие от полимеризации, элементарный состав продуктов поликонденсации в данном случае не совпадает с составом мономерных соединений, т. к. каждый химический акт поликонденсации сопровождается выделением молекулы низкомолекулярного продукта.
Приведенной выше общей схеме поликонденсации соответствуют также некоторые разновидности процессов, которые не сопровождаются выделением низкомолекулярных продуктов. К их числу, например, относится синтез полиуретанов из гликолей и диизоцианатов:
НО-R-OH + O=C=N-R'-N=C=O > HO-R-О-CO-NH-R'-N=C=O и т. д.
Подобные поликонденсационные процессы часто называют полиприсоединением. По кинетическим закономерностям реакции полиприсоединения весьма схожи с реакциями поликонденсации. В обоях типах поликонденсационных процессов рост макромолекул осуществляется путем взаимодействия функциональных групп молекул мономеров или таких же групп находящихся на концах уже образовавшихся цепей различной молекулярной массы. Получаемые в результате этих реакций промежуточные полимерные продукты вполне устойчивы и могут быть выделены в свободном виде. Однако они содержат на концах реакционноспособные группы и поэтому способны к дальнейшим реакциям конденсации, как друг с другом, так и с соответствующими мономерными молекулами. Отсюда следует, что теоретически поликонденсация может считаться завершенной лишь тогда, когда прореагируют все концевые функциональные группы, в результате чего должна образоваться одна гигантская циклическая макромолекула. На практике, однако, это никогда не достигается.
Вопросы для самостоятельной проработки:
1. Какие элементы Периодической системы способны к образованию полимерных цепей?
2. Приведите примеры полимеров, получаемых синтетически.
3. Приведите примеры природных полимеров.
4. Какие мономеры могут участвовать в реакции полимеризации?
5. Приведите характерные особенности процессов полимеризации и поликонденсации.
Раздел №5. Термодинамические условия проведения полимеризации.
Возможность протекания реакций определяется значением изменения энергии Гиббса в ходе реакции:
если ΔG>0, то реакция не протекает
если ΔG=0, то система находится в равновесии
если ΔG<0, то реакция может протекать.
Расчет изменения энергии Гиббса в ходе реакции может быть произведен по формуле:
ΔG=ΔH-TΔS (5.1.)
или
ΔG=ΔG˚+RTlnKp, (5.2.)
где ΔG˚=-RTlnKp - стандартный потенциал для р = 1атм и Т = 293К
или ΔG˚=ΔH˚-TΔS˚ (ΔH˚ и ΔS˚ определяются по справочным данным).
Условие протекания реакции на один моль вещества можно также выразить через изменение химического потенциала, который отождествляется с изменением энергии Гиббса:
Δμ=ΔH-TΔS (5.3.)
(химический потенциал по определению представляет собой частные производные энергии Гиббса по характеристическим функциям при некоторых постоянных переменных).
На рисунке 5.1 изображены типичные зависимости изменения химического потенциала от температуры. Температурная зависимость определяется как 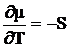 . Например для воды, поскольку Sпара > Sжидк. воды, то кривая 1 соответствует изменению для воды в парообразном состоянии (Вп), кривая 2 – для воды в жидком состоянии (Вж).
. Например для воды, поскольку Sпара > Sжидк. воды, то кривая 1 соответствует изменению для воды в парообразном состоянии (Вп), кривая 2 – для воды в жидком состоянии (Вж).
μ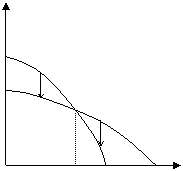
Ткип Вп Вж Т
Рис. 5.1. Зависимость изменения потенциала от температуры для воды
Чтобы процесс был термодинамически разрешен, необходимо, чтобы изменение потенциала было отрицательным, т. е. процесс протекал с уменьшением потенциала. Ниже Ткип μп>μж и пар конденсируется, выше Ткип μж>μп и жидкая вода превращается в пар.
Таким образом, самопроизвольно идут процессы перехода воды из одного состояния в другое в направлении, указанном на рисунке стрелками.
Рассмотрим возможные термодинамически разрешенные условия перехода мономеров в полимеры (процесс полимеризации).
 μ
μ
Тпр М П Т
![]()
![]()
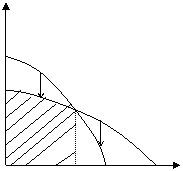
Рис. 5.2. Зависимость изменения потенциала от температуры (полимеризация возможна при температуре ниже Тпр)
В данном случае существует предельная температура, ограничивающая область полимеризации (на рисунке эта область заштрихована). При температурах, превышающих эту предельную температуру, полимеризация невозможна. Эта температура называется верхней предельной температурой.
Рассмотрим другой случай, когда область полимеризации лежит выше некоторой предельной температуры:
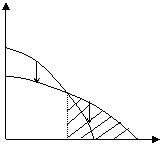 |
μ
Тпр П М Т
![]()
![]()
Рис. 5.3. Зависимость изменения потенциала от температуры (полимеризация возможна при температуре выше Тпр)
Температура, ограничивающая область полимеризации в данном примере называется нижней предельной температурой.
Возможны также случаи, когда полимеризация возможна во всей области температур (рис. 5.4. а), или невозможна вообще (рис. 5.4. б):
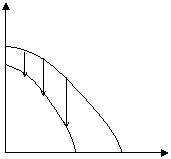 |
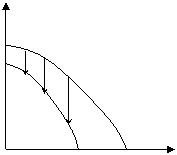 μ (а) μ (б)
μ (а) μ (б)
П М М П
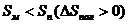
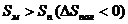
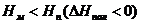
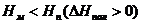
Рис. 5.4. Зависимость потенциала от температуры, когда полимеризация возможна во всей области температур (а), или невозможна вообще (б).
Процесс полимеризации можно условно представить в виде следующих стадий:
![]() , где А* - активатор, М – мономер
, где А* - активатор, М – мономер
![]()
…………………………….
![]()
Можно принять, что константы равновесия на каждой стадии приблизительно равны друг другу (при n > >1):
![]()
Константа каждой стадии равна:
![]() (5.4)
(5.4)
![]() (5.5)
(5.5)
Определяем среднюю степень полимеризации:
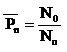 , (5.6)
, (5.6)
где
![]() (5.7)
(5.7)
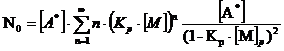 (5.8)
(5.8)
Получаем:
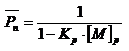 (5.9)
(5.9)
Т. к. степень полимеризации ![]() , то можно получить, что
, то можно получить, что ![]()
Полимерная молекула ведет себя как частица отдельной фазы, т. к. Кр не зависит от концентрации полимера. Например,
![]()
![]()
Учитывая приведенные выше допущения можно записать:
![]() (5.10)
(5.10)
Откуда
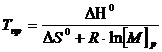 (5.11)
(5.11)
Это основное соотношение термодинамики полимеризации, связывающее равновесную концентрацию мономера, стандартные величины ∆Н° и ∆S° полимеризации и величину Тпр.
Рассмотрим влияние термодинамических ограничений на различные виды полимеризации.
1. Полимеризация с раскрытием кратных связей
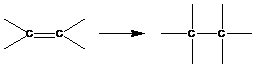
Тепловой эффект реакции полимеризации равен отрицательному значению изменения энтальпии:
![]() (5.12)
(5.12)
![]() , (5.13)
, (5.13)
сумма первых двух членов составляет примерно 20-22 ккал/моль
Для реакции полимеризации этилена ![]() ≈ 20 ккал/моль, это максимальная величина для раскрытия связи:
≈ 20 ккал/моль, это максимальная величина для раскрытия связи: ![]()

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 |