3. Методы получения и структура основных типов полимеров
3.1. Виды полимеризации. Инициирование и ингибирование полимеризации
Вопрос 1319
3.4. Ионная и ионно-координационная полимеризация
Вопросы 4501 – 4503, 4404 – 4409, 4
Раздел №12. Сополимеризация
12.1. Радикальная сополимеризация
Радикальную сополимеризацию обычно инициируют теми же способами, что и радикальную гомополимеризацию. Для неё, в принципе, характерны те же механизмы роста, обрыва и передачи цепи. Рассмотрим сополимеризацию двух мономеров. Предполагая, что активность радикалов роста определяется лишь типом концевого звена, следует учитывать четыре элементарные реакции роста:
Таблица 12.1.1.
Элементарные реакции роста цепи

где Мi — мономер i-ого типа; ~R∙j — макрорадикал, оканчивающийся звеном Mj, а kij — константа скорости присоединения Мj мономера к радикалу ~R∙i. Рассматриваемая модель получила название "модель концевого звена" сополимеризации. Кинетическая обработка приведенной реакционной схемы в квазистационарном приближении позволяет установить связь между составом сополимеров и составом исходной смеси мономеров. В квазистационарном состоянии концентрации радикалов ~R∙1 и ~R∙2 постоянны, т. е. скорости перекрестного роста цепи равны между собой:
(12.1.1)
Скорости превращения мономеров при сополимеризации описываются уравнениями:
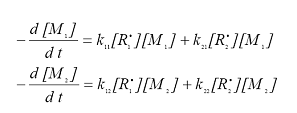 |
(12.1.2)
Из отношения скоростей этих реакций с учетом условия стационарности для концентраций радикалов (12.1.1) несложно получить следующее выражение, обычно называемое уравнением Майо-Льюиса, характеризующее на начальных стадиях превращения, когда без большой ошибки можно положить концентрации мономеров [M1] и [M2] величинами постоянными, зависимость состава получаемого сополимера от состава мономерной смеси:
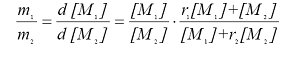 (12.1.3)
(12.1.3)
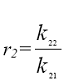 |
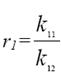 |
где, а так называемые константы сополимеризации. Они представляют собой отношения констант скоростей присоединения к данному радикалу "своего" и "чужого" мономеров. Значение r1 и r2 зависят от химической природы реагирующих мономеров.
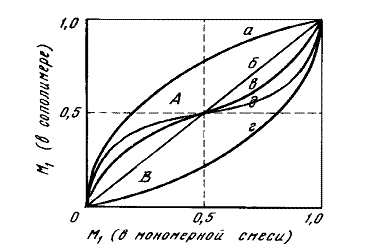
Рис. 12.1.1. Зависимость состава сополимера от состава смеси мономеров.
Зависимость состава сополимеров от состава смеси мономеров удобно характеризовать диаграммой "состав мономерной смеси - состав сополимера" (рис. 12.1.1.). Форма кривых на диаграмме составе зависит от значений r1 и r2. При этом возможны следующие случаи: 1) r1=r2=1, т. е. для всех соотношений концентраций мономеров в реакционной смеси состав сополимера равен составу исходной смеси (прямая б), 2) r1>1 и r2<1, т. е. для всех соотношений концентраций мономеров в исходной смеси сополимер обогащен звеньями М1 (кривая а), 3) r1<1 и r2>1, т. е. для всех исходных соотношений концентраций мономеров сополимер обогащен звеньями М2 (кривая г), и наконец, 4) r1<1 и r2<1, т. е. при малых содержаниях M1 в исходной смеси мономеров сополимер обогащен звеньями М1, а при больших — звеньями M2 (кривые в и д). В последнем случае наблюдается склонность к чередованию в сополимере звеньев М1 и М2, которая тем больше, чем ближе к нулю значения r1 и r2. Случай r1>1 и r2>1, которому должна соответствовать тенденция к раздельной полимеризации мономеров в смеси, обычно на практике не реализуется.
Величины r1 и r2 могут быть определены экспериментально. Знание их позволяет предсказать состав сополимера и распределение мономерных звеньев в цепях при любом соотношении мономеров в смеси. Значения r1 и r2 при радикальной сополимеризации и, следовательно, состав сополимера обычно слабо зависят от природы растворителя и очень мало меняются с температурой.
Рассмотрение величин r1 и r2 в рамках теории идеальной радикальной реакционной способности приводит к заключению, что r1*r2=1, т. е. константы скоростей присоединения одного из мономеров к обоим радикалам в одинаковое число раз больше констант скоростей присоединения другого мономера к этим радикалам. Имеется ряд систем, для которых это условие хорошо оправдывается на опыте. В таких случаях мономерные звенья обоих типов располагаются в макромолекулах случайно. Однако для многих систем r1*r2<1. Это отклонение связано с влиянием полярных и пространственных факторов, которые обусловливают тенденцию мономерных звеньев М1 и М2 к чередованию в макромолекулах. В таблице в качестве примеров приведены значения констант сополимеризации и их произведений для некоторых пар мономеров.
Таблица 12.1.2.
Константы радикальной сополимеризации некоторых мономеров.
М1 | М2 | r1 | r2 | r1r2 |
Стирол | Бутадиен | 0,80 | 1,40 | 1,12 |
Стирол | Метилметакрилат | 0,52 | 0,46 | 0,24 |
Стирол | Винилацетат | 55,0 | 0,01 | 0,55 |
Стирол | Малеиновый ангидрид | 0,01 | 0 | 0 |
Винилацетат | Винилхлорид | 0,23 | 1,70 | 0,39 |
Метилакрилат | Винилхлорид | 9,0 | 0,08 | 0,75 |
12.2. "Схема Q - е" Алфрея – Прайса
Учет полярных факторов был сделан в рамках полуэмпирической схемы, называемой схемой "Q-е", в которой принимают, что
![]() (12.2.1)
(12.2.1)
где Рi и Qj — параметры, соответствующие энергиям сопряжения в мономере (j) и радикале (i), согласно теории идеальной радикальной реакционной способности. Величины еi и еj учитывают поляризацию реагирующих мономеров.
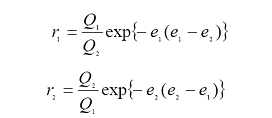 Тогда:
Тогда:
(12.2.2)
(12.2.3)
Используя эту схему, удалось оценить относительную реакционную способность мономеров и роль полярных факторов для большого числа пар сополимеризующихся мономеров. За стандартный мономер был принят стирол со значениями Q=1, е = −0,8. При сополимеризации стирола с другими мономерами (Mj) последние были охарактеризованы своими значениями Qj и еj, что дало возможность предсказать поведение этих мономеров в реакциях сополимеризации с другими мономерами, для которых также были установлены значения Q и е. Хотя схема "Q-е" не имеет полного теоретического обоснования, с практической точки зрения она оказалась полезной. Значения Q и е большинства мономеров собраны в справочной литературе.
12.3. Ионная сополимеризация
В катионной и анионной сополимеризации относительные активности мономеров часто очень сильно отличаются от таковых для радикальной сополимеризации. Поэтому при одинаковом соотношении сомономеров в смеси в зависимости от типа сополимеризации, могут быть получены сополимеры, резко различные по составу.
Таблица 12.3.1.
Влияние механизма реакции на состав продукта сополимеризации эквимолярной смеси стирола с метилметакрилатом
Катализатор | Тип полимеризации | Содержание стирола в сополимере, % |
SnCl4 | Катионная | 99 |
Na | Анионная | < 1 |
Пероксид бензоила | Радикальная | ≈ 50 |
Изучение зависимости состава сополимера от природы катализатора дает сведения о механизме реакции. В отличие от радикальной сополимеризации, состав сополимеров, о6разующихся при катионной и анионной сополимеризации, зависит от природы растворителя. Особенно сильно эта зависимость проявляется при анионной сополимеризации. Состав сополимеров зависит также от природы противоиона. При ионной полимеризации и сополимеризации в ряде случаев важную роль играет комплексообразование между активным центром и молекулой мономера, предшествующее включению последней в растущую цепь. Продолжительность жизни такого комплекса (т. е. время с момента его образования до включения очередной молекулы мономера в состав макромолекулы) может значительно превышать продолжительность жизни переходного состояния в обычных цепных реакциях (10-13 сек.), т. е. промежуточные комплексы могут оказаться достаточно стабильным. В таких случаях ионную полимеризацию или сополимеризацию называют координационно- ионной.
Условия комплексообразования, состав и строение комплексов зависят от природы растворителя. Возможно, что с этим связана одна из важных причин влияния растворителя на состав сополимеров.
12.4. Способы проведения полимеризации
Выбор способа полимеризации определяется конкретными требованиями, которые предъявляют к продукту полимеризации, а также природой полимеризуемого мономера, используемого инициатора и задачами, которые ставятся при осуществлении полимеризации. На практике обычно используют четыре способа проведения полимеризации: в блоке (или в массе), в растворе, в эмульсии и в суспензии (иногда суспензионную полимеризацию называют капельной или бисерной).
1. Полимеризация в блоке (блочная полимеризация) - это полимеризация мономера в конденсированной фазе в отсутствии растворителя. Если реакцию ведут до практически полного превращения мономера, то получают монолит (блок), имеющий форму сосуда, в которой был залит исходный мономер. При блочной полимеризации можно использовать как инициаторы радикальной, так и катализаторы ионной полимеризации, растворимые в мономере. Основным преимуществом данного способа является возможность использования блоков полимера без последующей переработки и отсутствие стадии отделения от растворителя. Основной недостаток - сложность отвода выделяющего тепла, особенно при высокой вязкости системы. Вопросы отвода тепла решают путем обрыва процесса на ранних стадиях превращения или проведением полимеризационных процессов в несколько стадий. Так при непрерывной полимеризации этилена при высоких давлениях процесс останавливают на невысоких степенях завершения реакции %), выделяют образовавшийся полимер, а непрореагировавший мономер снова пускают в производственный цикл. При полимеризации стирола и метилметакрилата в массе проблема теплоотвода решается проведением реакции в две стадии. На первой стадии форполимеризации при невысоких температурах (до 80ºC) получают 20-30% растворы полимера в собственном мономере. На второй стадии температуру в реакторе повышают и полимеризацию доводят до полного превращения мономера.
2. Полимеризацию в растворе проводят либо в жидкости, смешивающейся с мономером и с образующимся полимером ("лаковый способ"), либо в среде, растворяющей только мономер. В последнем случае образующийся полимер выпадает из раствора и может быть отделен фильтрованием. Преимущество этих способов - легкость отвода выделяющегося тепла. Недостатки метода связаны с необходимостью дополнительных затрат на подготовку растворителя, отделение и регенерацию растворителя, промывку и сушку полученного полимера. Кроме того, полимеризацию в этом случае трудно довести до полного исчерпания мономера и получить продукт высокого молекулярного веса, так как концентрация мономера непрерывно убывает и на конечной стадии оказывается очень малой.
Полимеризацией в растворе по радикальному механизму получают поливинилацетат, полиакрилонитрил, политетрафторэтилен и некоторые полиакрилаты. Среди ионных и координацнонно-ионных процессов необходимо упомянуть синтез бутил-каучука и бутадиен-стирольных каучуков на литийорганических катализаторах, полимеризацию этилена и других α-олефинов на катализаторах Цнглера-Натта.
3. Полимеризация в эмульсии (эмульсионная полимеризация) - один из распространенных промышленных способов получения полимеров, осуществляемый в среде с высокоразвитой поверхностью раздела между несмешивающимися фазами, одна из которых содержит мономер. Инициаторами эмульсионной полимеризации, вообще говоря, могут служить как радикалы, так и ионы.
При проведении эмульсионной полимеризации в качестве дисперсионной среды чаще всего используют воду. В таком случае мономер, нерастворимый или плохо растворимый в воде, вводят в количестве 30-60 об.%. Для стабилизации эмульсии используют поверхностно-активные вещества ПАВ (олеаты, пальмитаты, лаураты щелочных металлов, натриевые соли ароматических и высокомолекулярных жирных сульфокислот и др.). При достаточно высоких концентрациях ПАВ в водных растворах образуются мицеллы эмульгатора. Мономер частично растворяется в мицеллах, а частично остается в системе в виде достаточно крупных капель (диаметр порядком 10-4 см), стабилизированных эмульгатором. Число мицелл в системе примерно в 108 раз больше числа капель мономера. Полимеризацию обычно инициируют водорастворимыми низкотемпературными окислительно-восстановительными инициаторами.
Полимеризация начинается в мицеллах, которые вскоре превращаются в латексные частицы полимера коллоидных размеров, окруженные слоем эмульгатора. При этом на начальных стадиях процесса происходит как увеличение числа, так и рост размеров латексных частиц. В дальнейшем, после исчерпания мицеллярного эмульгатора, новые частицы не образуются, а имеющиеся увеличиваются в размере за счет диффузии мономера из капель. Полимеризация завершается после израсходования капель мономера. В каплях мономера полимеризация практически не происходит, так как инициатор растворим лишь в водной фазе, а вероятность столкновения инициирующего радикала с каплей гораздо меньше, чем с мицеллой. Важно подчеркнуть, что мицеллы, а затем и образующиеся из них латексные частицы служат эффективными ловушками для радикалов. Обратный выход макрорадикалов из частиц в водную среду невозможен ввиду нерастворимости полимера в воде (выйти из частицы могут лишь низкомолекулярные радикалы, образующиеся в частицах за счет реакции передачи цепи). Такой механизм изолирования радикалов, являющийся специфическим для эмульсионной полимеризации, позволяет значительно повысить концентрацию радикалов роста по сравнению с гомогенными процессами (при равных скоростях инициирования) вследствие невозможности взаимного обрыва радикалов из разных латексных частниц. Это обстоятельство открывает возможность получения полимеров с высокими молекулярными массами при скоростях реакции, значительно превышающих скорости при гомогенной полимеризации. К преимуществам данного метода следует отнести также легкость теплоотвода. Недостатки метода в основном связаны с дополнительными затратами на очистку конечного продукта от эмульгатора.
Эмульсионная полимеризация широко используется для получения полимеров на основе сопряженных диенов: бутадиена и изопрена и др. Этим способом полимеризуют также винилацетат, винилхлорид, акрилаты, метакрилаты и их смеси.
Полимеризацию в суспензии, так называемую «гранульную полимеризацию», проводят, диспергируя мономер, в виде капель размером порядка см в нерастворяющей или плохо растворяющей среде (обычно в воде). Капли стабилизируют водорастворимыми полимерами (поливиниловый спирт, желатин), а также твердыми гидрофильными порошками (тальк, глина, окись магния). В отличие от эмульсионной полимеризации, при суспензионной полимеризации используют радикальные инициаторы, растворимые в мономере. Поэтому полимеризацию в каждой капле можно рассматривать как микроблочную полимеризацию со всеми ее закономерностями. Полимер образуется в виде мелких гранул, пригодных для дальнейшей переработки в изделия. Недостаток суспензионной полимеризации, как и в случае эмульсионной полимеризации - необходимость отмывания полимера от стабилизатора суспензии. Полимеризацию в суспензии используют для синтеза поливинилхлорида, полистирола, полиметилметакрилата, поливинилацетата и других полимеров.
Вопросы для самостоятельной проработки:
1. Что такое константы сополимеризации?
2. Вывод и анализ уравнения дифференциального состава сополимера.
3. Как меняется состав сополимера в зависимости от состава исходной смеси при различных значениях констант сополимеризации?
4. Диаграмма составов.
5. Влияние полярности мономеров и радикалов на процесс сополимеризации. Q-е схема.
6. Зависимость состава сополимера при ионной сополимеризации от различных факторов.
7. Перечислите основные преимущества и недостатки существующих способов проведения полимеризации.
Задачи для самостоятельного решения
3. Методы получения и структура основных типов полимеров
3.5. Радикальная сополимеризация
Вопросы 5501 – 5504, 5405 – 5408, 5309 – 5316
3.6. Ионная сополимеризация
Вопросы 6501 – 6503, 6404 – 6406, 6
Раздел № 13. Поликонденсация
Поликонденсация – процесс синтеза высокомолекулярных соединений, в котором рост макромолекул происходит путем химического взаимодействия концевых групп (многократно повторяющихся реакций конденсации) исходных полифункциональных молекул друг с другом, с реакционноспособными n-мерами (олигомерами), а также n-меров между собой.
Поликонденсацией получают около 30% всех производимых полимеров, а также проводят химический синтез пептидов, белков, нуклеиновых кислот.
Пример реакции - поликонденсация этиленгликоля и адипиновой кислоты:
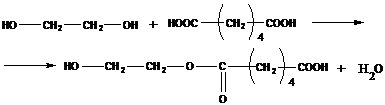
Образовавшийся димер может реагировать по тому же механизму с молекулой адипиновой кислоты или с молекулой этиленгликоля с образованием соответствующих тримеров (т. к. димер имеет также 2 функциональные группы, и возможно присоединение по группе –COOH или по группе –OH), а также возможна реакция двух молекул димеров между собой с образованием тетрамера. Затем образовавшиеся димеры, тримеры, тетрамеры, n-меры могут реагировать между собой или с молекулами мономеров – происходит удлинение цепочки.
В процессе поликонденсации выделяются молекулы воды, и образуется сложноэфирная связь (обратный процесс – процесс гидролиза).
Получение полиуретанов
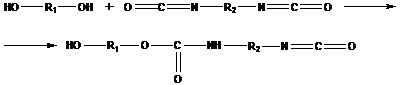
в приведенном примере нет выделения низкомолекулярного продукта, но характер формирования молекул соответствует поликонденсации; такие реакции называются реакциями полиприсоединения.
Таким образом, исходные молекулы должны быть бифункциональными, чтобы происходил процесс поликонденсации.
Характер формирования макромолекул различен в процессах поликонденсации и полимеризации.
Напомним, что процесс полимеризации протекает по схеме:
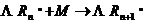
Рассмотрим основные особенности процессов полимеризации и поликонденсации (табл.13.1).
Таблица 13.1.
Основные особенности процессов полимеризации и поликонденсации
№ п/п | Особенность процесса | Полимеризация (ПМ) | Поликонденсация (ПК) | |
1 | Характер образования цепи | Цепной. Продуктом процесса является макромолекула. | Нарастание длины макромолекулы происходит по «ступеням» различной величины | |
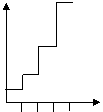
2 | Зависимость средней степени полимеризации от числа реакций, составляющих стадию образования макромолекул | Арифметическая прогрессия:
i i – число актов взаимодействия | Геометрическая прогрессии:
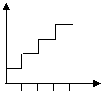
i Чем более глубоко проходит процесс, тем более сильно будет изменяться ММ в процессе поликонденсации | |
3 | Число реакционных центров в ходе процесса | Постоянно | В каждом акте число реакционных центров уменьшается на 2 (модель дубликации) | |
4 | Исчезновение мономера | Мономер исчезает на глубоких стадиях, существует практически до конца реакции (небольшая часть мономера остается в конце). Определяющим параметром можно принять степень превращения по мономеру. | Мономер исчезает на более ранних стадиях. Определяющим параметром принимается сте-пень превращения по функциональ-ным группам:
| |
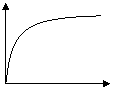
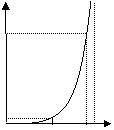
5 | Образование полимера | Полимер образуется практически сразу:
t |
10
2 q | |
6 | Наличие катализатора или инициатора | Наличие катализаторов или инициаторов обязательно | Наличие катализаторов или инициаторов необязательно |
Степень полимеризации в процессе поликонденсации определяется как отношение общего числа исходных молекул мономера к числу молекул, имеющихся в момент времени t:

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 |






 Pn
Pn
 Pn
Pn