На правах рукописи
Эффекты и механизмы действия сероводорода на сократительную функцию миокарда лягушки
03.03.01 – физиология
Автореферат
диссертации на соискание ученой степени
кандидата биологических наук
Казань – 2011
![]() Работа выполнена на кафедре физиологии человека и животных федерального государственного автономного образовательного учреждения высшего профессионального образования «Казанский (Приволжский) федеральный университет» Федерального агентства по образованию и науке РФ
Работа выполнена на кафедре физиологии человека и животных федерального государственного автономного образовательного учреждения высшего профессионального образования «Казанский (Приволжский) федеральный университет» Федерального агентства по образованию и науке РФ
Научный руководитель: доктор биологических наук, профессор
Официальные оппоненты: доктор биологических наук, профессор
доктор биологических наук, профессор
Ведущая организация: Учреждение Российской академии медицинских наук НИИ нормальной физиологии им. РАМН (г. Москва).
Защита состоится «27» марта 2012 г. в « » часов на заседании Диссертационного совета Д 212.078.02 при ФГАОУВПО «Казанский (Приволжский) федеральный университет» Федерального агентства по образованию и науке РФ
С диссертацией можно ознакомиться в научной библиотеке им. при ФГАОУВПО «Казанский (Приволжский) федеральный университет» 5.
Электронная версия автореферата размещена на официальном сайте ФГАОУВПО «Казанский (Приволжский) федеральный университет» Федерального агентства по образованию и науке РФ www.ksu.ru
Автореферат разослан « » 20 г.
 Ученый секретарь
Ученый секретарь
диссертационного совета
д. м.н. профессор
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность исследования
Исследование механизмов внутрисердечной регуляции сократимости миокарда является одним из актуальных направлений в физиологии сердца. Достаточно подробно изучена роль холин - и адренергических факторов в регуляции деятельности сердца (, 2005). Ведутся исследования об участии пуринорецепторов в регуляции работы сердца и сосудов в онтогенезе (, , 2011). Сероводород (H2S) – газ, обладающий хорошо известными токсическими эффектами, связанными с нарушением окислительного фосфорилирования в клетке (R. J. Reiffenstein et al., 1992). Однако, все больше данных свидетельствует о том, что H2S эндогенно синтезируется и оказывает физиологические эффекты в сердечно-сосудистой, нервной и эндокринной системах, а также в желудочно-кишечном тракте (, , 2006, 2010, , 2008, G. F.Sitdikova, 2010, D. J. Elsey et al., 2010, Н. Kimura et al., 2010). H2S был предположен в качестве эндогенного «газомедиатора» наряду с двумя другими физиологически активными газами - оксидом азота (NO) и монооксидом углерода (, , 2006, 2010, M. M. Gadalla, S. H. Snyder, 2010). В сердечно-сосудистой системе H2S синтезируется из L-цистеина цистатионин γ-лиазой и 3-меркаптосульфтрансферазой (В. Geng et al., 2004, G. Yong et al., 2008, D. J. Elsey et al., 2010) и оказывает целый ряд эффектов, включая вазодилятацию, регуляцию пролиферации и апоптоза, ангиогенез (M. M. Gadalla, S. H. Snyder, 2010, , 2010). Имеются данные о кардиопротекторной роли H2S, выражающейся в уменьшении повреждений миокарда в условиях ишемии/реперфузии в экспериментах in vitro и in vivo (B. Geng et al., 2004, J. S. Bian, et al., 2006, D. J. Elsey et al., 2010). В единичных исследованиях показано, что H2S оказывает отрицательный инотропный эффект в сердце различных видов теплокровных животных и уменьшает длительность потенциала действия рабочих кардиомиоцитов (, 2009, B. Geng et al. 2004, Y. G. Sun, Y. X. Cao, W. W. Wang et al., 2008). Механизмы действия H2S малоизученны и включают, по разным данным, систему аденилатциклазы, АТФ-зависимые К-каналы и потенциал-зависимые Са-каналы L-типа в зависимости от вида животного (M. Xu et al., 2007, Y. G. Sun, Y. X. Cao, W. W. Wang et al., 2008, G. Yong, et al., 2008, , 2009). Показано влияние H2S на сосудистый тонус у всех классов позвоночных животных (рыб, амфибий, рептилий) и включает как вазоконстрикцию, так и вазодилятацию, что указывает на филогенетическую древность H2S как газомедиатора и универсальность его действия (R. A. Dombkowski et al. 2004, K. R. Olson, et al. 2005). Данные о действии H2S на сократимость миокарда холоднокровных животных отсутствуют. Таким образом, сведения о регуляции функций сердца с помощью нового газообразного посредника - H2S во многом фрагментарны, а молекулярные мишени его влияния не определены. Поэтому исследование эффектов и мишеней действия экзогенного и эндогенного сероводорода на сократимость миокарда лягушки является актуальным.
Цель и задачи исследования
Целью исследования являлось выявление эффектов и механизмов действия сероводорода на сократимость миокарда лягушки
В соответствии с целью были поставлены следующие задачи:
1. Изучить действие донора сероводорода - гидросульфида натрия на сократимость миокарда лягушки.
2. Выявить эффекты субстрата синтеза сероводорода L-цистеина и блокаторов фермента синтеза газа цистатионин γ-лиазы на сократимость миокарда лягушки.
3. Проанализировать роль потенциал-зависимых кальциевых каналов L-типа и внутриклеточных кальциевых депо в эффектах гидросульфида натрия на сократимость миокарда.
4. Выявить влияние гидросульфида натрия на сократимость миокарда на фоне активации и ингибирования различных типов калиевых каналов.
5. Проанализировать роль закисления внутриклеточной среды в отрицательном инотропном эффекте гидросульфида натрия.
6. Выявить роль системы аденилатциклазы в эффектах сероводорода.
7. Исследовать взаимодействие системы оксида азота и сероводорода в регуляции сократимость миокарда
8. Проанализировать влияние сероводорода в условиях активации β-адренорецепторов и блокирования фосфодиэстераз.
Положения, выносимые на защиту:
1. Экзогенный и эндогенный сероводород оказывает обратимый и дозозависимый отрицательный инотропный эффект и уменьшает максимальные скорости укорочения и расслабления в желудочковом миокарде лягушки.
2. Отрицательный инотропный эффект сероводорода в миокарде лягушки опосредуется снижением входящего кальциевого тока в результате активации АТФ-чувствительных К-каналов и цГМФ-стимулируемой фосфодиэстеразы II типа.
Научная новизна
В работе впервые показано, что гидросульфид натрия – донор H2S обратимо и дозозависимо снижал силу сократимости и уменьшал максимальные скорости укорочения и расслабления полоски миокарда лягушки. При этом субстрат синтеза сероводорода L-цистеин также оказывал отрицательный инотропный эффект, а блокатор цистатионин γ-лиазы увеличивал амплитуду сокращения, что указывает на возможность эндогенного синтеза H2S в сердце холоднокровных животных. Впервые исследованы внутриклеточные механизмы действия сероводорода в миокарде лягушки. Показано, что одной из мишеней действия H2S являются АТФ-чувствительные калиевые каналы, активация которых вызывает гиперполяризацию мембраны, снижение входящего Са-тока и уменьшение силы сокращения. Впервые показано взаимодействие системы NO и H2S в регуляции сократимости миокарда. Кроме того, впервые выявлена роль аденилатциклазной системы в эффектах H2S. Предположено, что активация фосфодиэстераз, гидролизующих цАМФ, в частности фосфодиэстеразы II, при действии H2S, особенно в условиях активации β-адренорецепторов, приводит к уменьшению уровня цАМФ в клетке и снижению входящего Са-тока, что сопровождается понижением силы сокращения.
Научно-практическая ценность
Полученные в работе данные расширяют представления о возможности регуляции сократительной функции миокарда эндогенными физиологически активными соединениями. Это, в частности, касается вопросов влияния газообразных посредников, имеющих уникальные свойства, отличающие их от классических медиаторов, на сократимость миокарда холоднокровных животных. Научную ценность представляют данные об участии АТФ-зависимых калиевых каналов и фосфодиэстераз в эффектах H2S, что в дальнейшем позволит провести эволюционный анализ механизмов регуляции инотропной функции сердца эндогенными газообразными посредниками как у холоднокровных, так и у теплокровных животных. Полученные данные имеют не только теоретическое, но и практическое значение при разработке средств фармакологической коррекции сердечной деятельности. Результаты исследования представляют практическую ценность для физиологов, биофизиков, биохимиков, фармакологов и нейрохимиков. Полученные данные используются при чтении лекций на кафедре физиологии человека и животных Казанского (Приволжского) федерального университета. Работа выполнена при финансовой поддержке грантов РФФИ (); «Ведущая научная школа» (НШ-5250.2010.4), гранта К. Цейс.
Личный вклад диссертанта
Приведенные в работе данные получены при личном участии соискателя на всех этапах работы, включая составление плана исследования, проведение экспериментов, обработку полученных данных и оформление публикаций.
Достоверность полученных данных
Достоверность полученных данных подтверждалась использованием достаточного объема экспериментальных исследований, постановкой и решением поставленных задач, статистической обработкой полученных результатов.
Апробация работы
Основные результаты диссертационной работы доложены на следующих конференциях и съездах: международном XIII Биологическом симпозиуме студентов и аспирантов «SymBioSE 2009», Международной конференции «Рецепция и внутриклеточная сигнализация» (Пущино, 2009, 2011), Всероссийском с международным участием, научном симпозиуме «Растущий организм: адаптация к физической и умственной нагрузке» (Казань, 2009, 2010), международной конференции молодых ученых "Биология - наука 21-го века" (Пущино, 2009, 2010), XX Съезде физиологического общества имени (Калуга 2010), Международном симпозиуме «Biological motility» (Пущино, 2009), ХVII и ХVIII Международной научной конференции студентов, аспирантов и молодых ученых (МГУ, 2010, 2011), XV и ХVI Всероссийской научно-практической конференции «Молодые ученые в медицине» (Казань, КГМУ, 2010, 2011), ежегодных научных конференциях в Казанском федеральном университете.
Реализация результатов исследования
По теме диссертации опубликовано 20 печатных работ, в том числе 4 публикации в рецензируемых журналах (из списка ВАК).
Структура и объем диссертации
Диссертация объемом 120 страниц состоит из введения, обзора литературы, описания методики исследования, результатов исследования и их обсуждения, выводов и списка литературы. Список цитируемой литературы включает 310 источников, из них 34 - отечественных и 276 - иностранных авторов. Диссертация содержит 30 рисунков и 2 таблицы.
ОБЪЕКТ И МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования проведены на 320 разнополых лягушках Rana ridibunda в осенне-зимний период. Эксперименты проводились с использованием миокарда лягушки. Сократительную активность миокарда в эксперименте in vitro изучали на изолированных полосках желудочков сердца с использованием метода тензометрии на установках Power Lab (AD Instruments, Австралия) или Biopac Systems, Inc. (США), оснащенных изометрическими датчиками силы МLТ 050/D или TSD 125C с диапазоном измерений 0-50 грамм. Препарат стимулировали электрическими импульсами с частотой 0.1 Гц через два серебряных электрода. Запись кривой сокращения регистрировали на персональном компьютере при помощи программного обеспечения "Chart 5.3". Сигналы обрабатывали с помощью программы Chart или Elf (автор ), силу сокращения определяли в граммах. Оценивали амплитуду сокращения, а также максимальные скорости укорочения и расслабления. Статистический анализ проводили с помощью стандартных методов, достоверность различий определяли с помощью параметрического t-критерия Стьюдента (, 1973).
Наркотизированное животное фиксировали, вскрывали грудную клетку и быстро извлекали сердце, которое помещали в специальную ванночку со стимуляцией. Из ткани миокарда желудочков вырезались полоски длиной 4-6 мм и шириной 0.8-1.0 мм. Препарат фиксировали вертикально одним концом к датчику, другим - к фиксирующему блоку и помещали в резервуар объемом 20 мл, в который подавался раствор Рингера для холоднокровных животных, содержащим в мМ: 118.0 NaCl, 2.5 KCI, 1.8 CaCl, 10 Trizma (pH – 7.3-7.4 T=200C). После погружения препарата в резервуар следовал «период приработки» в течение 40-60 мин, в ходе которого мышечным волокнам постепенно придавалось оптимальное натяжение. По окончанию приработки регистрировались исходные параметры сокращения в течение 5 мин, после чего в резервуар добавлялись фармакологические агенты. По окончании регистрации фармакологических веществ, препарат изолированной полоски миокарда отмывали рабочим раствором в течение 10 минут.
В качестве донора H2S использовали гидросульфид натрия (NaHS), так как в водном растворе он диссоциирует до Na2+ и HS-, затем HS - связывается с H+ с образованием H2S. В нейтральном растворе одна треть NaHS находится в виде газа – H2S и оставшиеся две трети – в виде HS− (R. O. Beauchamp et. al., 1984). В экспериментах использовали: блокаторы и активаторы ионных каналов - нифедипин, глибенкламид, миноксидил, тетраэтиламмоний (ТЕА), NS 8593, 4-аминопиридин (4-АП), кофеин, субстрат синтеза H2S – L-цистеин, блокаторы цистатионин γ-лиазы – β-цианоаланин и пропаргилглицин, неспецифичный блокатор фосфодиэстераз – 3-isobutyl-1-methylxanthine (IBMX), аналоги циклических нуклеотидов – 8BrcAMP, 8-(4-Chlorophenylthio)adenosine 3',5'-cyclic monophosphate sodium salt (pCPT-cAMP), ингибитор аденилатциклазы – cisN-(2-phenylcyclopentyl) azacyclotridecl-en-amine hydrochloride (MDL-12,330A), блокатор NO-синтазы - NG-нитро-L-аргинин метиловый эфир (L-NAME), донор NO - S–nitroso–N-acetylpenicillamine (SNAP), блокатор фосфодиэстеразы II - erytro-9-(2-hydroxy-3nonyl)-adenine) hydrochloride (EHNA), агонист β-адренорецепторов - изопротеренол. Вещества, нерастворимые в воде, растворяли в диметилсульфоксиде (ДМСО). Концентрация ДМСО в подаваемых растворах не превышала 0.1%, в данной концентрации ДМСО в контрольных экспериментах не оказывал влияния на силу сокращения миокарда. Все использованные вещества фирмы Sigma (США).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Эффекты донора Н2S – NaHS на сократимость изолированной полоски миокарда желудочка. Аппликация NaHS, донора H2S, в концентрациях 10–500 мкМ приводила к дозозависимому снижению силы сокращения изолированной полоски миокарда желудочка. Была выявлена эффективная концентрация (EC50) NaHS, которая составила 38±14 мкМ (Рис. 1 А, Б). Отрицательный инотропный эффект NaHS наблюдался с первых минут аппликации и выходил на плато к 20 мин эксперимента (Рис.1 А). Таким образом, NaHS оказывает отрицательный инотропный эффект в миокарде лягушки. Подобное действие NаHS также наблюдалось и у теплокровных животных (G. Yong, 2008; K. R. Olson, 2008). В дальнейших экспериментах использовали NaHS в концентрации 100 мкМ, который к 20 мин эксперимента снижал силу сокращения полоски миокарда до 66±6% (n=14, p<0.05).
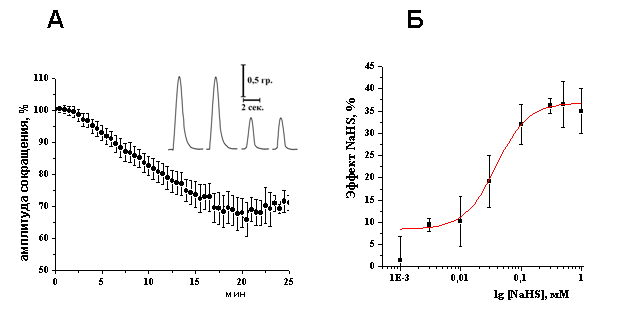

Рис. 1. Отрицательный инотропный эффект NaHS в миокарде желудочка лягушки.
A – Изменение амплитуды сокращений полоски миокарда при действии NaHS (100 мкМ) во времени. На вкладке показаны механограммы сокращения полоски миокарда в контроле и к 20 минуте аппликации NaHS,
Б – дозозависимость эффекта NaHS на амплитуду сокращения миокарда лягушки.
Влияние субстрата синтеза Н2S - L-цистеина и блокаторов фермента синтеза Н2S на амплитуду сокращения изолированной полоски миокарда. Для выявления возможности эндогенного синтеза Н2S использовали L-цистеин и блокаторы цистатионин γ-лиазы – одного из известных ферментов синтеза Н2S в миокарде. При добавлении L-цистеина в концентрации 200 мкМ наблюдалось снижение амплитуды сокращения полоски миокарда до 83±6% (n=6, p<0.05), а в концентрации 1 мМ L-цистеин угнетал силу сократимости до 58±4% (n=7, p<0.05) относительно контрольных значений к 20 мин аппликации (Рис. 2 А, Б). Для блокирования цистатионин γ-лиазы использовали β-цианоаланин и пропаргилглицин в концентрациях 500 мкМ. Аппликация β-цианоаланина приводила к повышению силы сократимости миокарда до 117±6% (n=8, p<0.05) относительно контрольного уровня, а пропаргилглицина – до 112±3 % (n=8, p<0.05) к 15 мин аппликации (рис. 2 Б). Таким образом, эндогенно синтезируемый H2S вызывал такие же эффекты, что и экзогенно апплицируемый, а блокаторы цистатионин γ-лиазы приводили к противоположному эффекту. В условиях блокирования цистатионин γ-лиазы β-цианоаланином аппликация L-цистеина в концентрациях как 200 мкМ, так и 1 мМ не вызывала отрицательного инотропного эффекта.
А Б
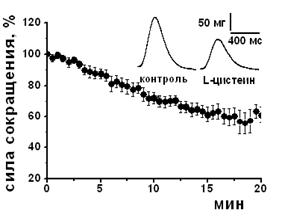
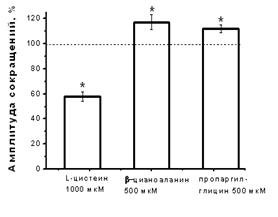
Рис. 2. Влияние субстрата и блокаторов синтеза сероводорода на сократимость миокарда
А – Динамика изменения силы сокращения при действии субстрата синтеза H2S L-цистеина в концентрации 1 мМ. На вкладке показаны оригинальные записи сокращений в контроле и при действии L-цистеина к 20 мин аппликации.
Б – Изменение силы сокращения миокарда при действии L-цистеина (1 мМ) и блокаторов цистатионин γ-лиазы – β-цианоланина (500 мкМ) и пропаргилглицина (500 мкМ). *p<0.05
Роль Са-каналов в эффектах NaHS на сократимость изолированной полоски миокарда желудочка. Известно, что ионы Са играют ключевую роль в регуляции сократимости миокарда. В ответ на деполяризацию мембраны кардиомиоцитов происходит открытие потенциал-зависимых Са-каналов L-типа, вход Са2+, который вызывает высвобождение Са2+ из внутриклеточных Са-депо через рианодиновые рецепторы и запускает процесс мышечного сокращения (M. D. Bers, 2002). Отрицательный инотропный эффект NaHS может быть связан с угнетением потенциал-зависимых Са-каналов L-типа, тем более, подобное влияние NaHS наблюдалось в кардиомиоцитах крысы (Y. G. Sun et al., 2008). Для блокирования потенциал-зависимых Са-каналов L-типа использовали нифедипин в концентрации 10 мкМ. Нифедипин приводил к снижению силы сокращения до 75±5% (n=5 p<0.05) (Рис. 3 А, Б). На фоне действия нифедипина NaHS уменьшал амплитуду сокращения до 72±2% (n=5, p<0.05) (Рис 3Б), что не отличалось от значений, полученных в контроле при аппликации NaHS. Следовательно, в сердце лягушки отрицательный инотропный эффект NaHS не связан с угнетением входящего Са-тока.
Для исследования роли внутриклеточных Са-депо в эффектах NaHS использовали кофеин, активирующий рианодиновые рецепторы саркоплазматического ретикулума. Аппликация кофеина в концентрации 3 мМ приводила к увеличению амплитуды сокращения миокарда до 127±11% (n=6, p<0.05). Эффект NaHS на фоне действия кофеина полностью сохранялся и к 20 мин аппликации составил 48±5% (n=6, p<0.05) (Рис. 3Б). Таким образом, отрицательный инотропный эффект H2S в миокарде лягушки не связан с его влиянием на выброс ионов Са из внутриклеточных Са-депо.
А Б
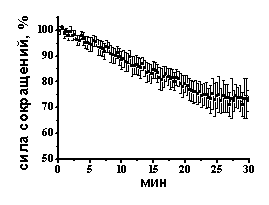
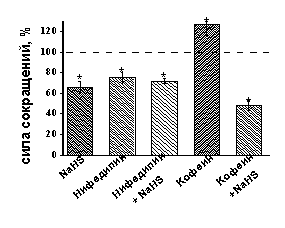
Рис.3. Роль потенциал-зависимых Са-каналов и внутриклеточных Са депо в отрицательном инотропном эффекте NaHS
А- Динамика изменения силы сокращения при ингибировании Са-каналов L-типа нифедипином (10 мкМ).
Б - Изменение силы сокращения при аппликации NaHS, нифедипина, кофеина и NaHS на фоне действия нифедипина и кофеина. При анализе эффектов NaHS за 100% принимались значения, полученные в контроле и на фоне действия нифедипина и кофеина. *p<0.05
Роль К-каналов в отрицательном инотропном эффекте NaHS в изолированной полоске миокарда лягушки. Известно, что целый ряд К-токов участвует в реполяризации мембраны кардиомиоцитов в различные фазы потенциала действия. К ним можно отнести два типа быстро активирующихся и инактивирующихся К-токов (Ito, f и Ito, s) и несколько компонентов К-токов задержанного выпрямления, включающих IKr (rapid), IКs (slow), IKur (ultrarapid) и др. (J. M. Nerbonne, 2005, J. Tamargo et al., 2004). Кроме того, в регуляции длительности потенциала действия и сократимости миокарда могут принимать участие и недавно выявленные в сердце теплокровных животных Са-активируемые К-каналы малой проводимости (Y. Xu et al., 2003).
Для ингибирования К–каналов использовали неселективный блокатор К–каналов ТЕА. Аппликация ТЕА в концентрациях от 3 до 10 мМ. увеличивала силу сократимости полоски миокарда до 159±24% (n=5, p<0.05), 202±23% (n=7, p<0.05) и 194±12% (n=4, p<0.05) (Рис. 4) относительно контрольных значений, соответственно. На фоне действия ТЕА во всех используемых концентрациях отрицательный инотропный эффект NaHS полностью сохранялся (рис. 4). Для блокирования потенциал-зависимых К-каналов использовали 4-аминопиридин (4-АП) в концентрациях 2.5 и 5 мМ. 4-АП в обеих концентрациях приводил к увеличению амплитуды сокращения полоски миокарда до 133±12% (n=11, p<0.05) и 191±30% (n=7, p<0.05), соответственно (Рис. 4). Эффект NaHS на фоне действия 4-АП полностью сохранялся (Рис. 4).
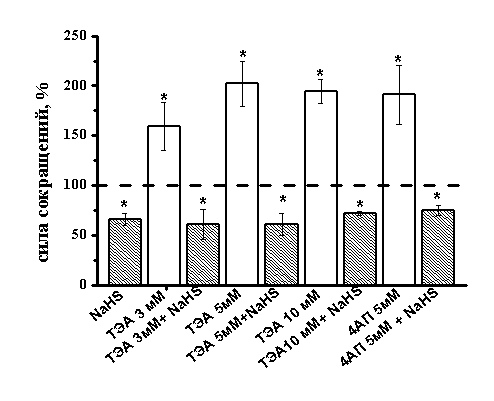
Рис. 4. Влияние NaHS на амплитуду сокращений миокарда в условиях ингибирования калиевых каналов разных типов
На диаграмме показан эффект NaHS в контроле, тетраэтиламмония (ТЕА) в разных концентрациях (3, 5, 10 мМ), 4-аминопиридина (4-АП) (5 мМ) и NaHS на фоне действия блокаторов. При анализе эффектов NaHS за 100% принимались значения, полученные в контроле и на фоне действия ТЭА или 4-АП.
*p<0.05
Известно, что Са-активируемые К-каналы могут быть мишенью действия Н2S (G. F. Sitdikova, 2010), активация которых в сердце теплокровных животных приводит к укорочению потенциала действия и снижению амплитуды сокращения миокарда. Блокатор Са-активируемые К-каналы малой проводимости – NS 8593 в концентрации 1 мкМ не приводил к достоверным изменениям амплитуды сокращения полоски миокарда. Эффект NaHS в данных условиях полностью сохранялся. Полученные данные свидетельствуют, что отрицательный инотропный эффект NaHS в миокарде лягушки не связан с изменением работы потенциал-зависимых и кальций-активируемых К-каналов.
Роль АТФ-чувствительных К-каналов в эффектах сероводорода. Одним из известных механизмов действия H2S в гладких мышцах сосудов и кардиомиоцитах крысы является активация АТФ-зависимых К-каналов (К(АТФ)-каналы) (B. Cheng, 2004, W. Zhao, 2001, , 2009). Для активации К(АТФ)-каналов использовали миноксидил (100 мкМ) и диазоксид (200 мкМ). При добавлении миноксидила происходило уменьшение силы сокращения полоски миокарда до 51±7% (n=5, p<0.05), диазоксида - до 68±8% (n=12, p<0.05).
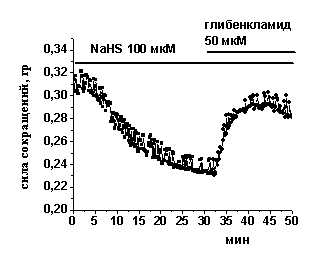
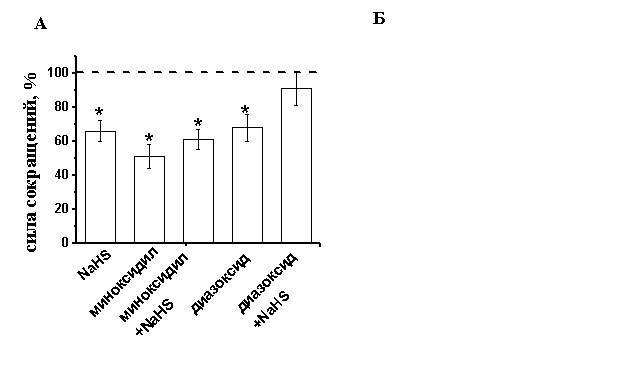

Рис. 5. Роль К(АТФ)-каналов в эффектах сероводорода на силу сокращения миокарда лягушки
А - На диаграмме показаны амплитуды сокращений миокарда при действии NaHS в контроле, миноксидила (100 мкМ), диазоксида (200 мкМ) и NaHS на фоне действия данных соединений. При анализе эффектов NaHS за 100% принимались значения, полученные на фоне действия миноксидила или диазоксида. * - p<0.05
Б - Пример эксперимента, в котором блокатор К(АТФ)-каналов глибенкламид 50 мкМ восстанавливает силу сокращения миокарда после действия NaHS.
На фоне миноксидила отрицательный инотропный эффект NaHS сохранялся, амплитуда сокращений уменьшалась до 61±6% (n=5, p<0.05) (Рис. 5 А), однако, на фоне действия диазоксида NaHS не приводил к изменениям амплитуды сокращения, которая к 20 мин составила 91±10 (n=10, р>0.05) (Рис. 5 А). По-видимому, эффект миноксидила в миокарде лягушки не является специфичным для К(АТФ)-каналов, а снижение силы сокращения при действии миноксидила может быть связано с ингибированием Са-каналов L-типа, показанное в желудочковых кардиомиоцитах морской свинки (S. Hayashi , 1993). Блокатор К(АТФ)-каналов глибенкламид в концентрации 50 мкМ не изменял достоверно силу сокращения полосок миокарда 108±5% (n=12, p<0.05). В условиях блокирования К(АТФ)-каналов глибенкламидом, NaHS снижал силу сокращения миокарда до 78±1% (n=13, p<0.05), что достоверно меньше эффекта NaHS в контроле. Было предположено, что снижение силы сокращения при действии NaHS может быть связано с активацией К(АТФ)-каналов. Эту гипотезу подтвердили эксперименты, в которых глибенкламид апплицировали после развития эффекта NaHS. В результате добавления глибенкламида происходило восстановление амплитуды сокращения полоски миокарда в среднем на 16±4% (n=5, p<0.05) (Рис.5 Б). Полученные данные указывают, что К(АТФ)-каналы участвуют в реализации отрицательного инотропного эффекта NaHS в миокарде лягушки.
Эффекты сероводорода на фоне закисления внутриклеточной среды кардиомиоцитов. Известно, что внутриклеточный рН играет важную роль в регуляции сократимости миокарда. «Закисление» внутриклеточной среды кардиомиоцитов сопровождается накоплением ионов Са в результате изменения направления работы Na/Ca-обменника и снижения функциональной активности Са-насосов плазматической мембраны и саркоплазматического ретикулума, уменьшением чувствительности миофибрилл к ионам Са. В результате происходит снижение сократительной функции миокарда. Имеются данные о том, что H2S вызывает закисление внутриклеточной среды в гладкомышечных клетках аорты крысы путем активации Cl-/HCO3- обменника, что частично опосредует H2S-вызванную вазорелаксацию (S. W. Lee et al., 2007). Кроме того, накопление избыточного количества протонов (Na+, Н+) в кардиомиоцитах происходит и при некоторых патофизиологических состояниях в условиях анаэробного гликолиза. Учитывая, что Н2S в высоких концентрациях может нарушать процессы окислительного фосфорилирования, сопровождающееся закислением внутриклеточной среды, исследовали эффекты газа на фоне действия пропионата натрия, который проникая через клеточную мембрану, закисляет содержимое клетки. В данной серии экспериментов регистрацию силы сокращений в контроле осуществляли в растворе пропионата натрия в концентрациях 20 и 40 мМ. Эффект NaHS на фоне действия пропионата полностью сохранялся и составил 66±6 (n=4, p<0.05), 63±13% (n=8, p<0.05) по отношению к начальному уровню, что не отличается от действия NaHS в контроле.
Роль аденилатциклазной системы в эффектах сероводорода на сократимость миокарда. В нервной системе и кардиомиоцитах теплокровных животных эффекты H2S могут быть опосредованы через изменение уровня цАМФ (Q. C. Yong, 2008, H. Kimura 2000). Увеличение уровня цАМФ является механизмом регуляции сократимости миокарда в ответ на активацию β-адренорецепторов. Для блокирования синтеза цАМФ использовали MDL-12,330A в концентрации 3 мкМ, аппликация которого приводила к понижению силы сокращения миокарда до 81±3% (n=11; p<0,05) (Рис. 6). Эффект NaHS на фоне действия MDL-12,330A был выражен в меньшей степени, чем в контроле и составил 87±2% (n=13, p<0.05) (Рис 6) по отношению к начальному уровню.
Для увеличения концентрации цАМФ использовали мембранопроникающие аналоги – 8BrcAMP и pCPTcAMP в концентрации 100 мкМ. Аппликация 8BrcAMP или pCPTcAMP не приводила к достоверным изменениям амплитуды сокращения. К 20 мин действия 8ВrсАМР сила сокращения полоски миокарда составила 101±5% (n=5, p>0.05), а pCPTcAMP – 110±11% (n=5, p>0.05) (Рис.6) по отношению к контрольным значениям. Добавление NaHS на фоне действия 8BrcAMP снижало сократимость полоски до 70±6% (n=5, p<0.05) и до 57±11% (n=5, p<0.05) в случае pCPTcAMP (Рис. 6). Таким образом, эффект NaHS на фоне действия аналогов цАМФ сохранялся в той же степени, что и в контроле.
Другим способом увеличения уровня цАМФ в клетке является ингибирование фосфодиэстераз. Неспецифический блокатор фосфодиэстераз IBMX (200 мкМ) приводил к увеличению силы сокращения до 120±4% (n=7, p<0.05) к 8 минуте аппликации, что, по-видимому, связано с накоплением цАМФ в кардиомиоцитах (Рис. 6). На фоне повышения уровня эндогенных циклических нуклеотидов NaHS снижал силу сокращения полоски миокарда до 82±4% (n=5) и этот эффект был достоверно меньше, чем эффект донора H2S в контроле (p<0.05) (Рис. 6).
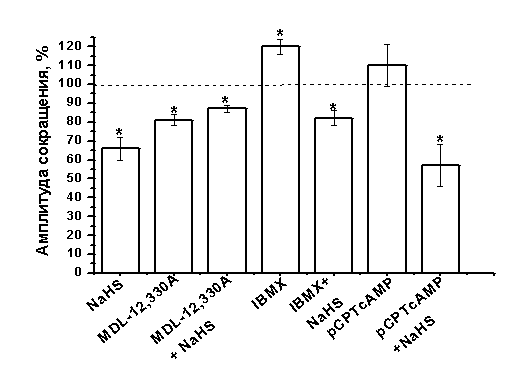
Рис. 6. Влияние гидросульфида натрия в условиях понижения и повышения уровня циклических нуклеотидов.
Представлены амплитуды сокращения миокарда при действии NaHS (100 мкМ) в контроле, MDL-12,330A (3 мкМ), IBMX (200 мкМ), pCPTcAMP (100 мкМ) и NaHS на фоне действия указанных агентов. При анализе эффектов NaHS за 100% принимались значения, полученные в контроле и на фоне действия MDL-12,330A, IBMX, pCPTcAMP, соответственно.
*- p<0.05
Таким образом, эффект H2S частично снимался в условиях ингибирования аденилатциклазы или блокирования фосфодиэстераз, что подтверждает участие цАМФ-зависимых путей в регуляции сократимости при действии газа. Отсутствие эффекта pCPTcAMP или 8BrcAMP на силу сокращения миокарда свидетельствует о том, что они не могут имитировать ситуацию, при которой повышается эндогенный уровень цАМФ (как в случае с IBMX). Кроме того, одним из ключевым факторов влияния цАМФ на сократимость является компартментализация этого циклического нуклеотида вблизи мишеней действия, а повышение общего уровня циклического нуклеотида недостаточно для специфической регуляции белковой мишени (М. Zaccolo et al., 2009). Полученные данные указывают на то, что отрицательный инотропный эффект NaHS в миокарде лягушке может быть связан с активацией фосфодиэстераз, гидролизующих цАМФ вблизи потенциал-зависимых Са-каналов и снижающих, соответственно, количество активных цАМФ-зависимых протеинкиназ.
Роль оксида азота в эффектах сероводорода на сократимость миокарда. Известно, что NO является важным регулятором силы сокращения в миокарде у лягушки (J. M. Chesnais, R. Fischmeister, P. F. Méry, 1999). Исходя из данных о взаимодействии NO и H2S в регуляции сосудистого тонуса (R. Hosoki et al., 1997, S. Kubo et al., 2007), нами был проведён анализ эффектов NaHS в условиях ингибирования синтеза NO и повышения его эндогенной концентрации. Блокатор различных форм NО-синтаз L-NAME (100 мкМ) приводил к повышению амплитуды сокращений, которая к 15 мин аппликации составила 115±4% (n=7, p<0.05) (Рис. 7 А). В условиях блокирования синтеза NO NaHS снижал силу сокращений миокарда до 65±8% (n=7) (Рис.7 А), что не отличалось от эффекта H2S в контроле и указывает на отсутствие влияние NaHS на синтез NO. Донор NO – SNAP в концентрации 10 мкМ уменьшал сократимость миокарда до 86±5% (n=10, p<0.05) (Рис. 7 А). На фоне действия SNAP отрицательный инотропный эффект NaHS был значительно меньше выражен, чем в контроле и составил 89±2% (n=11, p<0.05) (Рис. 7 А). Полученные данные указывают на участие сигнальных путей, запускаемых NO в эффектах NaHS. Известно, что отрицательный инотропный эффект NO в миокарде лягушки опосредуется увеличением уровня цГМФ, мишенью которого является цГМФ-зависимая фосфодиэстераза (фосфодиэстераза II), активация которой ведет к понижению уровня цАМФ, угнетению Са-тока и снижению силы сокращения (M. Dittrich et al., 2001). Было предположено, что предварительная аппликация донора NO приводит к активации фосфодиэстеразы II и снижению уровня цАМФ. В этих условиях эффект NaHS уменьшался, что указывает на возможное участие фосфодиэстеразы этого типа в эффекте H2S. Для подтверждения этой гипотезы использовали специфический блокатор цГМФ-стимулируемой цАМФ-специфичной фосфодиэстеразы (II типа) EHNA в концентрации 30 мкМ. На фоне действия EHNA отрицательный инотропный эффект NaHS не проявлялся, и к 20 мин аппликации сила сокращения миокарда составила 95±11% (n=6, p>0.05) (Рис. 7 А).
А Б
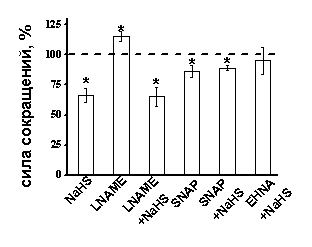
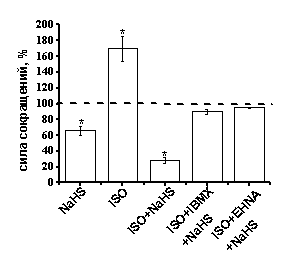
Рис. 7. Роль оксида азота, β-адренорецепторов и фосфодиэстеразы II в эффектах сероводорода
А – Показаны амплитуды сокращений миокарда при действии NaHS в контроле, LNAME (100 мкМ), SNAP (10 мкМ) и NaHS на фоне действия LNAME (100 мкМ), SNAP (10 мкМ) и EHNA (30 мкМ).
Б - На диаграмме показаны амплитуды сокращений миокарда при действии NaHS в контроле, изопротеронола (ISO) (1 мкМ), NaHS на фоне ISO (1 мкМ) и ISO (1 мкМ)+IBMX (200 мкМ).
При анализе эффектов NaHS за 100% принимались значения, полученные на фоне действия вышеперечисленных веществ.
* - p<0.05
Эффекты сероводорода в условиях активации β-адренорецепторов и блокирования фосфодиэстераз. Для активации β-адренорецепторов в кардиомиоцитах использовали изопротеренол в концентрации 1 мкМ. Аппликация изопротеренола вызывала увеличение силы сократимости миокарда до 170±16% (n=11, p<0.05) (рис. 7 Б). Эффект NaHS на силу сокращения миокарда в условиях предварительной активации β-адренорецепторов изопротеренолом составил 28±4% (n=5, p<0.05) (рис. 7 Б), что достоверно больше, чем действие NaHS в контроле. По-видимому, это указывает на участие внутриклеточных систем, запускаемых при активации β-адренорецепторов в эффектах H2S. Для подтверждения нашей гипотезы об участии фосфодиэстераз в эффектах NaHS использовали одновременную аппликацию изопротеренола и IBMX. В условиях одновременной активации β–адренорецепторов и блокирования фосфодиэстераз IBMX отрицательный инотропный эффект NaHS практически не проявлялся, амплитуда сокращений составила 90±3% (n=5, p>0.05) (рис. 7 Б). Для подтверждения нашей гипотезы об участии фосфодиэстеразы II в эффектах H2S использовали EHNA в концентрации 30 мкМ. В условиях одновременной активации β–адренорецепторов и блокирования фосфодиэстеразы II отрицательный инотропный эффект NaHS также не проявлялся и амплитуда сокращений составила 94±7% (n=6, p>0.05)
На основании полученных данных можно предположить, что отрицательный инотропный эффект NaHS опосредуется активацией фосфодиэстеразы II, что приводит к уменьшению уровня цАМФ и снижению входящего Са-тока.
Заключение
Полученные нами данные свидетельствуют о том, что донор сероводорода - NaHS оказывает отрицательный инотропный эффект в миокарде лягушки, уменьшая максимальные скорости укорочения и расслабления полоски. Субстрат синтеза Н2S - L-цистеин вызывал снижение амплитуды сокращений миокарда аналогичное действию NaHS, тогда как блокаторы цистатионин γ-лиазы вызывали противоположный эффект. При этом в условиях ингибирования цистатионин γ-лиазы эффект L-цистеина не проявлялся, что указывает на возможность синтеза Н2S в миокарде холоднокровных животных ферментом цистатионин γ-лиаза. Анализ ионных механизмов действия H2S выявил отсутствие его влияния на потенциал-зависимые Са-каналы L-типа, Са-каналы внутриклеточных Са-депо, потенциал - и кальций-активируемые К-каналы малой проводимости. Использование активаторов и блокатора К(АТФ)-каналов позволило сделать заключение, что К(АТФ)-каналы участвуют в реализации отрицательного инотропного эффекта NaHS в миокарде лягушки. По-видимому, активация калиевой проводимости под действием H2S приводит к укорочению потенциала действия, снижению входящего Са-тока, что, в свою очередь, ведет к уменьшению силы сокращения миокарда.
Известно, что регуляция Са-тока и сократимости может осуществляться опосредовано через фосфорилирование протеинкиназами А потенциал-зависимых Са-каналов при повышении уровня цАМФ в ответ на активацию β-адренорецепторов (T. J. Kamp et al., 2000). В наших экспериментах как снижение (блокирование аденилатциклазы), так и повышение эндогенного уровня цАМФ (блокирование фосфодиэстераз) уменьшало отрицательный инотропный эффект H2S. По-видимому, эффект NaHS реализуется путем уменьшения внутриклеточной концентрации цАМФ в результате снижения активности аденилатциклазы, либо активации фосфодиэстераз. Исследование взаимодействия двух систем газообразных посредников – H2S и NO показало, что на фоне предварительной аппликации донора NO SNAP эффект NaHS был выражен в меньшей степени, чем в контроле, что может быть связано с участием сигнальных систем, активируемых NO в эффектах H2S. Действительно, на фоне ингибирования цГМФ-активируемой фосфодиэстеразы (фосфодиэстеразы II) EHNA эффект NaHS полностью предотвращался.
В желудочковых кардиомиоцитах лягушки Са-ток регулируется локальным повышением уровня цАМФ вблизи цитоплазматической мембраны, а фосфодиэстеразы обеспечивают компартментализацию цАМФ, предотвращая его диффузию вдоль длины кардиомиоцита. Действительно, в наших экспериментах в условиях локального повышения уровня цАМФ при активации β-адренорецепторов эффект H2S был выражен сильнее, чем в контроле. При этом одновременная активация β-адренорецепторов и блокирование фосфодиэстераз IBMX или EHNA предотвращало развитие отрицательного инотропного эффекта H2S.
Таким образом, в основе отрицательного инотропного действия H2S в миокарде лягушки лежит снижение уровня цАМФ и усиление гидролиза циклического нуклеотида в результате активации цГМФ-стимулируемых фосфодиэстераз II типа. В результате происходит уменьшение активности цАМФ-зависимых протеинкиназ и фосфорилирования потенциал-зависимых Са-каналов, уменьшение входа Са в клетку и снижение силы сокращения миокарда.
Выводы
1. Донор сероводорода NaHS вызывает дозозависимое и обратимое снижение амплитуды сокращения миокарда лягушки, уменьшая максимальные скорости укорочения и расслабления полоски.
2. L-цистеин – субстрат синтеза сероводорода оказывает отрицательный инотропный эффект в миокарде лягушки, тогда как блокаторы цистатиони–γ-лиазы - фермента синтеза H2S – пропаргилгицин и β-цианоаланин увеличивали амплитуду сокращения полоски миокарда.
3. В условиях блокирования потенциал-зависимых Са-каналов L-типа нифедипином и активации внутриклеточных Са-депо кофеином эффект NaHS полностью сохранялся.
4. В условиях блокирования потенциал - и кальций-зависимых калиевых каналов тетраэтиламмонием, 4–аминопиридином и NS 8593 влияние NaHS на сократимость полоски миокарда не отличалось от контроля.
5. Эффект NaHS частично снимался при блокировании и активации АТФ-зависимых К-каналов глибенкламидом и диазоксидом, соответственно.
6. Отрицательное инотропное действие NaHS полностью сохранялось в условиях закисления внутриклеточной среды пропионатом натрия.
7. Влияние NaHS на сократимость миокарда уменьшалось при ингибировании аденилатциклазы с помощью MDL-12330А и в условиях блокирования различных типов фосфодиэстераз IBMX.
8. Отрицательный инотропный эффект NaHS не изменялся в условиях блокирования синтеза оксида азота (L-NAME), уменьшался на фоне предварительной аппликации оксида азота (SNAP) и полностью предотвращался в условиях блокирования фосфодиэстеразы II EHNA.
9. Эффект NaHS на силу сокращения миокарда был выражен в большей степени в условиях предварительной активации β-адренорецепторов изопротеренолом и не проявлялся при одновременной активации β–адренорецепторов и блокировании фосфодиэстераз IBMX или EHNA.
Список работ опубликованных по теме диссертации
1. , , , Зефиров циклических нуклеотидов в эффектах сероводорода на освобождение медиатора в нервно-мышечном синапсе лягушки. //Нейрохимия, 2009, т.26, № 4, С. 1-7. МАИК «Наука/Интерпериодика» ISSN(p):
2. Sitdikova G. F., Gerasimova E. V., Khaertdinov N. N., Zefirov A. L. Role of Cyclic Nucleotides in Effects of Hydrogen Sulfide on the Mediator Release in Frog Neuromuscular Junction. //Neurochemical Journal, 2009, Vol. 3, No. 4, pp. 282–287
3. , , Зефиров роли кальциевых и калиевых каналов в эффектах сероводорода на сократимость миокарда лягушки.// Бюллетень экспериментальной биологии и медицины. -2011. – Т.151, № 2, C.124-128
4. Abramochkin D. V., Haertdinov N. N., Porokhnya M. V., Zefirov A. L., Sitdikova G. F., Carbon monoxide affects electrical and contractile activity of rat myocardium. // Journal of Biomedical Science 2011, 18:40 doi:10.1186/8-40.
5. , , , Влияние монооксида углерода на параметры электрической и сократительной активности предсердного миокарда крысы. // доклады академии наук, 2011, том 439, № 2, с. 274–278
6. , , Ситдикова в регуляции сократимости миокарда лягушки// Биологические мембраны (принята в печать) 2012
7. , Сергеева сероводорода на частоту и силу сокращения сердца лягушки // Тезис в сборнике. Биология наука ХХI века. 13-я международная конференция молодых ученых. Пущино 2009. С.127.
8. , Сергеева нового газообразного посредника-сероводорода на сократимость миокарда желудочков лягушки. // Тезис в сборнике. Биология наука ХХI века. 13-я международная конференция молодых ученых. Пущино 2009. С.127-128.
9. Khaertdinov N. N., Sergeeva E. V., Shafigullin M. U. Hydrogen sulfide influence on rana ridibunda myocard contractility // Тезис в сборнике. Abstracts of the 13th annual Symposium for Biology Students of Europe «SymBioSE 2009» «Biology: Expasion of Borders» P.103-104.
10. , , Зефиров донора сероводорода - гидросульфида натрия на сократимость изолированной полоски миокарда желудочка лягушки. // VII Всероссийская конференция с международным участием “Механизмы функционирования висцеральных систем”, посвященной 160-летию со дня рождения - Санкт-Петербург, 29 сентября – 2 октября 2009 года. – С. 46.
11. , Яковлева сероводорода на сократимость миокарда в условиях ингибирования NO – синтазы. // Тезис в сборнике. ХV Всероссийская научно - практическая конференция 2010. С. 297-298.
12. Khaertdinov N. N., Yakovlev A. V., Sitdikova G. F. Effects of hydrogen sulfide on frog myocardium after inhibition of ATP-depended potassium channels. // Biological motility: from fundamental achievements to nanotechnologies. – Pushcino:Synchrobook – 2010 - P. 122-125
13. , Ситдикова калиевых каналов в отрицательном инотропном эффекте сероводорода на сердце лягушки. // Тезисы докладов XXI Съезда физиологического общества им. , Калуга 19-25 сентября 2010, М.-Калуга:ООО “БЕСТ-принт”, стр 650.
14. , Роль аденилатциклазной системы в эффектах сероводорода на сократимость миокарда лягушки. // Материалы Х юбилейной Всероссийской научной конференции с международным участием «Физиологические механизмы адаптации растущего организма», Казань, 25-27 июня 2010 г, Казань: ТГГПУ, С. 174-175.
15. , Ахметшина сероводорода на сократимость миокарда лягушки в условиях блокирования АТФ-зависимых калиевых каналов. // Тезис в сборнике. ХVII Международная научная конференция студентов, аспирантов и молодых ученых. Ломоносов-2010 С.290-291.
16. , , Ситдикова сероводорода на сократимость миокарда лягушки Rana Ridibunda и роль калиевых каналов в его эффектах. // Рецепция и внутриклеточная сигнализация. Сборник статей. - Пущино.- 2011. – Т.1.-С.
17. , , Ахметшина роли внутриклеточной концентрации кальция в эффектах сероводорода на сократимость миокарда лягушки. // XVIII Международная научная конференция студентов, аспирантов и молодых ученых. Сборник тезисов докладов «Ломоносов – 2011» – Москва, 2011 г. – С. 247-248.
18. , , Ситдикова ионных механизмов действия сероводорода в миокарде лягушки. //Сборник статей по материалам II международной научной конференции "Свободные радикалы, антиоксиданты и старение", Астрахань:АГУ, С. 155-158
19. , Эндогенный уровень цАМФ опосредует эффекты гидросульфида натрия на силу сокращения миокарда лягушки. // XLIX Международная научная студенческая конференция «Студент и научно-технический прогресс» - Новосибирск, 16-20 апреля 2011 г. - С. 4.
20. , , Ситдикова оксида азота в эффектах сероводорода на сократимость миокарда лягушки. // XIV международное совещание и VII школа по эволюционной физиологии, посвященные памяти академика . Сборник тезисов докладов и лекций – Санкт-Петербург, 24-29 октября 2011 г. – С. 20-21.
Выражаю искреннюю благодарность чл.-корр. РАМН, д. м.н., профессору за консультативную помощь и ценные рекомендации при выполнении и обсуждении работы.



