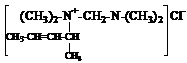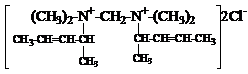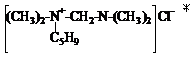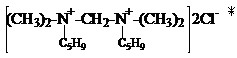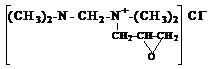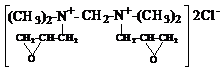На правах рукописи
СИНТЕЗ БАКТЕРИЦИДОВ И ИНГИБИТОРОВ
СЕРОВОДОРОДНОЙ КОРРОЗИИ
Специальность 02.00.13 - Нефтехимия
Автореферат
диссертации на соискание ученой степени
кандидата химических наук
Работа выполнена в Стерлитамакской Государственной Педагогической Академии им. Зайнаб Биишевой
Научный руководитель: доктор химических наук, профессор
Официальные оппоненты: доктор технических наук, профессор
доктор химических наук, профессор,
Фахретдинов Риваль Нуретдинович
Ведущая организация: -УфаНИПИНефть» г. Уфа.
Защита состоится «13»_апреля_2010 г. в _10_ч, в ауд. 202_на заседании диссертационного совета Д.212.200.12 в Российском государственном университете нефти и газа им по адресу ГСП-1, г. Москва, Ленинский проспект, 65
С диссертацией можно ознакомиться в библиотеке Российского государственного университета нефти и газа им
Автореферат разослан «___»___марта__ 2010 года.
Ученый секретарь
Диссертационного совета
к. т.н.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Практика эксплуатации стального оборудования нефтяных скважин, емкостей, нефтепроводов показывает, что одним из основных факторов аварий (около 80%) и преждевременного выхода оборудования из строя является коррозия наружных и внутренних стенок труб нефтепромыслового оборудования. Коррозия, имеющая место при контакте поверхности стали со смесью жидких и газообразных углеводородов, особенно интенсифицируется при насыщении их сероводородом и углекислым газом, являющимися продуктами жизнедеятельности сульфатвосстанавливающих бактерий (СВБ).
Среди различных методов борьбы с коррозией нефтепромыслового оборудования и трубопроводов ведущее место в настоящее время и на ближайшую перспективу принадлежит ингибиторной защите, как не требующей значительных капитальных вложений и серьезной перестройки технологии добычи, сбора и подготовки нефти.
Органические ингибиторы коррозии (ИК) обеспечивают высокую степень защиты оборудования нефтедобычи и нефтесбора от коррозии при малых концентрациях в коррозионной среде. ИК обладают быстродействием и их применение экономически эффективно. Поэтому ни одно месторождение, содержащее агрессивные компоненты, не эксплуатируется без применения ингибиторной защиты от коррозии. Достоинством этого метода является его простота и экономичность, возможность использования, как на новых скважинах, так и на находящихся уже в эксплуатации, что позволяет в процессе освоения месторождений легко заменять существующий ингибитор на более эффективный, не нарушая при этом технологию добычи на промыслах.
Несмотря на имеющуюся широкую номенклатуру замедлителей коррозии и бактерицидов, идет постоянный поиск новых, более эффективных веществ, обеспеченных отечественной сырьевой базой, способных выступать как в роли ингибиторов универсального действия, но и как бактерицидов, так как СВБ в водных средах быстро адаптируются к реагентам.
Исследования прошлых лет показали эффективность использования водных растворов четвертичных аммонийных солей как ИК и бактерицидов.
Целью настоящей работы является синтез новых четвертичных аммонийных солей и исследование их бактерицидных и ингибирующих свойств, подбор оптимальной товарной формы реагентов, разработка ресурсосберегающей, экологически чистой технологии их получения, с использованием в качестве сырья целевых и побочных продуктов предприятий г. Стерлитамака.
Для достижения поставленной цели решены следующие задачи:
– разработка методов синтеза четвертичных аммонийных солей на основе этаноламинов и N, N’-тетраметил-диаминометана;
– проведение испытаний полученных соединений в качестве бактерицидов и ингибиторов коррозии металлов;
– подбор оптимальных условий получения четвертичных аммонийных солей;
– разработка простой безотходной технологии получения синтезированных соединений.
Научная новизна:
Алкенилированием N, N’-тетраметил-диаминометана с эпихлоргидрином, гидрохлоридом пиперилена и смесью гидрохлоридов изопрена синтезированы новые хлористые соли, полностью подавляющие рост сульфатвосстанавливающих бактерий при концентрации 100-150 мг/л и ингибирующие сероводородную коррозию металлов на 82-96%.
На основе этаноламинов с эпихлоргидрином, гидрохлоридом пиперилена и смесью гидрохлоридов изопрена получены новые четвертичные аммонийные соли, подавляющие рост СВБ при концентрации 150-200 мг/л и ингибирующие сероводородную коррозию металлов на 68-72%.
Изучена бактерицидная и ингибирующая активность синтезированных соединений и влияние их строения.
Установлено, что кватернизация N, N’-тетраметил-диаминометана по одному атому азота усиливает ингибирующие и ослабляет бактерицидные свойства его аммонийной соли, а кватернизация по двум атомам азота – наоборот усиливает бактерицидные и ослабляет ингибирующие свойства. Для солей на основе этаноламинов эта зависимость прослеживается от числа (НО-С2Н4)-групп, т. е. с увеличением числа (НО-С2Н4)-групп бактерицидная активность солей возрастает, а защитная эффективность – уменьшается.
Практическая значимость работы:
– полученные реагенты расширяют и углубляют известные сведения о химии четвертичных аммонийных солей и представляют интерес, как в теоретическом, так и в прикладном аспекте.
– определены четвертичные аммонийные соли (ЧАС), применение которых дает наибольший защитный и бактерицидный эффект;
– разработана опытно-промышленная установка получения данных реагентов.
Публикации. По материалам диссертации опубликованы 3 статьи в журналах «Нефтехимия», «Башкирский химический журнал», «Коррозия: материалы, защита», 8 тезисов, опубликованных на Международной научно-практической конференции «Нефтегазопереработка и нефтехимия-2007», 2007 г., XXI Международной научно-технической конференции «Химические реактивы, реагенты и процессы малотоннажной химии», 2008 г., V международной научно-технической конференции «Инновации и перспективы сервиса», 2008 г. и во внутривузовских конференциях.
Структура и объем работы. Диссертация включает введение, пять глав, обобщающие выводы и список литературы из 142 наименований работ отечественных и зарубежных авторов. Работа изложена на 112 страницах машинописного текста, содержит 14 рисунков и 21 таблица.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Во введении показана актуальность проблемы защиты нефтегазодобывающего оборудования от коррозионного разрушения, вызванного СВБ. Обоснованы цель и задачи исследования.
В первой главе представлен обзор различных классов химических соединений, обладающих бактерицидными и ингибирующими коррозию металлов свойствами. Показано, что основная роль отводится азотсодержащим соединениям.
Вторая глава посвящена выбору и обоснованию объекта исследования, приведены характеристики и физико-химические свойства исходных соединений, представлены методики получения четвертичных аммонийных солей в кристаллическом виде и в виде водных растворов, а также методики исследования синтезированных солей в качестве бактерицидов и ингибиторов коррозии металлов.
В третьей главе приведены результаты обсуждения экспериментов по синтезам бактерицидов и ингибиторов коррозии, приведены характеристики и физико-химические свойства синтезированных соединений, доказано строение синтезированных соединений.
Синтез четвертичных аммонийных солей на основе
N, N’-тетраметилдиаминометана
Взаимодействием N, N’-тетраметилдиаминометана (ТМДМ) с гидрохлоридом пиперилена, смесью гидрохлоридов изопрена и эпихлоргидрином были синтезированы моноалкенил-N, N’-тетраметил-диаминометанхлориды и диалкенил-N, N’-тетраметил-диаминометанхлориды.
Схематично получение хлористых солей можно представить в следующем виде:
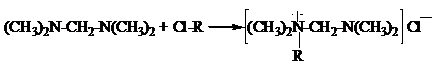 а) синтез моноалкениламмонийных солей
а) синтез моноалкениламмонийных солей
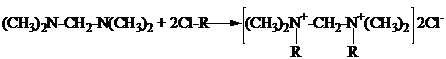 б) синтез диалкениламмонийных солей
б) синтез диалкениламмонийных солей
![]()
![]() где R – ; ; смесь гидрохлоридов изопрена:
где R – ; ; смесь гидрохлоридов изопрена:
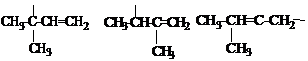 |
, , (далее обозначим –С5Н9).
Синтезы ЧАС проводили при атмосферном давлении, в токе инертного газа азота, при постоянном перемешивании, мольное соотношение АХ : ТМДМ от 1,0 : 2,3, температура от 200 до 900С, продолжительность реакции менялась от 1 до 9 ч. Реакции вели в растворе обессоленной воды и без растворителя.
С целью определения влияния условий проведения синтеза хлористых солей моно - и диалкенилN, N’-тетраметилдиаминометанов выполнены экспериментальные исследования с изменением температуры, продолжительности реакции и мольного соотношения реагирующих веществ.
Влияние температуры и времени реакции на выход ЧАС при проведении синтеза в среде обессоленной воды и без растворителя на примере получения хлористых солей N-моно(1-метил-2-бутенил) - N, N’-тетраметил-диаминометанхлорида и N, N’-ди(1-метил-2-бутенил) - N, N’-тетраметил-диаминометандихлорида представлено на рисунках 1 и 2.
Из рисунка 1 видно, что увеличение температуры способствует увеличению выхода продуктов реакции. Максимальный выход продуктов реакции, как в водной среде, так и без растворителя, достигается уже при 60 0С.
Из рисунка 2 видно, что реакция для монозамещения в водной среде заканчивается за 3 ч., а без применения растворителя продолжительность реакции увеличивается до 5 ч., содержание основного вещества при этом составило 94,8-98,3%.
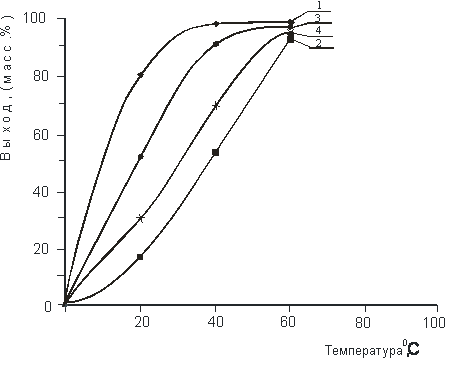 |
Рис. 1. Влияние температуры на выход хлористого N-(1-метил-2-бутенил)-N, N’-тетраметил-диаминометана и N, N’-ди(1-метил-2-бутенил) - N, N’-тетраметил-диаминометандихлорида:
1 – IX (водн. раствор, 3 ч.);
2 – IX (без растворителя, 5 ч.);
3 – X (водн. раствор, 5 ч.);
4 – X (без растворителя, 7 ч.).
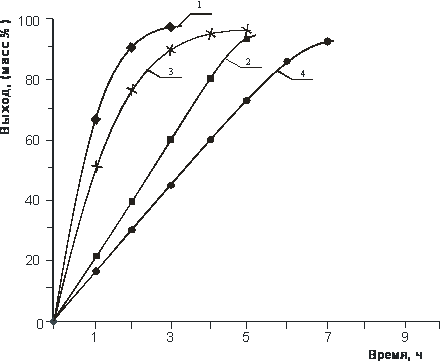 |
Рис. 2. Влияние продолжительности реакции на выход хлористого N-(1-метил-2-бутенил)-N, N’-тетраметил-диаминометана и N, N’-ди(1-метил-2-бутенил) - N, N’-тетраметил-диаминометандихло-рида (600С):
1 - IX (мольн. соотнош. 1,0 : 1,1, водный раствор);
2 - IX (мольн. соотнош. 1,0 : 1,1, без растворителя);
3 – X (мольн. соотнош. 1,0 : 2,2, водный раствор);
4 – X (мольн. соотнош. 1,0 : 2,2, без растворителя).
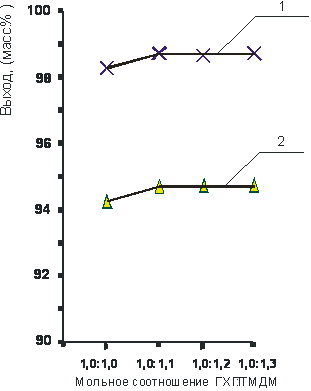 |
Рис. 3. Влияние мольного соотношения реагирующих веществ на выход хлористого N-(1-метил-2-бутенил)-N, N’-тетраметил-диаминометана (60 оС):
1 – водный раствор (3 ч.);
2 – без растворич.).
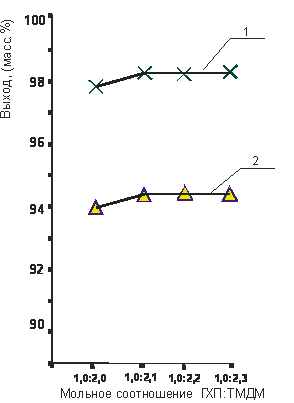 |
Рис. 4. Влияние мольного соотношения реагирующих веществ на выход N, N’-ди(1-метил-2-бутенил) -N, N’-тетраметил-диаминометандихлорида (60 оС):
1 – водный раствор (5 ч.);
2 – без растворич.).
Для дизамещения реакция в водной среде заканчивается за 5 ч., а без растворителя – за 7 ч., содержание основного вещества составило 94,3-98,1 %.
Влияние мольного соотношения реагирующих веществ на выход хлористых N, N’-моно(1-метил-2-бутенил)-N, N’-тетраметил-диаминометан-хлорида и N, N’-ди(1-метил-2-бутенил)-N, N’-тетраметил-диаминометанди-хлорида представлено на рисунках 3 и 4.
Так, из рисунков 3 и 4 видно, что оптимальное мольное соотношение ГХП : ТМДМ достигается при избытке амина и составляет 1,0 : 1,1 – для хлористых солей N, N’-моно(1-метил-2-бутенил) - N, N’-тетраметил-диаминометанхлорид и 1,0 : 2,2 – для N, N’-ди(1-метил-2-бутенил) - N, N’-тетраметил-диаминометандихлорида.
Таким образом, оптимальными условиями получения ЧАС на основе ГХП и ТМДМ в водной среде для моноалкенил-N, N’-тетраметил-диаминометанов являются: температура – 60 0С, время проведения реакции – 3 ч., мольное соотношение – 1,0 : 1,1; а для диалкенил-N, N’-тетраметил-диаминометанов: температура – 60 0С, время проведения реакции – 5 ч., мольное соотношение – 1,0 : 2,2. При проведении реакции без растворителя для моноалкенил-N, N’-тетраметил-диаминометанов: температура – 60 0С, время проведения реакции – 5 ч., мольное соотношение – 1,0 : 1,1; а для диалкенил-N, N’-тетраметил-диаминометанов: температура – 60 0С, время проведения реакции – 7 ч, мольное соотношение – 1,0 : 2,2.
В найденных условиях были получены остальные хлористые соли на основе N, N’-тетраметил-диаминометана, эпихлоргидрина и смеси гидрохлоридов изопрена.
Выход хлористых солей моно - и диалкенил-N, N’-тетраметил-диаминометана в найденных оптимальных условиях представлен в таблице 1. Анализируя данные таблицы 1, следует отметить, что использование в синтезах ЧАС в качестве растворителя обессоленной воды значительно увеличивает скорость реакции. Этот факт объясняется влиянием природы рас-
Таблица 1
Выход реагентов в оптимальных условиях на основе N,N¢-тетраметил-диаминометана
Шифр | Наименование соединения | Формула | Условия проведения синтезов | ||||
Среда | Время, ч | Температура, 0С | Мольное соотношение АХ : ТМДМ | Выход, масс. % | |||
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
IX | Хлористый N-(1-метил-2- бутенил)-N, N’-тетраметил-диаминометан |
| Водн. | 3 | 60 | 1,0 : 1,1 | 98,9 |
Без водн. | 5 | 94,8 | |||||
X | N, N’-ди (1-метил-2-бутенил) - N, N’-тетраметил-диаминометандихлорид |
| Водн. | 5 | 60 | 1,0 : 2,2 | 98,1 |
Без водн. | 7 | 94,3 | |||||
XI | Хлористый N, N’-(2-пентенил) - N, N’-тетраметил-диаминометан |
| Водн. | 3 | 60 | 1,0 : 1,1 | 98,3 |
Без водн. | 6 | 92,9 | |||||
| XII | N, N’-ди (2-пентенил) - N, N’-тетраметил-диаминометандихлорид |
| Водн. | 5 | 60 | 1,0 : 2,2 | 98,1 |
Без водн. | 7 | 92,5 | |||||
VII | Хлористый N-(2,3-эпоксипропил)-N, N’-тетраметил-диаминометан |
| Водн. | 5 | 80 | 1,0 : 1,1 | 96,5 |
Без водн. | 7 | 92,4 | |||||
VIII | N, N’-ди (2,3-эпоксипропил) - N, N’-тетраметил-диаминометандихлорид |
| Водн. | 6 | 80 | 1,0 : 2,2 | 96,2 |
Без водн. | 8 | 92,3 |
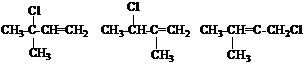
![]()
– С5Н9 - смесь гидрохлоридов изопрена, ,
творителя, которая выражается в его способности сольватировать ионы, образующиеся при диссоциации исходных реагентов. Вода и исходные реагенты образуют более устойчивые гидролизованные ионы. При этом, хлорид-ион галогенпроизводного замещается на гидрокси-группу, обладающую более высокой нуклеофильной способностью. В результате этого скорость реакции в водной среде увеличивается.
Синтез четвертичных аммонийных солей на основе этаноламинов
Для получения ЧАС на основе моно-, ди - и триэтаноламинов (ЭА) в качестве алкенилирующего агента использовали эпихлоргидрин, гидрохлорид пиперилена и смесь гидрохлоридов изопрена.
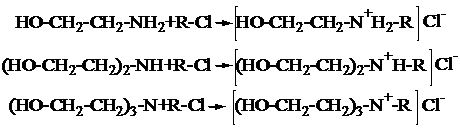 Синтез хлористых солей можно представить в виде реакций:
Синтез хлористых солей можно представить в виде реакций:
![]()
![]() где R – ; ; смесь гидрохлоридов изопрена:
где R – ; ; смесь гидрохлоридов изопрена:
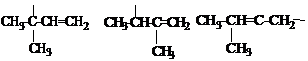 |
, , (далее обозначим –С5Н9).
Синтез ЧАС проводили при атмосферном давлении, в токе инертного газа азота, при постоянном перемешивании, в растворе обессоленной воды и без растворителя. Мольное соотношение реагирующих веществ менялось АХ : ЭА от 1,0 : 1,0 до 1,0 : 1,3, температура от 30 до 90 0С, продолжительность реакции 1-10 ч.
Влияние температуры, времени реакции и мольного соотношения реагирующих веществ на выход хлористых N-алкениламмонийных солей в водной среде и без растворителя представлены на рисунках 5-7 на примере получения N-(1-метил-2-бутенил)- моноэтаноламмонийхлорида.
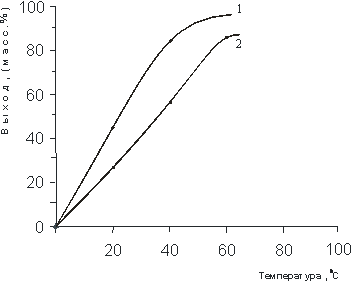
Рис. 5. Влияние температуры на выход N-(1-метил-2-бутенил)- моноэтаноламмонийхлорида (мольное соотношение 1,0 : 1,1):
1 – в водном растворе (6 ч.);
2 – без растворич.).
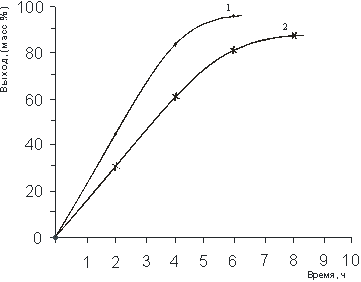
Рис. 6. Влияние продолжительности реакции на выход N-(1-метил-2-бутенил)- моноэтаноламмонийхлорида (60 0С, мольн. соотнош. 1,0 : 1,1):
1 – в водном растворе;
2 – без растворителя.
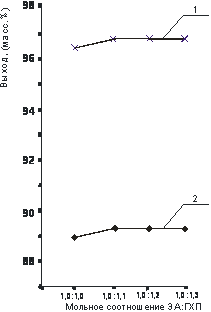 |
Рис.7. Влияние мольного соотношения хлористого N-(1-метил-2-бутенил)- моноэтаноламмонийхлорида (60 0С):
1 – в водном растворе (6 ч);
2 – без растворич).
Из рисунка 5 видно, что выход продуктов реакций в водной среде и без растворителя достигается при 60 0С.
С увеличением времени реакции происходит увеличение выхода солей. Так, из рисунка 6 видно, что реакция в водной среде заканчивается за 6 ч, содержание основного вещества при этом составило 96,9 %, а при проведении реакции без растворителя образовывалась вязкая масса коричневого цвета, при этом наибольший выход продуктов реакции достигается за 8 ч., содержание основного вещества составило 89,2 %.
Влияние мольного соотношения реагирующих веществ на выход солей представлено на рисунке 7, из которого видно, что оптимальный выход ЧАС достигается при мольном соотношении ГХП : МЭА=1,0 : 1,1.
Таким образом, условиями получения ЧАС на основе ГХП и МЭА являются: в водном растворе: температура – 60 0С, время проведения реакции – 6 ч., мольное соотношение реагирующих веществ 1,0 : 1,1. При проведении реакции без применения растворителя: температура – 60 0С, время проведения реакции – 8 ч., мольное соотношение реагирующих веществ 1,0 : 1,1.

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 |