В более отдаленные сроки (30–60 сутки) происходит волнообразное восстановление состояния электронно-транспортной цепи и системы окислительного фосфорилирования.
Разобщители максимально активируют работу электронно-транспортной цепи, что позволяет определить ее емкость в митохондриях интактных клеток. Скорость потребления кислорода после добавления разобщителей является максимально возможной при данном состоянии электронно-транспортной цепи и обеспеченности ее восстановленными продуктами.
В интактном органе 2,4-динитрофенол оказывает на эндогенное дыхание относительно слабое стимулирующее действие (таблица 1). В эксперименте A. Cittadini и др. [9] стимулирование динитрофенолом привело к 100 % росту интенсивности потребления кислорода. Незначительное повышение дыхания при действии разобщителя в проведенном эксперименте указывает на относительно небольшой запас прочности дыхательной системы. Еще более резерв ослабляется после острого воздействия ионизирующего излучения. Падение показателей действия ДНФ на 3 сутки после облучения (таблица 1) свидетельствует о полном исчерпании резервных возможностей дыхательной цепи [8]. Таким образом, относительно низкий уровень потребления кислорода ограничен возможностями самой электронно-транспортной цепи. На 10–30 сутки происходит увеличение резерва системы и уменьшение ее разобщенности. Динамика изменения VДНФ также свидетельствует о волнообразном восстановлении состояния электронно-транспортной цепи и окислительного фосфорилирования после облучения и наличии периодов острой стресс-реакции, последующей регенерации и стадии вторичного опустошения тимуса на 30–60 сутки.
Дополнительная информация может быть получена при анализе уровня дыхания интактных клеток в присутствии ингибиторов дыхательной цепи. Их использование позволяет отразить состояние NAD - и FAD-окисляемых субстратов в клетках тимуса и оценить вклад дыхательных комплексов в работу электронно-транспортной цепи. Последовательное введение амитала и малоната вызывает ингибирование вначале первого, а затем второго комплекса дыхательной цепи, что позволяет оценить вклад каждого из них в общий механизм транспорта протонов в клетках тимуса, а также роль жирных кислот в тканевой энергетике. Более высокое значение коэффициента АРД по сравнению с таковым для МРД свидетельствует о высокой активности сукцинатдегидрогеназы и преобладающем вкладе второго комплекса дыхательной цепи в системе митохондриального окисления ткани тимуса крыс. В свою очередь коэффициент МРД — показатель «остаточного» дыхания после добавления ингибиторов указывает на вклад жирных кислот в энергетику ткани. Повышенный уровень АРД над МРД (рисунок 2) указывает на превалирующую роль первого комплекса дыхательной цепи.
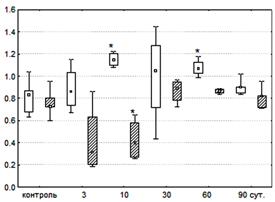
Рисунок 2 — Ингибиторный анализ состояния тканевого дыхания крысы
после облучения в дозе 0,5 Гр
Условные обозначения: ![]() — амителрезистентное дыхание;
— амителрезистентное дыхание; ![]() — малонатрезистентное дыхание;
— малонатрезистентное дыхание;
R — медиана; — границы верхнего и нижнего квартилей;
^ — минимум и максимум; * р < 0,05 по сравнению с контролем, критерий Манна-Уитни (n = 5)
После облучения эта закономерность проявляется особенно четко на 3 и 10 сутки. Затем отличия в участии обоих комплексов снижаются и становятся минимальными на 90 сутки, приближаясь к состоянию, характерному для контроля.
Заключение
Острое γ-облучение крыс в дозе 0,5 Гр вызвало резкое падение уровня эндогенного дыхания в тимусе в ближайшие сроки после облучения, сопровождающееся выраженным нарушением функционирования электронно-транспортной цепи. В отдаленные сроки после облучения происходит волнообразное восстановление уровня эндогенного дыхания, состояния дыхательной цепи и системы окислительного фосфорилирования.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Иванов, А. А. [и др.] // Медицинская радиология и радиационная безопастность. — 2001. — Т. 46, № 3. — С. 64–78.
2. Ерофеева, Л. М. // Морфология. — 2008. — Т. 133, № 2. — С. 45.
3. Грудзь, Т. И. [и др.] // Радиобиология. — 1990. — Т. 30, № 6. — С. 760–764.
4. Грицук, А. И. [и др.] // Весцi НАН Беларусi. Сер. мед.-бiял. навук. — 2002. — № 2. — С. 63–70.
5. Северин, С. Е. Практикум по биохимии / , . — М.: МГУ, 1989. — 509 с.
6. Кисурина-Евгеньева, О. П., Онищенко, Г. Е. // Цитология. — 2000. — Т. 42, № 1. — С. 42–46.
7. Гевондян, К. А. [и др.] // Докл. РАН. — 2005. — Т. 105, № 3. — С. 277–282.
8. Gnaiger, E. Mitochondrial Pathways and Respiratory Control / E. Gnaiger. — Innsbruck, 2007. — 98 р.
9. Cittadini, А. [et al.] // Molecular and Cellular Biochemistry. — 1975. — Vol. 8, № 1. —P. 49–57.
Поступила 18.02.2011
УДК 577.112.824: 541.495.2
ВЛИЯНИЕ РАЗЛИЧНЫХ КОНЦЕНТРАЦИЙ МОЧЕВИНЫ И ЗНАЧЕНИЙ РН
НА ПОКАЗАТЕЛИ ФЛУОРЕСЦЕНЦИИ БЫЧЬЕГО СЫВОРОТОЧНОГО АЛЬБУМИНА
, ,
Гомельский государственный университет имени Ф. Скорины
Гомельский государственный медицинский университет
Мочевина как химическое вещество влияет на конформацию бычьего сывороточного альбумина, вызывая частичное разворачивание его белковой глобулы с выходом на поверхность гидрофобных аминокислот. Изменение значения рН раствора, в котором находится белок, сказывается на состоянии белка. Имеется несколько конформационных состояний, в которые переходит сывороточный альбумин.
Задачей наших исследований являлось изучение влияния различных концентраций мочевины и значений рН на конформацию сывороточного альбумина. Очень чувствительными для изучения конформации белка являются методы собственной и зондовой флуоресценции. Изучая зависимость влияния различных факторов на показатели флуоресценции, можно с определенной долей вероятности предположить о конформационных переходах в белке.
Ключевые слова: бычий сывороточный альбумин, флуоресценция, флуоресцентный зонд АНС, мочевина, рН, конформация белка.
EFFECT OF DIFFERENT CONCENTRATIONS OF UREA AND PH
ON THE FLUORESCENCE PARAMETERS OF BOVINE SERUM ALBUMIN
P. A. Avdeev, V. A. Ignatenko, Yu. V. Kornoushenko, L. A. Evtuhova
Gomel State University named Skoryna
Gomel State Medical University
Urea is a chemical effect on the conformation of bovine serum albumin, causing a partial unfolding of the protein globule its exit to the surface of hydrophobic amino acids. Changing the pH of the solution in which the protein also affects the state of the protein, so there are multiple conformational states in which urea as a chemical effect on the conformation of bovine serum albumin, causing a partial unfolding of the protein globule of its exit to the surface of hydrophobic amino acids. Changing the pH of the solution in which the protein also affects the state of the protein, so there are multiple conformational states into which the serum albumin.
The objective of our research was to study the effect of different protein concentrations and pH on the conformation of serum albumin. Very sensitive method for studying protein conformation are their own methods and probe fluorescence. The dependence of the effect of various factors on the fluorescence can be with a certain degree of probability suggest conformational transitions in proteins.
Key words: bovine serum albumin, fluorescence, fluorescent probe ANS, urea, pH, the conformation of the protein.
Введение
Альбумин является одним из основных белков плазмы крови человека и животных. Одна из важнейших функций альбуминов в организме это транспортная. Эти белки участвуют в переносе жирных кислот, билирубина холестерина, гормонов, витаминов и других биологически активных веществ. Сывороточный альбумин способен связывать ионы металлов переменной валентности. Также достоверно доказано, что значительная часть кальция в сыворотке также связана с альбуминами. По-видимому, эти белки способны связывать любые гидрофобные или амфифильные молекулы небольшой молекулярной массы — не более 1000 Да [1].
Относительно недавно были описаны новые виды патологических изменений, которые могут происходить с молекулами белков: их первичная структура не нарушена, но вторичная или третичная — изменена [2]. Таким образом, некоторые патологические процессы могут сопровождаться изменением конформации молекул альбумина плазмы крови. Чаще всего это удается наблюдать в результате перегрузки молекул альбумина токсическими продуктами, которые печень и другие органы детоксикации не успевают выводить из организма. Известно, что ряд патологических состояний организма, таких как почечная недостаточность, воспалительные и опухолевые процессы характеризуется повышением концентрации в крови мочевины. [3]. Мочевина является очень активным денатурирующим агентом по отношению к белкам. Пагубному влиянию в первую очередь подвергаются именно белки крови, среди которых и сывороточные альбумины, которые непосредственно контактируют с мочевиной, находящейся в кровеносном русле. В результате взаимодействия с мочевиной нарушается нативная конформация белка, а с ней снижается эффективность выполнения его физиологических функций[2].
Основная часть
Одной из характерных особенностей альбумина является его способность к обратимым конформационным превращениям при изменении рН раствора. Известны следующие формы альбумина в зависимости от рН, при котором образуются эти изомеры (конформеры):
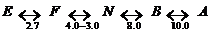
Потеря естественных свойств белков, выраженная в таком конформационном превращении белка, которое, с одной стороны, не является его рабочим состоянием, а с другой — настолько медленно, обратимо или необратимо совсем, что делает невозможным дальнейшее выполнение функции — денатурация. Денатурация, как правило, сопровождается разрывом большого числа слабых - S—S - связей. В соответствии с силами, определяющими стабильность белков как термодинамическую стабильность (свободная энергия системы равна нулю), денатурация обратима, процесс может идти медленно [3].
Одним из точных методов определения степени конформации альбумина является исследование его спектров. Тирозил — основная хромофорная группа альбумина — наполовину погружен внутрь молекулы или, пользуясь более строгим определением, находится в условиях менее полярного окружения. Гидрофобный эффект приводит к смещению максимума поглощения в красную сторону, поэтому его уменьшение или денатурация сопровождается «голубым» сдвигом[4].
На различиях в спектрах хромофоров, находящихся в разном окружении, основано применение дифференциальной спектрофотометрии. В этих случаях спектр исследуемого белка сравнивается его же спектром, но полученным в разных условиях. Например, одна из кювет спектрофотометра содержит водный раствор белка, а другая — его раствор в солях или органическом растворителе (сольвентная дифференциальная спектрофотометрия — СДС) или обе сравниваемые кюветы находятся при разной температуре (температурная дифференциальная спектрофотометрия — ТДС).
Материалы и методы
Для эксперимента приготовлены: растворы бычьего сывороточного альбумина (БСА) (Sigma-Aldrich) концентрацией 0,66 г/литр (10–5 моль/л) в трех буферных растворах со значениями рН = 4,54; 7,43; 9,08, 2 моль/л раствор ацетатного буфера (CH3COONa×3H2O — ч. д.а.) рН = 4,54, 0,15 моль/л раствор фосфатного буфера (Na2HPO4/KH2PO4 — ч. д.а.) рН = 7,43 и 0,2 моль/л раствор трис-буфера (NH2C(CH2OH)3×HCl — ч. д.а.) рН = 9,08, которые были необходимы для создания постоянного значения рН при проведении эксперимента. После приготовления растворов буферов была измерена величина рН полученных растворов буферов на рН-метре. Для проведения изучения зондовой флуоресценции белка использовался 1-анилино-8-нафталинсульфонат (АНС) в концентрации 1,3×10-3моль/л (Sigma-Aldrich). АНС готовили путем взвешивания необходимой навески и разбавления ее в этиловом спирте, так как в воде АНС не растворяется из-за наличия большого гидрофобного участка на его молекуле [48].
Мочевину растворяли в буферных растворах белка так, чтобы получить концентрацию 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 моль/л.
Измерение показателей собственной и зондовой флуоресценции проводили на спектрофлуориметре Cary Eclipse (США). Длину возбуждения для собственной флуоресценции брали равную 296 нм, при данной длине волны практически полностью всю энергию возбуждения поглощают триптофанилы белка. Показатели собственной флуоресценции детектировались на промежутке длин волн от 300 до 650 нм. Длину возбуждения для зондовой флуоресценции брали равную 340 нм, при которой поглощается связанный с белком флуоресцентный зонд АНС (1-анилино-8-нафталинсульфонат). Показатели зондовой флуоресценции детектировались на промежутке длин волн от 350 до 650 нм. Ширина щелей излучения и поглощения при измерении собственной и зондовой флуоресценции бралась по 5 нм.
Каждый эксперимент проводили по три раза. Измерения флуоресценции проводили по три раза. Графики строили по средним из трех экспериментов. Неопределенность результатов эксперимента — в пределах 5 %.
Результаты и их обсуждение
Проводили исследования влияния мочевины на интенсивность собственной флуоресценции альбумина при значениях рН = 4,54; 7,43; 9,08. Концентрация альбумина оставалась постоянной 0,66 г/л, а концентрация мочевины изменялась от 1 до 10 моль/л.
В контрольных опытах без добавления зонда АНС при трех значениях рН интенсивность собственной флуоресценции белка была выше при значении рН = 4,54, ниже — при рН = 9,08 и самая низкая — при рН = 7,43. Полученные данные показаны на рисунке 1.
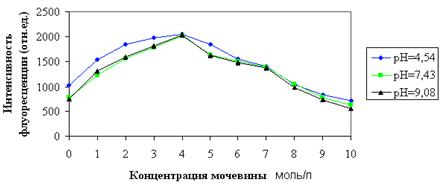
Рисунок 1 — Влияние сверхвысоких концентраций мочевины
на интенсивность собственной флуоресценции альбумина при рН = 4,54; 7,43; 9,08
В растворе альбумина при повышении концентрации мочевины наблюдали рост интенсивности флуоресценции до концентрации мочевины в 4 М/л. При данной концентрации мочевины происходит разворачивание белковой глобулы, что ведет к выходу на поверхность второго триптофанила. При достижении концентрации мочевины выше 4 М/л происходит падение интенсивности собственной флуоресценции, и чем выше концентрация мочевины, тем ниже оказываются значения собственной флуоресценции, причем эта закономерность повторяется независимо от значений рН.
Падение интенсивности собственной флуоресценции при концентрации мочевины выше 4 М/л можно объяснить несколькими возможными процессами. В литературных источниках описаны эффекты, когда при полном разворачивании белка происходило образование олигомерных форм белка. Вероятно, мочевина вызывает появление на белковой глобуле локальных мест выхода гидрофобных участков на поверхность, за счет чего молекулы альбумина могут вступать во взаимодействие, при котором образуются олигомерные комплексы белка. При этом флуоресценция обусловлена лишь триптофанилами наружных молекул, составляющих данный олигомерный комплекс.
На рисунке 2 представлены результаты изменения максимумов интенсивности зондовой флуоресценции альбумина при увеличении концентрации мочевины в растворе.
С ростом концентрации мочевины интенсивность зондовой флуоресценции снижалась независимо от значения рН в растворе. При концентрации мочевины в 9 М/л и более показатели интенсивности флуоресценции практически выровнялись, это говорит о том, что высокие концентрации мочевины вызывают одинаковые конформационные переходы альбуминов независимо от того, какая это форма альбумина — N, F или В.
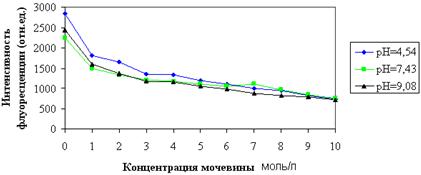
Рисунок 2 — Влияние сверхвысоких концентраций мочевины
на интенсивность зондовой флуоресценции альбумина при рН = 4,54; 7,43; 9,08
Снижение интенсивности зондовой флуоресценции можно объяснить конкуренцией между мочевиной и АНС за связывающие центры на молекуле альбумина. Это подтверждается тем, что падение интенсивности идет практически равномерно с ростом концентрации мочевины. Таким образом, применение метода зондовой флуоресценции для описания нативного белка имеет свои ограничения. Так, при большой концентрации других лигандов в растворе они могут вступать в конкуренцию за места посадки на альбумине.
При интерпретации полученных экспериментальных данных нужно учитывать, что для белков и альбумина, в том числе, характерно наличие явления микрогетерогенности структуры, то есть отличий в аминокислотной последовательности определенной части белка от среднестатистической молекулы альбумина.
Часть молекул альбумина может быть гликозилировано, что, например, наблюдается при изучении сывороточного альбумина людей, страдающих сахарным диабетом. У таких людей процентное соотношение гликозилированного альбумина по отношению к негликозилированному намного выше, чем у здоровых. Препарат альбумина может содержать примеси некоторых метаболитов, что зависит от метода очистки альбумина. Так как он является транспортным белком, то при его не слишком тщательной очистке возможно получить альбумин, содержащий активно-флуоресцирующие вещества (билирубин, желчные кислоты и др.), которые могут внести значительный вклад в интенсивность флуоресценции и тем самым привести к ошибочным результатам. Такие химические вещества в крови, как соли тяжелых металлов, оксиды, которые ковалентно связываются с определенными функциональными группами на аминокислотах или вступают в химические взаимодействия с ними, вызывая значительные пространственные перестройки в молекуле альбумина. От данных примесей часто не удается избавиться, используя даже современные методы хроматографии и диализа.
Важно учитывать возможность формирования олигомерных фракций белка, которые всегда присутствуют в препаратах сывороточного альбумина. По некоторым данным, мономерная фракция альбумина в сухом препарате в лучшем случае достигает 80–90 %, а в худшем — может быть даже ниже олигомерной. Молекула альбумина склонна к формированию таких олигомерных комплексов, когда несколько одиночных молекул альбумина соединяются вместе. Их формирование происходит благодаря как нековалентным, так и ковалентным взаимодействиям. Ковалентная связь между молекулами альбумина может возникать благодаря дисульфидным связям соседних молекул альбумина. В молекуле альбумина содержится 35 аминокислотных остатков цистеинов, при этом 34 из них образуют между собой дисульфидные связи, которые стабилизируют пространственную укладку альбумина. Один из цистеиновых остатков не имеет связи и часто благодаря остатку этой аминокислоты могут образовываться цистеиновые мостики между соседними молекулами. Под действием различных денатурирующих факторов на молекулу белка возможно разрушение нескольких дисульфидных связей из семнадцати существующих в ней. После чего к одной молекуле альбумина может присоединяться другая белковая молекула, имеющая в своем составе такую же восстановленную группу цистеина. Таким образом, воздействие мочевины может привести к формированию крупных белковых комплексов, которые включают десятки молекул альбумина.
Возможно, что каждый из представленных гипотетических процессов может иметь место в данном эксперименте. При этом при разных концентрациях мочевины значение каждого из этих факторов будет изменяться. Так, известно, что образование олигомеров белка за счет дисульфидных связей происходит только при высоких концентрациях мочевины, а при ее низких значениях олигомерные фракции белка образуются в основном за счет гидрофобных взаимодействий.
Данные олигомерные комплексы белка проявляют совершенно иные флуоресцентные свойства, чем мономерная фракция белка. Так, находящиеся внутри белкового комплекса молекулы получают меньшее количество энергии, возбуждающей флуоресценцию, из-за эффекта экранирования со стороны молекул, находящихся на поверхности белкового комплекса. Также та энергия, которая все же дошла до триптофанов молекул, находящихся внутри белкового комплекса, может теряться безизлучательно, так как внутри такого белкового комплекса высока вероятность столкновения возбужденной аминокислоты с аминокислотой, которая имеет низкий запас энергии, и таким образом, значительная часть поглощенной энергии рассеивается внутри белкового комплекса.
В результате влияния этих факторов изменение интенсивности флуоресценции альбумина не всегда может однозначно указывать на тот или иной процесс, который происходит с молекулой альбумина. Для повышения эффективности спектрофлуориметрического метода применяют метод добавления в исследуемый раствор флуоресцентного зонда. Флуоресцентные зонды — это молекулы, способные флуоресцировать, связавшись с молекулой исследуемого вещества, при этом интенсивность флуоресценции исследуемого образца увеличивается в несколько раз. Это происходит благодаря тому, что практически вся энергия, поглощенная триптофанилами, мигрирует на флуоресцентный зонд. Чем больше молекул флуоресцентного зонда связывается с молекулой, тем выше интенсивность зондовой флуоресценции и ниже флуоресценция остатков триптофана. Флуоресцентные зонды в отличие от флуоресцентных меток взаимодействуют с молекулами благодаря нековалентным взаимодействиям, поэтому их прикрепление к молекуле белка практически не сказывается на пространственной укладке белковой молекулы.
Заключение
Таким образом, экспериментально показано, что молекула сывороточного альбумина обладает очень лабильной и неустойчивой структурой. Незначительные изменения величины рН или концентрации мочевины вызывало значительные конформационные перестройки в белковой глобуле. Можно с определенной долей достоверности предположить, что возрастание концентрации мочевины в крови будет способствовать разрушению нативной конформации сывороточного альбумина, что вносить определенный вклад в протекание патологического процесса.
По снижению показателя интенсивности зондовой флуоресценции можно судить о том, что с ростом концентрации мочевины связывающая способность альбумина снижается. Таким образом и в организме может проявляться данная закономерность, из-за чего большие концентрации мочевины нарушают одну из основных — транспортную функцию альбумина.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Альбумин сыворотки крови в клинической медицине / под ред. , . — М.: ИРИУС, 1994. — 226 с.
2. Чёгер, С. И. Транспортная функция сывороточного альбумина / . — Бухарест: Изд-во Академии СРР, 1975. — 183 с.
3. Луйк, А. И. Сывороточный альбумин и биотранспорт ядов / , . — М.: Медицина, 1984. — С. 12–29.
4. Биохимия: учеб. / Под ред. . — 2-е изд., испр. — М.: ГЭОТАР-МЕД, 2004. — 784 с.
5. Мушкамбаров, Н. Н. Молекулярная биология: учеб. пособие для студ. мед. вузов / , . — М.: Медицинское информационное агентство, 2007. — 536 с.
Поступила 17.11.2010
УДК 616.98-078:579,835.12:575.22
РАЗРАБОТКА И АПРОБАЦИЯ МЕТОДИКИ ОПРЕДЕЛЕНИЯ ГЕНОТИПОВ
И АЛЛЕЛЬНЫХ ВАРИАНТОВ HELICOBACTER PYLORI
, ,
Республиканский научно-практический центр
радиационой медицины и экологии человека, г. Гомель
Гомельский государственный медицинский университет
Разработана и апробирована методика определения генотипов и аллельных вариантов Helicobacter pylori с использованием полимеразной цепной реакции (ПЦР), позволяющая определять генетическую структуру циркулирующих штаммов и их роль в развитии заболеваний желудочно-кишечного тракта (ЖКТ). Достоверных различий между группами больных с заболеваниями ЖКТ и группой больных гастритами не выявлено (p > 0,05), что свидетельствует о близкой генетической структуре H. pylori в группах пациентов с заболеваниями ЖКТ. Достоверно чаще встречается сagA-генотип при сравнении показателей контрольной группы и группы пациентов с ЯБДК (p = 0,007), что показывает значимость данного гена в развитии дуоденальных язв.
Ключевые слова: H. pylori, праймеры, ПЦР, генотип, заболевания желудочно-кишечного тракта.
PREPARATION AND APPROBATION OF HELICOBACTER PYLORI
GENIC AND ALLELIC VARIANT TESTING
A. V. Voropaeva, O. Yu. Baranov, E. V. Voropaev
Republican Research Centre for Radiation Medicine and Human Ecology, Gomel
Gomel State Medical University
Prepared and approbated method of H. pylori genotype and allelic variant testing by means of PCR (polymerase chain reaction). PCR determines the genetic structure of H. pylori circulating strains and their role in the occurrence of GIT (gastrointestinal tract) diseases. There are no significant differences between the groups of patients with GIT diseases and gastritis (p > 0,05). It testifies about the similar gene structure of H. pylori in the patients with GIT diseases. Cag-A genotype is significantly more often observed in making a comparison of control group and duodenal ulcer patients (p = 0,007). It reveals the significance of this gene in the occurrence of duodenal ulcers.
Key words: H. pylori, clarithromycin, PCR-RFLP, genotype, resistance.
Введение
Важнейшее значение, определяющее клинические исходы инфицирования человека Helicobacter pylori (H. pylori), придается в настоящее время генетической структуре микроорганизма. С этой целью во всем мире проводятся масштабные исследования, позволяющие оценить региональные особенности генотипа H. pylori, так как развитие клинически значимого заболевания зависит в значительной степени от патогенного потенциала бактерии, а не только от восприимчивости макроорганизма и экологических факторов.
В геноме бактерии H. pylori имеются гены (vacA, cagA, babA, iceA, dupA), ассоциированные с повышенной патогенностью. Примерно 50 % штаммов H. pylori выделяют активный вакуолизирующий цитотоксин VacA, тогда как ген vacA содержится почти у всех штаммов. Ген vacA имеет 2 региона: сигнальный — s (signal) и срединный – m (middle). Сигнальный s-регион гена включает два подтипа — s1 и s2. Срединный m-регион имеет также два аллельных типа — m1 или m2 [1]. VacA цитотоксин повреждает мембраны клеток эпителия и формирует в них избирательный электроннозависимый канал ионов. Бикарбонат и органические анионы покидают клетку, что позволяет бактерии получать питание, VacA проникает в мембраны митохондрий, вследствие этого высвобождается цитохром С и начинается апоптоз. VacA в эксперименте вызывает эрозии и язвы слизистой желудка. Тем не менее примерно у 30 % пациентов с язвами цитотоксин не вырабатывается и, таким образом, существенно не влияет на ульцерогенез [2].
Ген cagA (cytotoxin associated gene) имеет размер 128 kDa, кодирует белок длинной 1186 аминокислотных остатка и обязан своим именем первоначальной ассоциации с экспрессией vacA-гена. CagA-ген считается маркером группы примерно 30 генов, т. н. cag-PAI-островка патогенности. Некоторые из них кодируют 4 тип cекреторной системы, посредством которой протеин CagA может проникать в клетки эпителия [3]. Продукт cagA-гена вводится бактерией в эпителиальные клетки желудка, где затем проходит тирозинфосфорилирование. Фосфорилированный CagA специфически связывается SHP-2-фосфатазой, активирует ее деятельность и тем самым вызывает морфологические преобразования клеток. CagA-протеин обладает высокими антигенными свойствами, благодаря которым вырабатываются сывороточные IgG, IgM-антитела и местный sIgA-ответ [4, 5].
Ген babA (blood group associated binding gene) кодирует образование белка BabA, массой 75 kDa, который является посредником сцепления между Lewis b антигенами группы крови человека на клетках желудочного эпителия и H. pylori. BabA индуцирует продукцию интерлейкина IL-8, и его наличие связано с плотностью колонизации.
Ген iceA (induced by contact with epithelium) активируется при контакте с эпителиоцитами слизистой оболочки и существует в двух аллельных формах — iceA1 и iceA2. У больных, инфицированных H. pylori c генотипом iceA1, инфильтрация собственной пластинки слизистой оболочки желудка полиморфно-ядерными нейтрофилами выше, чем у инфицированных другим генотипом. Aдгезия к эпителиальным клеткам желудка in vitro индуцируется экспрессией IceA1 белка. Имеются данные, указывающие на то, что аллель iceA1 чаще встречается при язвенной болезни, iceA2 — при гастритах [8].
В последнее время активно обсуждается роль нового фактора вирулентности — гена dupA (duodenal ulcer promoting) как защитного маркера риска развития рака желудка и маркера язвенной болезни двенадцатиперстной кишки [10].
Цель
Разработать и апробировать методику, позволяющую проводить определение генотипов и аллельных вариантов H. pylori и соответственно оценить их клиническую значимость в развитии заболеваний желудочно-кишечного тракта в Республике Беларусь.
Материал и методы исследования
В исследовании использовались как известные последовательности праймеров, так и самостоятельно подобранные нами. Материалом для исследования являлись образцы биоптатов cлизистой оболочки желудка (CОЖ) пациентов c заболеваниями желудочно-кишечного тракта (n = 226) и контрольной группы (n = 24) с подтвержденной лабораторно при помощи быстрого уреазного теста и полимеразной цепной реакции (ПЦР) инфекцией H. pylori. Статистическая обработка выполнялась с использованием критерия c2 , c2 с поправкой Йетса, построения и анализа ROC-кривых с помощью пакета программы «MedCalc», 9.6.2.0. Статистически достоверными считали данные при р < 0,05.
Результаты и обсуждение
Одной из хорошо изученных микробных детерминант, связанных с высоким риском развития заболеваний желудочно-кишечного тракта, является цитотоксинассоциированный ген саgА — иммунодоминантный антиген и маркер заболеваний. Учитывая важность выявления данного гена при хеликобактерассоциированных заболеваниях желудочно-кишечного тракта, для этой цели нами изучены возможности применения различных пар праймеров, позволяющих выявлять данный ген, и отработаны условия проведения ПЦР. Данные представлены в таблице 1.

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 |




