Одна из физиологических функций печени — накопление депо железа, которое является жизненно важным элементом. Однако при высокой концентрации в гепатоцитах железо оказывает токсическое действие, что особенно актуально для уже пораженного органа, в том числе при хроническом гепатите, поскольку это может способствовать прогрессированию патологического процесса, т. е. фиброзу печени [3].
Таким образом, можно предполагать, что гиперферритинемия как признак избытка железа в организме может быть прогностическим фактором, определяющим более высокий уровень фиброза печени у пациентов с хроническими гепатитами.

Оценка выраженности фиброза печени — достаточно непростая задача, стоящая перед врачом. Золотым стандартом в диагностике фиброза остается пункционная биопсия. Однако биопсия печени имеет существенные ограничения. Так, одной из объективных причин таких ограничений является нерепрезентативность биоптата, представляющего собой 1/часть ткани органа. Также на результат исследования влияет квалификация врача-морфолога. Кроме того, больные зачастую неохотно соглашаются на пункционную биопсию. Поэтому весьма актуальными остаются методы неинвазивной оценки степени фиброза [4, 5].
Из всех методов, использующих показатели биохимического анализа крови, наиболее простым тестом для диагностики фиброза печени является индекс Ритиса (соотношение концентраций АСТ и АЛТ в крови). Однако этот тест не обладает высокой чувствительностью и предсказательной ценностью. Поэтому более целесообразно использовать другие, более сложные методики, специально разработанные для оценки фиброза. К таковым относятся тесты APRI, Forns и FIB-4.
Цель
Провести сравнительную оценку выраженности фиброза печени у больных хроническими гепатитами неинвазивными методами в зависимости от уровня ферритина.
Материалы и методы исследования
Проведено комплексное клиническое обследованиемужчин и 22 женщины) пациента с хроническими гепатитами различной этиологии, наблюдавшихся в ГУ «Республиканский научно-практический центр радиационной медицины и экологии человека».
Лабораторное обследование пациентов включало общий клинический анализ крови (уровень гемоглобина, количество эритроцитов и тромбоцитов), а также определение уровней сывороточных трансаминаз (АСТ и АЛТ), гаммаглютамилтранспептидазы (ГГТП), общего холестерина. Кроме того, определялись показатели метаболизма железа: концентрации общего железа сыворотки крови, ферритина, трансферрина, общая железосвязывающая способность сыворотки крови, рассчитывался индекс насыщения трансферрина.
Всем пациентам проводилась неинвазивная оценка фиброза печени с помощью тестов APRI, Forns и FIB-4.
Тест APRI, впервые описанный в 2003 г., наиболее прост и использует только два показателя — уровень АСТ и количество тромбоцитов.
Формула расчета: APRI = АСТ × 100 / ((верхний предел АСТ) × тромбоциты (109/л).
Оценка теста: если полученное значение больше 1,0, то вероятность значительного фиброза велика, если меньше 0,5, то мала [6].
Индекс FIB-4 был разработан американскими учеными из Вирджинского университета на основе обследования 832 пациентов с коинфекцией вируса иммунодефицита человека и гепатита С. Для расчета индекса используются параметры: возраст, АСТ, АЛТ, тромбоциты.
Формула расчета: FIB-4 = возраст (лет) × АСТ / (тромбоциты (109/л) × √(АЛТ)).
Оценка теста: вероятность значительного фиброза печени мала (порядка 90 %), если значение меньше 1,45, и велика, если значение больше 3,25 [7].
Тест Forns разработан Xavier Forns с соавт. на основе обследования 476 пациентов с хроническим гепатитом С, которым проводилась биопсия печени. В формуле расчета используются параметры: холестерин, тромбоциты, возраст, ГГТП.
Формула расчета: Forns = 7,811 – 3,131 × ln (тромбоциты) + 0,781 × ln (ГГТП) + 3,467 × ln (возраст) – 0,014 × (холестерин, мг/дл).
Оценка теста: значение меньше 4,2 соответствует отсутствию фиброза больше 1 степени с вероятностью 96 % [8].
Полученные результаты обрабатывались с помощью программ «Microsoft Excel», «Statistica», 6.0. Cравнение данных в независимых группах проводилось с помощью критерия Манна-Уитни, долей — точного критерия Фишера.
Результаты и их обсуждение
По результатам лабораторного обследования все пациенты были разделены на 2 группы: 1 группу составили,5 %) больных с гиперферритинемией (уровень сывороточного ферритина более 250 мкг/л). Во 2 группу вошло,5 %) пациентов с нормальным уровнем сывороточного ферритина.
Средний возраст больных в обеих группах статистически значимо не различался (1-я группа — 45,8 ± 3,1 года, 2 группа — 50,4 ± 2,2 года, р = 0,068).
Далее была проведена оценка основных показателей биохимического анализа крови в обеих группах. Полученные в результате данные представлены в таблице 1.
Таблица 1 — Показатели биохимического анализа крови пациентов
Показатель | 1 группа (n = 13) | 2 группа (n = 38) | р |
Сывороточное железо, мкмоль/л | 24,3 ± 2,8 | 20,8 ± 1,5 | 0,15 |
Ферритин, мкг/л | 451,7 ± 23,6 | 105,9 ± 11,7 | < 0,00001 |
ОЖСС, мкмоль/л | 74,9 ± 3,2 | 79± 2,3 | 0,25 |
Трансферрин, г/л | 2,74 ± 0,16 | 2,89 ± 0,1 | 0,19 |
% насыщения трансферрина | 34,4 ± 5,1 | 27,5 ± 2 | 0,225 |
АЛТ, Ед/л | 107 ± 26,8 | 42,2 ± 5,7 | 0,002 |
АСТ, Ед/л | 115,2 ± 28,7 | 33,1 ± 3,89 | 0,003 |
ГГТП, Ед/л | 379 ± 99 | 64,2 ± 9,8 | 0,0001 |
Холестерин, ммоль/л | 5,3 ± 0,32 | 5,2 ± 0,2 | 0,39 |
Анализируя данные, приведенные в таблице 1, следует отметить, что у пациентов 1 группы заметна отчетливая тенденция к более высоким показателям, отражающим запас железа в организме (сывороточное железо, % насыщения трансферрина). Также у больных данной группы были достоверно выше показатели, отражающие выраженность синдромов цитолиза (АЛТ, АСТ) и холестаза (ГГТП). Таким образом, гиперферритинемия, по-видимому, может являться не только отражением высокого содержания железа в организме, но и большей активности воспалительного процесса в печени.
По приведенным выше формулам у пациентов обеих групп были рассчитаны средние значения индексов неинвазивной оценки фиброза. Результаты представлены в таблице 2.
Таблица 2 — Значения индексов фиброза у пациентов
Индексы | 1 группа | 2 группа | р |
APRI | 1,68 ± 0,45 | 0,47 ± 0,08 | 0,0003 |
Forns | 5,7 ± 0,42 | 4,8 ± 0,27 | 0,042 |
FIB-4 | 2,52 ± 0,44 | 1,31 ± 0,12 | 0,0054 |
Данные, представленные в таблице 2, свидетельствуют о том, что у пациентов с гиперферритинемией показатели неинвазивной оценки фиброза были достоверно выше, чем у больных с нормальным уровнем ферритина.
Далее была проведена оценка частоты вероятности значительного фиброза печени у пациентов обеих групп в соответствии с приведенными критериями (рисунки 1 и 2).
Как видно на рисунке 1, у пациентов 1 группы частота показателя индекса APRI более 1,0 (высокая вероятность значительного фиброза) была значительно выше, чем во 2 группе (р = 0,0014). У большинства больных 2 группы индекс был менее 0,5 (низкая вероятность значительного фиброза), различие также статистически значимо (р = 0,001).
При сравнении частот вероятности значительного фиброза по индексу FIB-4 были получены похожие результаты. Значение индекса более 3,25 (вероятность значительного фиброза печени высока) намного чаще выявлялось у больных 1 группы (р = 0,0031), и напротив, значение индекса менее 1,45 (вероятность значительного фиброза печени мала) достоверно чаще (р = 0,015) обнаруживалось у пациентов 2 группы (рисунок 2).
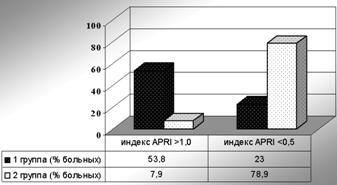
Рисунок 1 — Частота вероятности значительного фиброза по индексу APRI
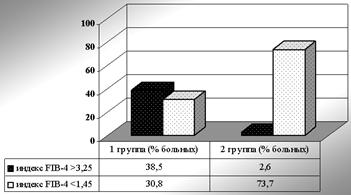
Рисунок 2 — Частота вероятности значительного фиброза по индексу FIB-4
При сравнении частот значимых индексов Forns у пациентов обеих групп было выявлено следующее. Низкая вероятность фиброза более 1 степени (с вероятностью 96 %) по индексу Forns встречалась у больных 1 группы значительно реже, чем у пациентов 2 группы (15,4 и 36,8 % соответственно), хотя статистической значимости различий установлено не было (р = 0,15).
Заключение
Результаты показателей индексов неинвазивной оценки фиброза свидетельствуют о том, что для больных хроническими гепатитами с гиперферритинемией характерна большая выраженность фибротических процессов в печени по сравнению с теми пациентами, у которых уровень ферритина в пределах нормы. Возможно, гиперферритинемия у данных пациентов является следствием повышенного содержания железа в организме, что также косвенно подтверждается более высокими значениями сывороточного железа и индекса насыщения трансферрина. Также у этих пациентов были достоверно более высокими маркеры синдрома цитолиза, т. е. имела место большая выраженность воспалительного процесса в печени, что, несомненно, способствует прогрессированию фиброза печени. Кроме того, следует отметить, что, не смотря на отсутствие статистической достоверности, у больных 1 группы средний возраст был несколько ниже. Это может быть признаком того, что у пациентов данной группы хронические гепатиты имели более выраженные клинические проявления и прогрессировали быстрее, что явилось причиной более ранней их диагностики.
Таким образом, можно предполагать, что наличие гиперферритинемии у больного хроническим гепатитом является неблагоприятным прогностическим признаком, свидетельствующим о более быстром прогрессировании заболеваний печени.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Факторы прогрессирования хронических гепатитов и циррозов печени/ [и др.] // Экспериментальная и клиническая гастроэнтерология. — 2008. — № 6. — С. 101–106.
2. Диагностическое значение комплексного исследования показателей метаболизма железа в клинической практике/ [и др.] // Гематология и трансфузиология. — 2005. — Т. 50, № 5. — С. 23–28.
3. Богуш, Л. С. Алгоритм диагностики нарушений обмена железа у больных хроническими диффузными заболеваниями печени / // Проблемы здоровья и экологии. — 2008. — № 3. — С. 142–148.
4. Исаков, В. А. Как определять выраженность фиброза печени и зачем? / // Клин. гастроэнтерол. гепатол. Русское издание. — 2008. — Т. 1, № 2. — C. 72–75.
5. Диагностические возможности методов неинвазивной оценки фиброза при диффузных заболеваниях печени / [и др.] // Рос. журн. гастроэнтерол. гепатол. колопроктол. — 2009. — № 4. — С. 48–54.
6. A Simple Noninvasive Index Can Predict Both Significant Fibrosis and Cirrhosis in Patients With Chronic Hepatitis C / C. T. Wai [et al.] // Hepatology. — 2003. — Vol. 38. — P.518–526.
7. Development of a simple noninvasive index to predict significant fibrosis in patients with HIV/HCV coinfection / R. K. Sterling [et al.] // Hepatology. — 2006. — Vol. 43. — P. 1317–1325.
8. Identification of chronic hepatitis C patients without hepatic fibrosis by a simple predictive model / X. Forns [et al.] // Hepatology. — 2002. — Vol. 36. — P. 996–989.
Поступила 18.10.2010
УДК 616.36-002.2-08:578.245
ЭФФЕКТИВНОСТЬ РАЗЛИЧНЫХ СХЕМ ТЕРАПИИ ПРЕПАРАТАМИ ИНТЕРФЕРОНОВ
У ПАЦИЕНТОВ С ХРОНИЧЕСКИМ ГЕПАТИТОМ С
, ,
Гомельский государственный медицинский университет
Проведено сравнение эффективности разных схем применения препаратов интерферонов при терапии ХГС с различными генотипами вируса. При лечении хронического гепатита С необходимо ориентироваться не только на клиническую, но и фармакоэкономическую эффективность терапии. С помощью анализа «затраты/эффективность» установлено, что наилучшим соотношением «цена/качество» обладает схема с использованием монотерапии ИФН с высокодозным началом.
Ключевые слова: хронический вирусный гепатит С, интерфероны, фармакоэкономическая эффективность.
EFFICIENCY OF VARIOUS SCHEMES OF INTERFERON THERAPY
IN PATIENTS WITH CHRONIC HEPATITIS С
E. L. Krasavtsev, V. M. Mitsura, A. P. Demchilo
Gomel State Medical University
Comparison of different schemes of interferon therapy efficiency is studied in patients with chronic hepatitis C with various viral genotypes. On treatment of chronic hepatitis C it is necessary to be guided not only on clinical, but also pharmaco-economic efficiency of means of «cost-effectiveness» analysis it is established that the best price/quality ratio has the scheme with use of interferon monotherapy with high-doses beginning.
Key words: chronic hepatitis С, interferons, pharmaco-economics.
Введение
В последнее десятилетие прошлого века было доказано влияние противовирусной терапии на снижение частоты хронизации острого гепатита С и уменьшение скорости прогрессирования фиброза печени при хроническом гепатите С (ХГС), а также частоты декомпенсации цирроза печени и развития его осложнений, формирования гепатоцеллюлярной карциномы. В течение последних 20 лет в лечении ХГС специалистами всех стран отдается предпочтение назначению интерферона (ИНФ), так как его использование способствует подавлению вирусной репликации, снижает активность инфекционного процесса и тем самым препятствует прогрессированию заболевания [2, 4]. Однако несмотря на накопленный опыт в лечении ХГС, окончательно не найдены оптимальные режимы дозирования и длительности лечения [3, 6, 9, 11, 12]. Обобщая данные многочисленных публикаций отечественных и зарубежных авторов, можно сказать, что в последнее время наметилась тенденция к увеличению доз ИФН и удлинению сроков терапии до 12–24 месяцев [7, 10]. В конце ХХ в. комбинированная терапия ИФНα в стандартном режиме в сочетании с рибавирином в 3 раза повысила эффективность лечения ХГС [14]. Комбинированная терапии ИФН с рибавирином в настоящее время является мировым стандартом в лечении HCV-инфекции. Как новый стандарт терапии констатируются преимущества комбинированной терапии ПегИФН с рибавирином [1].
Клиническая ценность каждого лекарственного препарата определяется его эффективностью, переносимостью и безопасностью. В связи с появлением на фармацевтическом рынке большого количества препаратов у медицинских работников появилась возможность выбора оптимальной терапии с точки зрения фармакоэкономики [5]. Внедрение такой методологии позволяет, по оценкам экспертов, снизить себестоимость медицинских услуг ориентировочно на 10–20 % за счет оптимизации лечебного процесса, сокращения сроков терапии, применения наиболее эффективных средств [8]. Приемлемое соотношение стоимости и эффективности и (или) стоимости и полезности в некоторых странах стало необходимым условием включения лекарственных средств в лекарственные формуляры, дотируемые государством [5].
Материал и методы
Проведено сравнение эффективности разных схем применения препаратов интерферонов при лечении ХГС (по 3 млн МЕ 3 раза в неделю — 1 группа и при использовании высоких начальных доз — 6 млн МЕ 3 раза в неделю в течение 3 месяцев и затем по 3 млн МЕ 3 раза в неделю — 2 группа). В 3 группу вошли больные, получвшие комбинированную терапию препаратов интерферона с рибавирином или его аналогами. Больные с 1 b генотипом HCV и с неизвестным генотипом получали лечение в течение года, с другими генотипами HCV — в течение 6 месяцев. Среди пациентов с ХГС с 1b генотипом HCV в 1 группе было 14 больных (средний возраст 26,9 ± 4,4 года, мужчин было 57,1 %, женщин — 42,9 %), во 2 — 16 пациентов (средний возраст 37,75 ± 3,07 года, мужчин было 81,25 %, женщин — 18,75 %, в 3 — 18 (средний возраст 30,0 ± 3,3 года, мужчин было 94,4 %, женщин — 5,6 %). Отличие в возрасте в 1 группе (р < 0,05) по сравнению со 2 предполагало более высокую эффективность терапии в этой группе. Такое же значение имело большее количество женщин в 1 группе.
Среди пациентов с ХГС с другими генотипами HCV в 1 группе было 11 больных (средний возраст 30,6 ± 4,6 года, мужчин было 45,5 %, женщин — 55,5 %), во 2 — 20 пациентов (средний возраст 31,1 ± 1,4 года, мужчин было 55,0 %, женщин — 45,0 %), в 3 — 11 (средний возраст 28,1 ± 2,5 года, мужчин было 64,4 %, женщин — 35,6 %). Группы по полу и возрасту статистически не различались.
Оценка вирусологического ответа после окончания терапии препаратами интерферонов через 6 и более месяцев проводилась всем пациентам. Диагноз был подтвержден у всех больных обнаружением РНК НСV до начала проведения противовирусной терапии.
Нами также проведен анализ «затраты-эффективность» для оценки фармакоэкономической эффективности примененных схем лечения ХГС [5].
Результаты и обсуждение
Так как неблагоприятным прогностическим фактором, влияющим на результат противовирусной терапии, является 1b генотип HCV [1,2,4,11], нами проведено сравнение эффективности различных схем интерферонотерапии у больных ХГС с 1b генотипом и другими генотипами HCV раздельно (таблицы 1 и 2).
При анализе результатов лечения на сроке 3 месяца в 1 группе ранний вирусологический ответ наблюдался у 2 (18,2 %) из 11 пациентов, которым удалось провести определение РНК HCV в эти сроки. Ранний биохимический ответ отмечался в этой группе у 6 (66,7 %) из 9 больных. Во 2 группе ранний вирусологический ответ был зарегистрирован у,5 %) из 16 пациентов, которым проводилось вирусологическое исследование в эти сроки, а ранний биохимический ответ — у 3 (30,0 %) из 10 больных. В 3 группе ранний вирусологический ответ наблюдался у,5 %) больных из 18, которым в эти сроки проводилось это исследование, а биохимический ответ — у 9 (69,2 %) из 13. Таким образом, ранний вирусологический ответ статистически значимо чаще достигался во 2 группе, чем в 1 (р = 0,0033, точный критерий Фишера) и в 3 (р = 0,0463, точный критерий Фишера). Также статистически значимыми были отличия и между 3 и 1 группами больных по достижению раннего вирусологического ответа (р = 0,0005, точный критерий Фишера).
При анализе результатов лечения в 1 группе первичный вирусологический ответ (к окончанию терапии) определялся у 1 (12,5 %) из 7 пациентов, биохимический — у 3 (33,3 %) из 9. Во 2 группе первичный вирусологический ответ был зарегистрирован у,3 %) из 15 больных, которым проводилось определение РНК HCV в эти сроки, а первичный биохимический ответ регистрировался у 6 (60,0 %) больных из 10. Первичный вирусологический ответ наблюдался в 3 группе у 5 (27,8 %) больных из 13, которым в эти сроки проводилось это исследование, а биохимический ответ — у 9 (69,2 %) из 13, которым проводилось это исследование. Причем первичный вирусологический ответ статистически значимо чаще также достигался во 2 группе, чем в 1 (р = 0,0084, точный критерий Фишера) и в 3 (р = 0,0113, точный критерий Фишера).
Таблица 1 — Эффективность интерферонотерапии больных ХГС с 1b генотипом HCV при различных схемах лечения
Ответ на интерферонотерапию | Группа больных | |||
1, n = 14 | 2, n = 16 | 3, n = 18 | ||
Ранний | ВО, % | 18,2 ± 12,2 n = 11 | 87,5 ± 8,5* ** n = 16 | 55,6 ± 12,1* n = 18 |
БО, % | 66,7 ± 16,7 n = 9 | 30,0 ± 15,3 n = 10 | 69,2 ± 13,3 n = 13 | |
Первичный | ВО, % | 12,5 ± 12,5 n = 8 | 73,3 ± 11,8* ** n = 15 | 27,8 ± 10,9 n = 18 |
БО, % | 33,3 ± 16,7 n = 9 | 60,0 ± 16,3 n = 10 | 69,2 ± 13,3 n = 13 | |
Устойчивый или длительный | ВО, % | 0 n = 14 | 18,75 ± 10,1 n = 16 | 22,2 ± 10,1 n = 18 |
БО, % | 28,6 ± 7,8 n = 7 | 12,5 ± 12,5 n = 8 | 25,0 ± 25,0 n = 4 |
* Различия статистически значимы (р < 0,05, точный критерий Фишера) при сравнении с 1 группой, ** различия статистически значимы (р< 0,05, точный критерий Фишера) при сравнении с 3 группой.
Устойчивый или длительный вирусологический ответ (через 6 месяцев и более после окончания терапии) в 1 группе не наблюдался ни у одного больного из 14, причем у 4 пациентов с вирусологическим ответом на фоне лечения после завершения курса интерферонотерапии вновь выявлялась РНК HCV. Биохимический ответ в эти сроки был зарегистрирован в этой группе только у 2 (28,6 %) из 7 пациентoв. Во 2 группе устойчивый или длительный вирусологический ответ определялся у 3 (18,75 %) из 16 больных. Также как и в 1 группе не было соответствия вирусологического обследования на фоне лечения и после его завершения. Так, устойчивый или длительный вирусологический ответ был у 2 больных, у которых РНК HCV выявлялась на фоне лечения, и, наоборот, у 3 пациентов, у которых не было РНК HCV на фоне лечения, после завершения курса она определялась. Биохимический ответ в эти сроки был у 1 (12,5 %) из 7 пациентов. Устойчивый или длительный вирусологический ответ прослеживался у 18 пациентов 3 группы. У 4 (22,2 %) был вирусологический ответ и еще у 14 РНК HCV продолжала определяться. Биохимический ответ в эти сроки был у 1 (25,0 %) пациента из 4, которые сдавали биохимический анализ в эти сроки, другие пациенты проводили только вирусологические исследования.
Эффективность интерферонотерапии больных ХГС с другими генотипами HCV ХГС при различных схемах лечения представлена в таблице 2.
Таблица 2 — Эффективность интерферонотерапии больных ХГС с другими генотипами HCV при различных схемах лечения
Ответ на интерферонотерапию | Группа больных | |||
1, n = 11 | 2, n = 20 | 3, n = 17 | ||
Ранний | ВО, % | 60 ± 16,3 n = 10 | 95,0 ± 5* n = 20 | 84,6 ± 10,4 n = 13 |
БО, % | 80 ± 20 n = 5 | 75,0 ± 16,4 n = 8 | 100 n = 10 | |
Первичный | ВО, % | 50 ± 22,4 n = 6 | 85,0 ± 8,2 n = 20 | 85,7 ± 9,7 n = 14 |
БО, % | 100 n = 4 | 88,9 ± 11,1 n = 9 | 80 ± 13,3 n = 10 | |
Устойчивый или длительный | ВО, % | 36,4 ± 15,2 n = 11 | 50 ± 12,9 n = 16 | 58,8 ± 12,3 n = 17 |
БО, % | 50 ± 50 n = 2 | 50 ± 50 n = 2 | 80 ± 20 n = 5 |
* Различия статистически значимы (р < 0,05, точный критерий Фишера) при сравнении с 1 группой.
При анализе результатов лечения на сроке 3 месяца в 1 группе ранний вирусологический ответ наблюдался у 6 (60 %) из 10 пациентов, которым удалось провести определение РНК HCV в эти сроки. Ранний биохимический ответ отмечался в этой группе у 4 (80 %) из 5 больных. Во 2 группе ранний вирусологический ответ был зарегистрирован у%) из 20 пациентов, которым проводилось вирусологическое исследование в эти сроки, а ранний биохимический ответ — у 6 (75 %) из 8 больных. В 3 группе ранний вирусологический ответ наблюдался у,6 %) из 13 больных, которым в эти сроки проводилось это исследование, а биохимический ответ — у 8 (80 %) из 10. Таким образом, ранний вирусологический ответ статистически значимо чаще достигался во 2 группе, чем в 1 (р = 0,0312, точный критерий Фишера).
При анализе результатов лечения в 1 группе первичный вирусологический ответ определялся у 3 (50 %) из 6 пациентов, биохимический — у 4 (100 %) из 4. Во 2 группе первичный вирусологический ответ был зарегистрирован у%) из 20 больных, которым проводилось определение РНК HCV в эти сроки, а первичный биохимический ответ регистрировался у 8 (88,9 %) из 9 больных. Первичный вирусологический ответ наблюдался в 3 группе у,7 %) из 14 больных, которым в эти сроки проводилось это исследование, а биохимический ответ — у 8 (80 %) из 10, которым проводилось это исследование.
Устойчивый или длительный вирусологический ответ в 1 группе наблюдался у 4 (36,4 %) из 11 больных. Биохимический ответ в эти сроки был зарегистрирован в этой группе только у 1 из 2 пациентoв, которые сдавали биохимический анализ в эти сроки, другие пациенты проводили только вирусологические исследования. Во 2 группе устойчивый или длительный вирусологический ответ определялся у 8 (50 %) из 16 больных. Биохимический ответ в эти сроки был зарегистрирован в этой группе только у 1 из 2 пациентoв, которые сдавали биохимический анализ в эти сроки, другие пациенты проводили только вирусологические исследования. Устойчивый или длительный вирусологический ответ прослеживался у 17 пациентов 3 группы. У,8 %) был вирусологический ответ, еще у 7 — РНК HCV продолжала определяться. Биохимический ответ в эти сроки был у 4 (80 %) из 5 пациентов, которые сдавали биохимический анализ в эти сроки, другие пациенты проводили только вирусологические исследования.
Также, как и у больных с 1b генотипом HCV, не было соответствия вирусологического обследования на фоне лечения и после его завершения.
Для анализа «затраты/эффективность» нами были приняты следующие предпосылки. Затраты, предшествующие лечению (обследование, включающее биопсию печени, выявление РНК HCV методом ПЦР, биохимический анализ крови), считались одинаковыми для всех исследованных нами схем терапии. Длительность терапии составила 12 месяцев при 1b генотипе HCV и не менее 6 месяцев при других генотипах вируса. Критерием эффективности лечения принято определение устойчивого вирусологического ответа (УВО, оценивается спустя 6 месяцев после окончания курса терапии) [2, 3, 4, 9].
Нами сравнивались 5 схем противовирусной терапии ХГС.
Схема 1. 1b генотип HCV. Монотерапия препаратами α-ИФН в стандартной дозе — 3 млн МЕ препарата 3 раза в неделю в течение 12 месяцев. Курсовая доза = 432 млн МЕ. Показанная нами эффективность такой схемы (достижение УВО) — 0 %. Таким образом, ни в одном случае ремиссия не была достигнута. Понесенные затраты были нецелесообразны.
Другие генотипы HCV. Монотерапия препаратами α-ИФН в стандартной дозе — 3 млн МЕ препарата 3 раза в неделю в течение 6 месяцев. Курсовая доза = 216 млн МЕ. Показанная нами эффективность такой схемы (достижение УВО) — 36,4 %. Чаще всего из препаратов α-ИФН нами применялся реальдирон. Стоимость 1 ампулы (3 млн МЕ) препарата «Реальдирон» в аптечной сети РБ — $19 (2005 г.); на курс лечения — $19×72 инъекции = $1370. Чтобы оценить стоимость достижения 1 ремиссии, необходимо затраты разделить на эффективность (в долях от единицы). Соотношение «затраты/эффективность» = 1370/0,364 = $3764.
Схема 2. 1b генотип HCV. Монотерапия препаратами пегилированного интерферона (Пегинтрон, США). Препарат вводится 1 раз в неделю, курс — 12 месяцев (48 недель). Стоимость одной дозы препарата составляет $г.), курсовая доза — $16800. Максимальная терапевтическая эффективность — 38 %. Побочные эффекты терапии несколько более выражены по сравнению с терапией «обычным» α-ИФН [13]. Соотношение «затраты/эффектив-ность» = 16800/0,38 = $44210
Другие генотипы HCV. Монотерапия препаратами пегилированного интерферона (Пегинтрон, США). Препарат вводится 1 раз в неделю, курс — 6 месяцев (24 недели). Стоимость одной дозы препарата составляет $г.), курсовая доза — $8400. Максимальная терапевтическая эффективность — 68 %. Побочные эффекты терапии несколько более выражены по сравнению с терапией «обычным» α-ИФН [13]. Соотношение «затраты/эффективность» = 8400/0,68 = $12353.
Схема 3. 1b генотип HCV. Монотерапия с высокодозным началом (ВДН). Терапия проводится препаратами α-ИФН, первые 3 месяца по 3 млн МЕ 6 раз в неделю, затем до 12 месяцев — 3 млн МЕ препарата 3 раза в неделю. Курсовая доза = 540 млн МЕ. Показанная нами эффективность такой схемы (УВО) — 18,75 %. Чаще всего из препаратов α-ИФН нами использовался реальдирон. Стоимость 1 ампулы (3 млн МЕ) – $19; на курс лечения — $19×180 инъекций = $3420. Соотношение «затраты/эффектив-ность» = 3420/0,1875 = $18240
Другие генотипы HCV. Монотерапия с высокодозным началом (ВДН). Терапия проводится препаратами α-ИФН, первые 3 месяца по 3 млн МЕ 6 раз в неделю, затем до 12 месяцев — 3 млн МЕ препарата 3 раза в неделю. Курсовая доза = 270 млн МЕ. Показанная нами эффективность такой схемы (УВО) — 50,0 %. Чаще всего из препаратов α-ИФН нами использовался реальдирон. Стоимость 1 ампулы (3 млн МЕ) — $19; на курс лечения — $19×90 инъекций = $1710. Соотношение «затраты/эффек-тивность» = 1710/0,5 = $3420.
Схема 4. 1b генотип HCV. Комбинированная терапия (КТ) препаратами α-ИФН (реальдирон) и рибавирина. Курсовая доза α-ИФН составляет 432 млн. МЕ, стоимость курсовой дозы реальдирона (см. п. 1) — $2740. Наиболее доступным препаратом рибавирина является рибамидил (Россия). Суточная доза (средняя) — 1000 мг (5 таблеток) ежедневно. Стоимость одной упаковки препарата (20 таб.) — $39 (2005 г.), на курс терапии (12 месяцев) — $39 × 90 упаковок = $3510. Стоимость комбинированной терапии = 2740 + 3510 = $6250. Терапевтическая эффективность схемы — 22,2 %. Соотношение «затраты/эффективность» = 6250/0,222 = $28153.

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 |




