Диагностика когнитивных нарушений не основывается только на субъективных симптомах; необходимо использовать специальные нейропсихологические тесты, которые, по данным литературы, необходимо применять как до операции, так и после неё [98].
В настоящее время рекомендованы к применению следующие тесты: [67]
1. The Rey Auditory Verbal Learning Test (тест на запоминание слов);
2. The Trail Making Test, Parts A and B (тест на способность выполнять сложные (комбинированные) задания);
3. The Grooved Pegboard Test (тест на ловкость движений);
4. The Digit Span Test (тест на способность упорядочить числа);
5. The Stroop Test (тест с применением эффекта Струпа);
6. The Paper and Pencil Memory Test (тест на сенсоримоторную реакцию);
7. Erzigkeit’s Short Cognitive Performance Test (SKT) (короткий тест, включающий в себя девять подтестов; может быть выполнен в течение 15 минут, что очень удобно для предоперационного использования) и др. [69].
Также в литературе указывается на возможность использования видеоигр (симулятор вождения) для постоперационного тестирования. [62]
Наиболее популярный тест в клинической практике в настоящий момент - The Mini-Mental Status Examination (MMSE). Он содержит вопросы, помогающие охарактеризовать временную и пространственную ориентацию пациента, а также задания, оценивающие запоминание, внимание, корректность мышления, а также способность понимать текст, писать и рисовать. Данный тест занимает пять минут [69].
Глава 2. Материалы и методы исследования
2.1. Материалы исследования
Работа была проведена на базе Центра кардиохирургии и интервенционной кардиологии ФГБУ «Санкт-Петербургский многопрофильный центр» Минздрава РФ в период с 2016 по 2017 гг.. Вид исследования – ретроспективный.
Проанализировано 239 историй болезни пациентов, поступивших на оперативное лечение с целью хирургической реваскуляризациии миокарда, коррекции патологии аорты и клапанного аппарата сердца.
Среди факторов риска дооперационного периода, способных оказывать негативное влияние как на течение заболевания, так и исходы оперативного вмешательства, рассмотрены артериальная гипертензия, атеросклероз брахиоцефальных сосудов, сахарный диабет, постинфарктрый кардиосклероз (ПИКС), наличие или отсутствие фибрилляции предсердий, фракция выброса левого желудочка, хроническая цереброваскулярная недостаточность. Учитывались также курение и злоупотребление алкоголем. Из факторов риска периоперационного периода анализировались время (длительность) искусственного кровообращения у больного, время окклюзии аорты, объем кровопотери во время операции.
2.2. Методы исследования
При анализе учитывались данные жалоб, анамнеза заболевания, клинико-неврологического и соматического обследования больных. При этом использовались лабораторные и инструментальные методы исследования (клинический анализ крови, биохимические исследования, гемостаз, липидный спектр; УЗДГ БЦА, ЭхоКГ, холтеровское мониторирование, МСКТ);
Статистическая обработка проводилась с помощью методов системного анализа. Для статистической обработки полученных данных использовали пакет прикладных программ для статистического анализа STATISTICA 10.
Исследуемые выборки были предварительно проверены на подчинение закону нормального распределения с использованием критерия Колмогорова-Смирнова.
Для оценки межгрупповых различий изучаемых показателей применяли параметрический критерий Стьюдента.
Статистический анализ качественных показателей проводился на основе данных, сгруппированных в таблицы сопряженности, с применением критерия Манна-Уитни.
Критический уровень значимости (р) нулевой статистической гипотезы (об отсутствии значимых различий) принимали равным 0,05.
Глава 3. Результаты и обсуждение
В зависимости от характера кардиохирургического вмешательства больные были разделены на 2 группы: I группа (187 человек, м - 130 (69,5%), ж - 57 (30,5%), средний возраст 62,2±8,3 года) - пациенты с ИБС, подвергшиеся операции АКШ; II группу составили 50 больных (м-34 (68%), ж-16 (32%), средний возраст 63,1±7,7 года), из которых у 26 (58%) пациентов диагностированы приобретенные, а у 24 (48%) - врожденные клапанные пороки сердца;
При дальнейшем анализе пациенты I группы были разделены на две подгруппы: IA подгруппа – пациенты, перенесшие операции АКШ без церебральных осложнений (ЦО) в послеоперационном периоде (ПП), и IБ подгруппа – пациенты, перенесшие операции АКШ с церебральными осложнениями в первые 12-72 часа после оперативного вмешательства.
Среди пациентов I группы в первые 12-72 часа после оперативного вмешательства осложнения в виде гипоксически-ишемической энцефалопатии с делирием и ОНМК развились в 14 случаях (IБ подгруппа), что составляет 7,49% от числа больных I группы. При этом у 11 (5,88%) человек развилась ГИЭ с делирием, а у 3 (1,61%) больных возникло ОНМК по ишемическому типу (рис. 1).
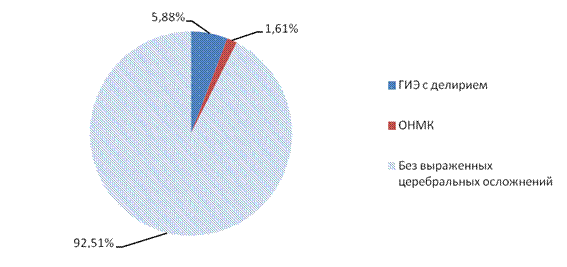
Рис. 1. Структура неврологических осложнений после операции у пациентов с АКШ
Пациенты II группы также были разделены на 2 подгруппы: IIА подгруппа – пациенты, перенесшие корригирующие операции на клапанном аппарате сердца, без тяжелых послеоперационных церебральных осложнений, и IIБ подгруппа – пациенты, перенесшие корригирующие операции на клапанном аппарате сердца, с церебральными осложнениями в первые 12-72 часа после оперативного вмешательства.
Проведенный анализ показал, что у пациентов II группы после операции церебральные осложнения возникли у 7 пациентов (IIБ подгруппа), что составило 14% от числа больных II группы, при этом у 6 (12%) пациентов развилась ГИЭ с делирием, а у 1 пациента - ОНМК по ишемическому типу (2%) (рис. 2).
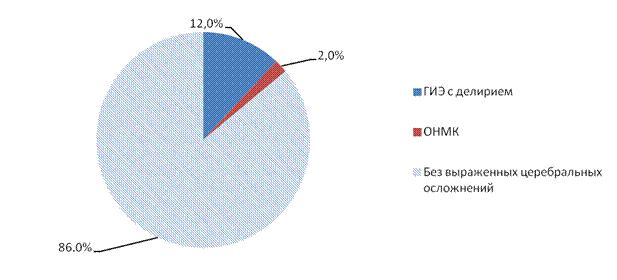
Рис.2. Структура неврологических осложнений после операции у пациентов, с корригирующими операциями на клапанном аппарате сердца
Среди больных I группы наибольший удельный вес в структуре факторов риска занимали такие факторы, как АГ и ХЦВН, несколько меньше (в пределах 35- 50%) - ПИКС, а/с БЦС, курение (табл.1)
Таблица 1.
Структура дооперационных факторов риска у пациентов I группы
Фактор риска | Число больных |
Артериальная гипертензия | 176 (94,1%) |
Атеросклероз брахицефальных сосудов | 69 (36,9%) |
Постинфарктный кардиосклероз | 92 (49,2%) |
Острое нарушение мозгового кровообращения в анамнезе | 17 (9,1%) |
Сахарный диабет | 41 (32,9%) |
Курение | 84 (44,9%) |
Злоупотребление алкоголем | 3 (1,6%) |
Фибрилляция предсердий | 6 (3,2%) |
Хроническая цереброваскулярная недостаточность | 142 (75,9%) |
Снижение фракции выброса левого желудочка < 45% | 54 (28,9%) |
Данные по факторам риска у больных II группы представлены в табл. 2.
Таблица 2.
Структура дооперационных факторов риска у пациентов II группы
Фактор риска | Число больных |
Артериальная гипертензия | 38 (76%) |
Атеросклероз брахицефальных сосудов | 11 (22%) |
Постинфарктный кардиосклероз | 9 (18%) |
Острое нарушение мозгового кровообращения в анамнезе | 3 (6%) |
Сахарный диабет | 6 (12%) |
Курение | 13 (26%) |
Злоупотребление алкоголем | 3 (6%) |
Фибрилляция предсердий | 5 (10%) |
Хроническая цереброваскулярная недостаточность | 36 (72%) |
Снижение фракции выброса левого желудочка < 45% | 15 (30%) |
Обращает внимание большая доля среди факторов риска АГ и ХЦВН у больных II группы, а на долю ПИКС, а/с БЦС, курения приходится 18-30%.
Тем не менее, доля больных с ФП выше у пациентов II группы по сравнению с I группой.
Среди таких интраоперационных факторов риска, как длительность искусственного кровообращения (ДИК) > 240 мин, время окклюзии аорты (ОА) > 150 мин, интраоперационная кровопотеря > 350 мл, а также длительность анестезии (ДА) > 210 мин у пациентов I группы обращают на себя внимания высокая частота следующих: ДА > 210 мин и интраоперационная кровопотеря > 350 мл (табл. 3).
Таблица 3.
Структура интраоперационных факторов риска у пациентов I группы
Фактор риска | Частота | Среднее значение (M±SD) |
Длительность искусственного кровообращения > 240 мин | 0 | 82,4±26,7 |
Время окклюзии аорты > 150 мин | 1 (0,5%) | 53,2±20,3 |
Длительность анестезии > 210 мин | 187 (95,2%) | 275,7±47,5 |
Интраоперационная кровопотеря > 350 мл | 54 (28,9%) | 353,7±70,9 |
Среди пациентов II группы структура интраоперационных факторов риска развития послеоперационных ЦО представлена в таблице 4.
Таблица 4.
Структура интраоперационных факторов риска у пациентов II группы
Фактор риска | Частота | Среднее значение (M±SD) |
Длительность искусственного кровообращения > 240 минут | 1 (2,0%) | 125,8±40,3 |
Время окклюзии аорты > 150 мин | 1 (2,0%) | 94,7±30,9 |
Длительность анестезии > 210 мин | 46 (92,0%) | 312,6±64,9 |
Интраоперационная кровопотеря > 350 мл | 20 (40,0%) | 393±147,1 |
Также обращает на себя внимание высокая частота пациентов с ДА > 210 мин и интраоперационной кровопотерей > 350 мл.

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 11 |



