Основным видом оперативного вмешательства у пациентов всех групп было КШ в условиях ИК. Большинству пациентов была проведена ПР (в группе бисопролола в 83%, в группе атенолола – в 70%, в группе метопролола – в 66,7% случаев).
Рецидив стенокардии III-IV ФК отмечен у 1 (2,5%) больного в группе атенолола (в группах бисопролола и метопролола – не отмечено).
ФВ ЛЖ в группе пациентов, принимавших бисопролол и атенолол, увеличилась за период наблюдения на 5,3% (с 51,7±1,1% к 1 месяцу до 52,1±0,8% и к концу периода наблюдения до 54,6±0,7% и с 49,3±1,07 до 52,2±0,7 к 1 месяцу и до 51±0,8% к концу наблюдения), группе метопролола, носила еще менее значимый характер – всего 1%.
Отчетливое увеличение продолжительности нагрузочной пробы было отмечено только в группе бисопролола (с 6,3±0,1 мин до 10,4±0,1 мин, p<0,05), в группах атенолола и метопролола изменения данного параметра носили недостоверный характер.
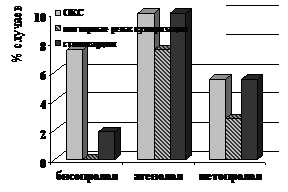
За 3 года наблюдения возобновление стенокардии III-IV ФК имело место у 1 (1,9%) пациента группы бисопролола, у 4 (10%) в группе атенолола, у 2 (5,5%) в группе метопролола.
В группе бисопролола в течение 3 лет наблюдения госпитализация наблюдалась в 15 случаях, из них 4 (7,5%) случая с ОКС (в группе атенолола – 31 случай госпитализаций, с ОКС – 4 (10%), выполнено 3 (7,5%) повторных реваскуляризации. В группе метопролола – 32 госпитализации, с ОКС – 2 (5,5%), повторных реваскуляризаций – 1 (2,8%).
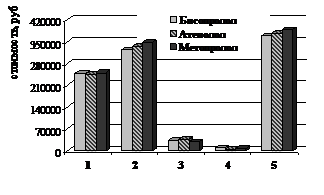
Динамика осложнений и средние затраты за весь период наблюдения за больными ИБС, включенными в исследование на рис. 14.
Динамика осложнений Средние затраты, руб.
Рисунок 14. Динамика осложнений в послеоперационном периоде и показатели средних затрат в группах больных ИБС, подвергшихся КШ в группах бисопролола, атенолола и метопролола.
1 – периоперационные затраты, руб., 2 – прямые медицинские затраты за 3 года, руб., 3 – непрямые медицинские затраты за 3 года, руб., 4 – прямые немедицинские затраты за 3 года, руб.; 5 – итоговая стоимость, руб.
Затраты на медикаментозную терапию бисопрололом составили 8.138,4±425,8 руб., атенололом - 2.628±101,5 руб., метопрололом – 6.709,2±447,1 руб.
В периоперационном периоде в группе бисопролола отмечалось увеличение положительных результатов в сравнении с группой атенолола на 26,8% при увеличении общих затрат на 2.542,1 руб.; в сравнении с группой метопролола - увеличение положительных результатов на 20,1% при снижении общих затрат на 1.915,8 руб. Через 3 года наблюдения в группе бисопролола - увеличение положительных результатов в сравнении с группой атенолола на 39,8% при снижении общих затрат на 8.162,4 руб.; в сравнении с группой метопролола - увеличение положительных результатов на 21,8% при снижении общих затрат на 18.113,5 руб.
По нашим данным назначение бисопролола позволяет ограничить ишемическо-реперфузионное повреждение в послеоперационном периоде, что проявляется в меньшей частоте проявлений ишемии миокарда, снижении количества гемодинамически значимых нарушений ритма и проводимости. Дальнейший прием препарата обеспечил не только улучшение систолической функции ЛЖ, повышение толерантности к нагрузке у больных ИБС, но и привел к меньшим материальным затратам при трехлетнем ведении данной категории пациентов.
Клинико-фармакоэкономические аспекты применения бета-адереноблокаторов у больных ИБС, подвергнутых эндоваскулярному вмешательству
После ТЛБАП со стентированием 24 пациента в периоперационном периоде и на протяжении 3 лет наблюдения принимали бисопролол (конкор, “ Nycomed ”, Австрия), 23 пациента - атенолол (атенолол, «Синтез» (г. Курган), Россия) и 23 пациента - метопролол (эгилок, “Egis”, Венгрия).
Основным видом эндоваскулярного вмешательства - была ТЛБАП со стентированием. В среднем в группе бисопролола имплантировано 1,25±0,09 стентов, (в группе атенолола - 0,9±0,04, в группе метопролола - 1,17±0,06). Стенты Сурhег (США) имплантированы 2 (8,3%) пациентам в группе бисопролола, 1 (4,3%) в группе атенолола и 2 (8,7%) в группе метопролола. Частота периоперационного ИМ составила 4,2% в группе бисопролола (в группах атенолола и метопролола – не отмечено).
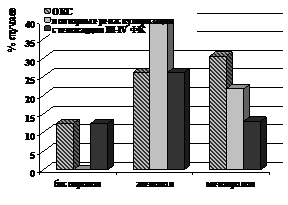
Рецидив стенокардии III – IV ФК в раннем периоде после ТЛБАП со стентированием чаще отмечен в группе атенолола – у 4 (17,4%) пациентов (p < 0,05), в группе бисопролола – у 1 (4,2%), в группе метопролола у 2 (8,7%). За весь период наблюдения рецидив стенокардии III - IV ФК в группе бисопролола составил 3 (12,5%), в группе атенолола – 6 (26%), в группе метопролола у 3 (13%).
Увеличение продолжительности нагрузочной пробы в группе бисопролола было наиболее показательно (с 7±0,02 мин до 10±0,6 мин, p<0,05), в группах атенолола и метопролола сравнения изменения данного параметра носили недостоверный характер.
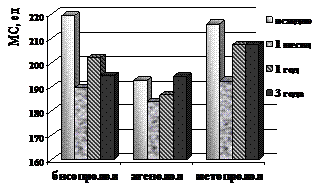
Выявлена отчетливая тенденция к уменьшению МС в группе бисопролола - с 219,4±7,3 ед., а через 1 месяц и далее 1, 2 и 3 года терапии, соответственно 189,7±6,2 ед., 202,1±6,7 ед., 199,3±5,5 ед. и 194,7±4,8 ед. В группе атенолола через 1 месяц отмечалось снижение МС ЛЖ с 192,8±3,7 до 183,9±3,3, далее – увеличение показателя до 186,7±4,1; 192,8±3,5 и 194,3±3,7.В группе метопролола – с 216±5 до 192,5±4,6 к моменту выписки, к концу 1 года – до 207,4±6,6, к концу 2 года до 210±5,9 и к концу 3 года до 207,5±6,9.
Данные представлены на рис. 15.
(а) (б)
Рисунок 15. Динамика показателей миокардиального стресса (а) и осложнений в отдаленном периоде (б) у больных ИБС, подвергшихся ТЛБАП со стентированием в группах бисопролола, атенолола и метопролола.
За 3 года наблюдения было отмечено, что возобновление стенокардии III-IV ФК имело место у 3 (12,5%) пациентов группы бисопролола, у 6 (26,1%) в группе атенолола, у 3 (13%) в группе метопролола. В группе бисопролола в течение 3 лет наблюдения 12 случаев госпитализаций, из них 3 (12,5%) случаев с ОКС (в группе атенолола – 31 случай, с ОКС – 6 (26,1%), в группе метопролола – 23 случая, с ОКС – 7 (30,4%)). За период наблюдения повторных вмешательств в группе бисопролола не проводилось. В группе атенолола – 9 (39,1%) повторных реваскуляризаций (ТЛБАП со стентированием ,8%), КШ – 1 (4,3%)). В группе метопролола – 5 (21,7%) повторных реваскуляризаций (ТЛБАП со стентированием %), КШ - 2 (8,7%)).
Средние затраты за весь период наблюдения за больными ИБС, включенными в исследование на рис. 16.
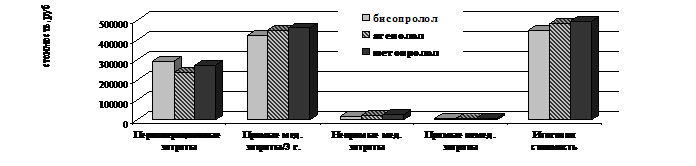
Рисунок 16. Средние затраты за период наблюдения в группах больных ИБС, подвергшихся ТЛБАП со стентированием в группах бисопролола, атенолола и метопролола
В периоперационном периоде в группе бисопролола отмечалось увеличение положительных результатов в сравнении с группой атенолола на 23,2% при увеличении общих затрат на 53.886,5 руб.; в сравнении с группой метопролола - увеличение положительных результатов на 0,7% при увеличении общих затрат на 21.031,2 руб. Через 3 года наблюдения в группе бисопролола отмечалось увеличение положительных результатов в сравнении с группой атенолола на 40,2% при снижении общих затрат на 31.152,2 руб.; в сравнении с группой метопролола - увеличение положительных результатов на 27,2% при снижении общих затрат на 44.350,8 руб.
Бета-адреноблокаторы (ББ) являются облигатными препаратами у больных ИБС. Снижая потребление миокардом кислорода, эти препараты повышают количество миокардиальной массы, спасенной при реперфузии, что особенно важно во время реваскуляризации при ОКС или после реканализации окклюзированного коронарного сосуда.
Клинико-фармакоэкономические аспекты применения ингибиторов ангиотензинпревращающего фермента у больных ИБС, подвергнутых КШ
После КШ 45 больных получали периндоприл (престариум, “Servier”, Франция), 42 - эналаприл (эднит 10 мг, Gedeon Richter, Венгрия) и 40 пациентов - лизиноприл (диротон 10 мг, Gedeon Richter, Венгрия).
Основным видом оперативного вмешательства у пациентов обеих групп было КШ в условиях ИК. Большинству пациентов была проведена ПР миокарда (в группе периндоприла в 77,8%, в группе эналаприла – в 78,6%, в группе лизиноприла – в 77,5% случаев). У 11 больных в группе периндоприла, у 6 - в группе эналаприла и у 5 – в группе лизиноприла, КШ сочеталось с ГРЛЖ.
Возобновление стенокардии III-IV ФК в ранние сроки после КШ в группах не отмечено. За три года наблюдения было отмечено, что возобновление стенокардии III-IV ФК имело место у 1 (2,2%) пациента группы периндоприла, у 2 (4,8%) в группе эналаприла, у 3 (7,5%) в группе лизиноприла
Во всех группах пациентов было отмечено достоверное снижение ФК ХСН (NYHA). Так в группе периндоприла ФК ХСН снизился с 2,13±0,04 до 1,7±0,05 (p<0,01) к концу периода наблюдения, в группе эналаприла - с 2,14±0,05 до 1,7±0,05, в группе лизиноприла - с 2,3±0,04 до 1,7±0,05 ФК.
По данным ЭхоКГ в группе периндоприла КДР ЛЖ уменьшилась за период наблюдения на 8,6%, в группе эналаприла динамика на 1,8%, в группе лизиноприла – КДР ЛЖ не изменился. К окончанию исследования в группе периндоприла ММЛЖ уменьшилась на 11,3 %, в группе эналаприла - на 9,3%, в группе лизиноприла на 7,1%.
Отмечено, что ФВ ЛЖ в группе периндоприла увеличилась за период наблюдения на 11,7% (с 48,9%±1,2 до 55,4%±2), в группе эналаприла - на 6,7% (с 48,3%±1,2 до 51,1%±0,9), в группе лизиноприла – на 0,6% (с 52,8%±1 до 53,1%±0,9) (рис. 16).
Величина МС в группе больных ИБС, находящихся на лечении периндоприлом, исходно составила 213,1±6,2 ед., к концу наблюдения - 203,5±3,9 ед. В группе эналаприла и лизиноприла отмечался достоверный рост (p<0,05) величины МС - с 203,8±5,9 ед. до 222,8±5,4 ед. и с 208,4±4,9 ед. до 214,2±4,8 ед. соответственно.
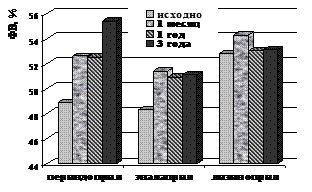
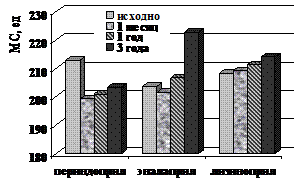
Рисунок 17. Динамика ФВ левого желудочка и миокардиального стресса за период наблюдения у больных ИБС, подвергшихся КШ в группах периндоприла, эналаприла и лизиноприла.
На фоне применения всех изучаемых препаратов было отмечено достоверное снижение как систолического, так и диастолического АД. Снижение АД в положении сидя ниже 150/90 мм рт. ст. или на 20/10 мм рт. ст. от исходного уровня было достигнуто у 69 % пациентов, принимавших периндоприл, у 55 % пациентов, получавших эналаприл и у 52% пациентов, получавших лизиноприл (Р<0,05)
В группе периндоприла в течение 3 лет наблюдения госпитализация наблюдалась в 18 случаях, (в том числе 6,7% с ОКС), в группе эналаприла - в 25 случаях (с ОКС – 2,4%, ТБАП со стентированием – 2,4%), в группе лизиноприла - в 28 случаях (7,5% с ОКС и 2,5% с ТЛБАП со стентированием).
Средние затраты за весь период наблюдения за больными ИБС, включенными в исследование на рис.17. Затраты на терапию иАПФ составили в группе периндоприла – 11.075,3±484 руб., эналаприла – 5.135,6±303,3 руб., лизиноприла – 9.409±406,9 руб.
В периоперационном периоде в группе периндоприла отмечалось увеличение положительных результатов в сравнении с группой эналаприла на 23% при увеличении затрат на 571,4 руб. (через 3 года - на 9% при увеличении общих затрат на 27.419,4 руб.); в сравнении с группой лизиноприла - увеличение положительных результатов на 7,8% при увеличении общих затрат на 8.802 руб. (через 3 года - на 8,3% при увеличении общих затрат на 14.966,8 руб.).
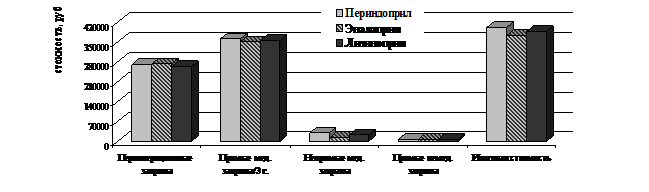
Рисунок 18. Средние затраты за период наблюдения у больных ИБС, подвергшихся КШ в группах периндоприла, эналаприла и лизиноприла
По результатам нашего наблюдения периндоприл не только повышает толерантность к нагрузкам и снижает функциональный класс ХСН, но также существенно замедляет прогрессирование ХСН. Причем, терапия периндоприлом ассоциируется с большей эффективностью, безопасностью и наилучшим соотношением стоимость–эффективность, чем применение эналаприла и лизиноприла.
Клинико-фармакоэкономические аспекты применения иАПФ у больных ИБС, подвергнутых ТЛБАП с КС
24 пациента после выполненной ТЛБАП со стентированием получали периндоприл (престариум, “Servier”, Франция), 23 - получали эналаприл (эднит 10 мг, Gedeon Richter, Венгрия) и 23 получали лизиноприл (диротон 10 мг, Gedeon Richter, Венгрия)
Основным видом эндоваскулярного вмешательства - была ТЛБАП со стентированием. Летальных исходов при выполнении вмешательств в группах не отмечено.
В среднем у пациентов группы периндоприла имплантировано 1,25±0,09 стентов (в группе эналаприла - 1±0,03, в группе лизиноприла - 1,5±0,06), Стенты Сурhег (США) были имплантированы 3 (12,5%) пациентам в группе периндоприла, 2 (8,7%) – в группе эналаприла и (8,7%) – в группе лизиноприла.
В раннем послеоперационном периоде ОИМ отмечался у 2 (8,3%) больных в группе периндоприла (в группе эналаприла и лизиноприла – не отмечено). Гемодинамически значимые НРС интраоперационно отмечены - в группе периндоприла у 3 (12,5%) больных, в группе эналаприла – у 2 (8,7%), в группе лизиноприла - у 3 (13,04%) больных. Возобновление стенокардии III – IV ФК в ранние сроки после эндоваскулярного вмешательства в группе периндоприла – не отмечено, в группе эналаприла - у 2 (8,7%), в группе лизиноприла - у 2 (8,7%) пациентов. За три года наблюдения возобновление стенокардии III-IV ФК имело место у 1 (4,2%) пациентов группы периндоприла, у 4 (17,4%) в группе эналаприла, у 4 (17,4%) в группе лизиноприла.
По данным ЭхоКГ прирост ФВ ЛЖ и уменьшение КДР ЛЖ в группах не носили достоверного характера. Через 3 года лечения периндоприлом ММЛЖ уменьшилась на 5,3 %, в группе эналаприла - на 7,7%, в группе лизиноприла - на 4,2%.
Выявлена тенденция к снижению МС (в группе периндоприла с 213,1±4,4 ед., до 203,5±6,7 ед. к концу наблюдения). В группе эналаприла и лизиноприла - недостоверное снижение МС, (с 208,8±5,5 ед. до 207,7±4,5 ед. и с 208,4±5,6 ед. до 202,1±9,9 ед. соответственно).
На фоне применения всех изучаемых препаратов у большинства пациентов во всех группах удалось достигнуть целевого уровня АД.
В периоперационном периоде в группе периндоприла отмечалось увеличение положительных результатов в сравнении с группой эналаприла на 14,3% при увеличении общих затрат на 38.539,8 руб.; в сравнении с группой лизиноприла - увеличение положительных результатов на 9,9% при снижении общих затрат на 26.817,8 руб. Через 3 года наблюдения в группе периндоприла - увеличение положительных результатов в сравнении с группой эналаприла на 35,5% при снижении общих затрат на 37.908,6руб.; в сравнении с группой лизиноприла - увеличение положительных результатов на 52,9% при снижении общих затрат на 172.057,8 руб.
Средние затраты за весь период наблюдения за больными ИБС, включенными в исследование представлены на рис.19.
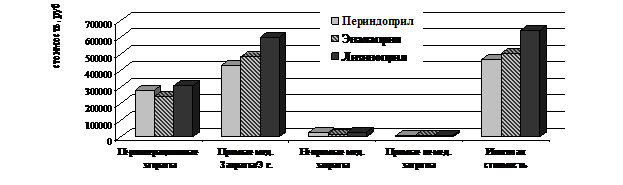
Рисунок 19. Средние затраты за период наблюдения у больных ИБС, подвергшихся ТЛБАП со стентированием в группах периндоприла, эналаприла и лизиноприла
Таким образом, несмотря на большую стоимость медикаментозной терапии в послеоперационном периоде, показатели эффективности в группе пациентов, принимавших периндоприл выше, чем в группе эналаприла.
Клинико-фармакоэкономическое сравнение применения антагонистов кальция – амлодипина и нифедипина у больных ИБС, подвергнутых КШ
После КШ 40 больным был назначен амлодипин (нормодипин, Gedeon Richter, Венгрия), 40 - нифедипин (кордипин XL, KRKA, Словения) и 40 пациентам в составе комплексной терапии не назначались аСа за весь период наблюдения.
ПР была выполнена в группе амлодипина у 82,5% пациентов, в группе нифедипина – у 60%, в группе сравнения – у 82,5%. Признаки ишемии миокарда в раннем послеперационном периоде реже встречались в группе амлодипина (в 7,5% случаев против 10% в группе нифедипина, 7,5% в группе сравнения, p < 0,05). Рецидив стенокардии в раннем послеоперационном периоде отмечен в группе нифедипина у 2 (5%), в группе сравнения – у 1 (2,5%) больных (в группе амлодипина – не отмечено).
Было выявлено снижение ММЛЖ в группах амлодипина и нифедипина на 16,9 и 13,8% соответственно, в группе сравнения - на 4,2%.
За 3 года наблюдения возобновление стенокардии III-IV ФК имело место у 4 (10%) в группе нифедипина, у 2 (5%) в группе сравнения (в группе амлодипина – не отмечено).
По нашим результатам за трехлетний период наблюдения в группе амлодипина получено достоверное снижение уровней холестерина и триглицеридов на 10,2% и 13,3% (в группе нифедипина – 7,8% и 11,8%, в группе сравнения – 4% и 0% соответственно). Уровень ХС ЛПНП уменьшился на 15,6% (в группе нифедипина – на 7,1%, в группе сравнения -5,7%), количество ХС ЛПВП возросло на 18,2% (в группе нифедипина – без изменений, в группе сравнения – на 2%), индекс атерогенности снизился на 13,5% (в группе нифедипина – на 5,1%, в группе сравнения – без изменений).
В группе амлодипина в течение 3 лет наблюдения госпитализация наблюдалась в 17 случаях (с ОКС – 2,5%), в группе нифедипина - 43 случая (в т. ч. с ОКС – 17,5%), в группе сравнения - 27 случаев госпитализаций (с ОКС – 5%).
Средние затраты за весь период наблюдения за больными ИБС, включенными в исследование представлены на рис. 20.
Стоимость лечения антагонистов кальция на амбулаторном этапе в группе амлодипина составила – 9.543,7±794,9 руб. (в группе нифедипина– 8.847,6±832,2 руб.).
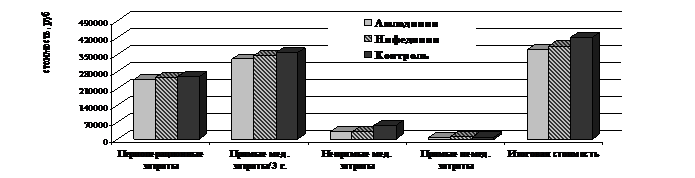
Рисунок 20. Средние затраты у больных ИБС, подвергшихся КШ в группах амлодипина, нифедипина и не принимающих антагонисты кальция за период наблюдения
В периоперационном периоде в группе амлодипина отмечалось увеличение положительных результатов в сравнении с группой нифедипина на 12,5% при снижении общих затрат на 8.871 руб.; с группой контроля - увеличение положительных результатов на 12,5% при снижении общих затрат на 13.302,9 руб. Через 3 года наблюдения в группе амлодипина отмечалось увеличение положительных результатов в сравнении с группой нифедипина на 30% при снижении общих затрат на 16.457,8 руб.; в сравнении с группой контроля - увеличение положительных результатов на 25% при снижении общих затрат на 53.978,6 руб.
По нашим данным включение в схему лечения амлодипина позволяет в два раза снизить частоту рецидива стенокардии, количество госпитализаций с ОКС. В группе пациентов, принимающих амлодипин более отчетливо наблюдается обратное развитие гипертрофии миокарда и положительное влияние на нормализацию липидного обмена (снижение ХСЛПНП и увеличение ЛПВП) при снижении общих затрат на данную категорию пациентов.
Клинико-фармакоэкономические аспекты применения триметазидина модифицированного высвобождения у больных ИБС, подвергнутых КШ
50 больных после КШ в периоперационном периоде получали триметазидин МВ (предуктал МВ, “Servier”, Франция) и 52 пациента не принимали триметазидин за весь период наблюдения.
Большинству пациентов была проведена ПР (в группах триметазидина МВ и группе сравнения, соответственно, в 80% и 73,1% случаев). У 5 больных группы триметазидина МВ и 9 пациентов в группе сравнения, КШ сочеталось с ГРЛЖ.
В раннем послеоперационном периоде после КШ признаки электрической нестабильности миокарда (ригидный синусовый ритм, АВ диссоциация, миграция водителя ритма, частые желудочковые и предсердные экстрасистолы, внутрижелудочковые, АВ - и СА блокады) реже наблюдались в группе пациентов ИБС, принимавших триметазидин МВ (в 2% случаев против 7,7% в группе сравнения, p < 0,05). Кроме того, в группе триметазидина МВ реже фиксировались пароксизмы фибрилляции предсердий (соответственно, 4% и 13% случаев, p < 0,05), признаки ишемии миокарда (в 4% случаев против 9,2% в группе сравнения, p < 0,05). Интраоперационный ИМ встречался только в группе сравнения в 3,7% случаев, рецидив стенокардии III-IV ФК в раннем послеоперационном периоде отмечен у 1 (1,9%) пациента в группе сравнения (в группе триметазидина – не отмечено).
Уменьшение ФК стенокардии и ФК ХСН (NYHA) носило высоко достоверный характер (p<0,001): в группе триметазидина МВ ФК стенокардии с 2,96±0,03 до 0,02±0,01 к 1 месяцу наблюдения и до 0,1±0,02 к концу периода наблюдения, За период наблюдения возобновление стенокардии III-IV ФК имело место в группе триметазидина МВ у 1 (2%) и у 5 (9,6%) больных в группе сравнения (p<0,05).
ФК ХСН (NYHA) с 2,17±0,02 до 1,5±0,03 (p<0,01) к концу периода наблюдения. В группе сравнения – ФК стенокардии уменьшился с 2,8±0,1 до 0,13±0,01 к 1 месяцу и до 0,4±0,02 к концу периода наблюдения, ФК ХСН – с 2,2±0,02 до 1,9±0,01 (р>0,05).
Было отмечено, что ФВ ЛЖ в группе триметазидина МВ, увеличилась за период наблюдения на 15,7% (с 48,7±1,6% к 1 месяцу до 51,7±1,1% и к концу периода наблюдения до 57,8±0,9%), в группе сравнения динамика показателя носила менее значимый характер – всего 2,1% (с 50,1±0,8%, к первому месяцу – до 52,6±0,6% и к концу периода наблюдения – до 51,2±0,5%).
В группе триметазидина МВ в течение 3 лет госпитализация наблюдалась в 14 случаях (с ОКС – 2 (4%)), повторных реваскуляризаций – не потребовалось. В группе сравнения - 28 случаев госпитализаций (с ОКС – 5 (9,6%)), выполнено 3 (5,8%) повторных реваскуляризаций (в течение 1 года после КШ).
В периоперационном периоде в группе триметазидина МВ отмечалось увеличение положительных результатов в сравнении с группой сравнения - на 10,9% при снижении общих затрат на 13.611,6 руб. Через 3 года наблюдения в группе триметазидина МВ - увеличение положительных результатов на 30,6% при снижении общих затрат на 17.976,1 руб.
Средние затраты за весь период наблюдения представлены на рис.21.
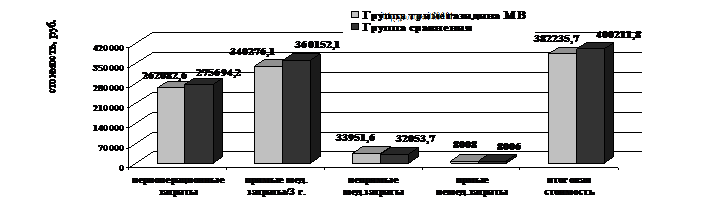
Рисунок 21. Средние затраты у больных ИБС, подвергшихся КШ в группе триметазидина МВ и в группе сравнения за весь период наблюдения
Использование триметазидина МВ способствует уменьшению случаев возвратной стенокардии и безболевой ишемии миокарда и в раннем послеоперационном и в отдаленном периоде. Использование триметазидина МВ способствует наиболее быстрому восстановлению как систолической, так и диастолической функций миокарда, что связано с его кардиопротекторными и противоишемическими свойствами.
Клинические аспекты эффективности применения триметазидина модифицированного высвобождения у больных ИБС, при проведении эндоваскулярных вмешательств
28 пациентов в периоперационном периоде при выполнении ТЛБАП со стентированием получали триметазидин МВ (предуктал МВ, “Servier”, Франция) сравнили с результатами вмешательства у 28 пациентов, которые не принимали триметазидин МВ за весь период наблюдения.
После эндоваскулярного вмешательства уменьшение ФК стенокардии носило достоверный характер (p<0,001): в группе триметазидина МВ с 2,7±0,03 до 0,8±0,03 к 1 месяцу наблюдения и до 1,4±0,03 к концу периода наблюдения; в группе сравнения - с 2,6±0,04 до 0,9±0,04 к 1 месяцу и до 1,5±0,03 к концу периода наблюдения. Рецидив стенокардии III-IV ФК в группе триметазидина МВ отмечен у 1 (3,6%), в группе сравнения у 4 (14,3%) пациентов.
В группе триметазидина МВ, отмечено достоверное снижение ФК ХСН (NYHA) с 2±0,01 до 1,8±0,05 (p<0,05) к 3 году наблюдения, в группе сравнения - тенденция к уменьшению показателя (с 2±0,01 до 1,9±0,02).
Была обнаружена тенденция к уменьшению МС. В группе триметазидина МВ, исходно величина МС составила 207,6±4,4 ед., к концу периода наблюдения 205,5±2,5 ед. В группе сравнения отмечался рост величины МС к концу периода наблюдения.
За период наблюдения в группе триметазидина рецидив стенокардии III-IV ФК отмечен у 1 (3,6%) пациента, в группе сравнения у 5 (17,8%).
В группе триметазидина МВ к моменту выписки из стационара количество наджелудочковых, в т. ч. суправентрикулярных экстрасистол уменьшилось на 83,5% (в группе сравнения – на 24,8%), к моменту окончания исследования – уменьшение на 93,03%, по сравнению с данными на конец 1 месяца – на 57,6%, по сравнению с первым годом – на 12,6% (в группе сравнения – на 46,4%, 28,7% и к окончанию исследования – увеличение на 3,6%).
В группе триметазидина отмечается уменьшение количества пациентов с пароксизмальной желудочковой тахикардией с 3 (10,7%) до 0, в группе сравнения за период наблюдения увеличилось количество пациентов с ПЖТ на 66,7% (с 1 (3,6%) исходно до 3 (10,7%) к третьему году).
В группе триметазидина МВ в течение 3 лет наблюдения госпитализация наблюдалась в 9 случаях, проведена 1(3,6%) повторная реваскуляризация. В группе сравнения в течение периода наблюдения - 16 случаев госпитализаций (с ОКС – 1 (3,6%)). Выполнено 6 (21,4%) повторных реваскуляризаций,8%) - ТЛБАП со стентированием и 1 (3,6%) – КШ).
Средние затраты за весь период наблюдения представлены на рис.22.
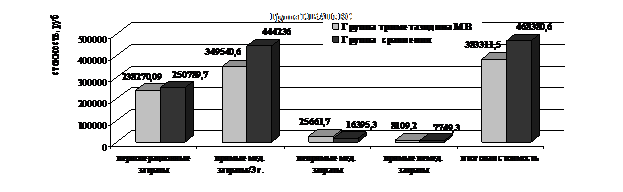
Рисунок 22. Средние за весь период наблюдения у больных ИБС, подвергшихся ТЛБАП со стентированием в группе триметазидина МВ и в группе сравнения
В периоперационном периоде в группе триметазидина МВ отмечалось увеличение положительных результатов в сравнении с группой сравнения - на 7,1% при повышении общих затрат на 12.519,6 руб. (за 3 года - увеличение положительных результатов на 32,1% при снижении общих затрат на 85.069,1 руб.).

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 |



