При обострении хронического панкреатита отмечено повышение содержания в крови CD25 позитивных лимфоцитов (р=0,02), что является характерным признаком активации воспалительного процесса любой этиологии ( с соавт., 2009). Активация CD25+-клеток отражает активный иммунный ответ на хроническое воспаление в ткани поджелудочной железы. При этом наблюдалось снижение активности фагоцитарной способности циркулирующих нейтрофилов (р=0,01) у пациентов пожилого и старческого возраста с хроническими панкреатитами, что считается одним из факторов, способствующих осложненному течению данной патологии ( с соавт., 2006).
Наибольший интерес представляло изучение особенностей иммунного статуса и параметров оксидативного стресса у обследованных пациентов в зависимости от распространенности системного и абдоминального атеросклеротического процесса. Результаты исследования свидетельствовали о развитии дисбаланса субпопуляционного состава лимфоцитов, цитокинового спектра крови, стимуляции функциональной активности и истощении биоцидного потенциала нейтрофилов при прогрессировании атеросклероза у пациентов пожилого и старческого возраста с хроническими заболеваниями органов пищеварения. Установлена прямая корреляционная зависимость содержания Т-цитотоксических (rs=0,29, p=0,0001), TNK-лифоцитов (rs=0,28, p=0,001), CD3+25+ и CD3+HLADR+-лимфоцитов (rs=0,19, p=0,007 и rs=0,25, p=0,0001 соответственно) от количества пораженных сосудистых бассейнов, что свидетельствует об активации клеточного звена адаптивного иммунитета при прогрессировании атеросклероза. Увеличение распространенности системного атеросклероза сопровождалось снижением уровня В-лимфоцитов (CD3-19+) и повышением концентрации ЦИК в периферической крови больных (rs=-0,18, p=0,014 и rs=0,18, p=0,01 соответственно).
Баланс между провоспалительными и противовоспалительными факторами является решающим для прогрессирования атеросклероза (Нагорнев В А., 2006; Frostegard J., Ulfgren A. K., Nyberg P., et al., 1999). Уровень ИЛ1α тесно коррелировал с количеством пораженных сосудистых бассейнов (rs=0,48, p=0,018). В настоящее время большинство исследований демонстрируют проатерогенную роль ИЛ1β (Hasdai D., Scheinowitz M., 1996), данные о значение ИЛ1α в атерогенезе представлены в единичных исследованиях (Kamari Y., Shaish A., Shemesh S. et al., 2011). Содержание NK (CD3-16+CD56+) в крови пациентов пожилого и старческого возраста с хроническими заболеваниями ЖКТ уменьшалось по мере прогрессирования атеросклероза (rs=0,-27, p=0,0002). Так же нами отмечена положительная корреляция между количеством сосудистых бассейнов и относительным содержанием палочкоядерных нейтрофилов (rs=0,15, p=0,03), что может свидетельствовать об активации данных эффекторных клеток врожденного звена иммунной системы. Однако при этом лизосомальная функция нейтрофильных гранулоцитов снижалась по мере увеличения распространенности атеросклероза (rs=0,-14, p=0,04).
Атеросклеротическое поражение брюшной аорты и ее висцеральных ветвей является частным проявлением системного атеросклероза. Изменения иммунного статуса при увеличении распространенности абдоминального атеросклероза были однонаправлены наблюдаемым сдвигам при системном атеросклерозе (таб. 4).
Таблица 4.
Сравнительная характеристика иммунологических показателей и параметров оксидативного стресса у гастроэнтерологических больных пожилого и старческого возраста с различной выраженностью атеросклероза в бассейне брюшной аорты
Показатель | Группа 1 n=29 | Группа 2 n=106 | Группа 3 n=75 | P |
Субпопуляционный состав лимфоцитов | ||||
Т-цитотоксические (CD3+8+), % | 23,6±9,06 | 23,1±9,56** | 30,5±9,44# | 0,015 |
Т-цитотоксические (CD3+8+), 109/л | 413±194* | 431±238 | 649±400# | 0,002 |
ТNK-лимфоциты (CD3+16+CD56+), % | 1,53±1,02* | 5,49±4,61 | 5,38±5,19# | 0,002 |
ТNK-лимфоциты (CD3+16+CD56+), 109/л | 24,2±16,9* | 68,8±74,5 | 90,2±81,7# | 0,006 |
Функциональная активность нейтрофилов | ||||
Лизосомальная активность нейтрофилов, у. е. | 295±92,5* | 268±58,9** | 260±67,5 | 0,008 |
НСТ-тест нейтрофилов спонтанный, активность, % | 17,1±12,6 | 18,3±11,6* | 19,8±11,5# | 0,047 |
НСТ-тест индуцированный, активность, % | 36,8±16,0* | 33,7±14,5 | 31,0±14,1# | 0,048 |
ФР нейтрофилов, у. е. | 2,13±0,38* | 1,75±0,29** | 1,61±0,26# | 0,002 |
Цитокины, пг/мл | ||||
ИЛ1α | 69,2±19,0* | 80,5±64,3** | 98,9±60,6# | 0,021 |
ФНОα | 0,91±0,24* | 1,38±0,67** | 1,31±0,51 | 0,031 |
Метаболиты NO, мкмоль/л | ||||
Общее содержание метаболитов NO | 22,2±8,19 | 23,2±5,76** | 25,8±7,84# | 0,002 |
Нитриты | 5,31±1,71* | 7,01±5,57** | 8,07±3,62# | 0,002 |
Показатели ПОЛ-АОЗ | ||||
Каталаза эритроцитов, мкмоль/л | 25,3±7,18 | 21,6±9,40 | 20,3±14,3# | 0,090 |
КД иСТ[и], ед. и.о. | 0,32±0,15 | 0,33±0,10** | 0,39±0,14# | 0,057 |
Примечение: 1. данные представлены в виде средней арифметической и ее стандартной ошибки (M±m). 2. оценка статистической неоднородности групп проводилась с помощью критерия Крускала-Уоллиса (р), с последующим уточнением характера различий по критерию Манна-Уитни; 3. *- различия между показателями 1 и 2 групп достоверны при р<0,05; **- различия между показателями 2 и 3 групп достоверны при р<0,05; # - различия между показателями 1 и 3 групп достоверны при р<0,Выделены показатели, имеющие значимые различия
У больных с атеросклерозом в бассейне брюшной аорты, независимо от его распространенности, наблюдалось увеличение содержания TNK-лимфоцитов. Наиболее выраженные изменения иммунных параметров отмечены у пациентов с поражением непарных висцеральных ветвей. В данной группе выявлено повышение уровня Т-цитотоксических и Т-лимфоцитов, экспрессирующих активационные антигены – HLA-DR. Выявленные в периферической крови изменения могут свидетельствовать о том, что активация Т-клеток при атеросклерозе в бассейне брюшной аорты не ограничивается зоной бляшки.
Полученные данные свидетельствуют о том, что увеличение распространенности атеросклероза в бассейне брюшной аорты сопровождалось повышением концентрации в периферической крови больных ИЛ1α и ФНОα, обладающих способностью индуцировать друг друга и проявляющих многочисленные общие эффекты. В настоящее время считается доказанным, что наряду с классическими нейрогормонами, гиперэкспрессия цитокинов вносит существенный вклад в развитие и прогрессирование сердечной недостаточности ( и соавт., 2010; Ansari A., 1987; Hosenpud J. D., Campbell S. M., Mendelson D. J., 1989). Возможно, наблюдаемое возрастание концентрации ИЛ 1α и ФНОα является одним из механизмов связи между прогрессированием висцерального атеросклероза и увеличением тяжести сопутствующей сердечно-сосудистой патологии. Отдельного внимания заслуживает выявленная положительная корреляция между содержанием в крови ИЛ 1α и выраженностью абдоминальной боли у пациентов с атеросклерозом висцеральных артерий (рис. 3). Следует отметить, что до настоящего времени нет единого представления о патогенезе абдоминальных болей при ишемии органов пищеварения. Основными импульсами для возникновения любой висцеральной боли являются внезапное повышение давления в полом органе, растяжение его стенки или капсулы паренхиматозных органов и натяжение брыжейки. Некоторые авторы выделяют «сосудистую боль», возникающую при ишемии и обусловленную раздражением симпатических нервов сосудистых сплетений ( и соавт., 2009). Помимо этого, гипоксия ткани сопровождается гиперпродукцией биологически активных веществ, раздражающих внутриорганно расположенные нервные окончания (, , 2001). Вполне вероятно, что один из компонентов патогенеза сосудистой боли сопряжен и с активацией иммуно-воспалительных механизмов. Возникающие при этом устойчивые изменения цитокинового профиля способствуют формированию провоспалительного статуса как на периферии, так и в структурах мозга, что имеет важное значение в генезе хронических болевых синдромов (Capuron L, Dantzer R., 2003; Watkins L. R., Maier S. F., 2000).


Рисунок 3. Корреляционная зависимость между выраженностью абдоминальной боли и концентрацией ИЛ1α в крови больных пожилого и старческого возраста с хроническими заболеваниями органов пищеварения и атеросклерозом в непарных висцеральных артерий
В настоящее время внимание многих исследователей привлечено к изучению роли нейтрофильных гранулоцитов в патогенезе атеросклероза (Baetta R., Corsini A., 2010; Soehnlein O., Weber C., 2009). У пациентов пожилого и старческого возраста с хроническими заболеваниями органов пищеварения по мере увеличения распространенности атеросклероза обнаружены одновременно признаки активации и истощения функций нейтрофилов. При этом наиболее значимые изменения функции нейтрофилов отмечены при прогрессировании атеросклероза в бассейне брюшной аорты. По мере увеличения распространенности атеросклероза в бассейне брюшной аорты показатели активности спонтанного НСТ-теста нейтрофилов повышались, в то время как активность индуцированного НСТ-теста, функционального резерва (ФР) и лизосомальная активность нейтрофилов, напротив, снижались. Данные изменения можно расценивать как признаки развивающейся недостаточности эффекторных функций нейтрофилов, вероятно, связанные с истощением на фоне длительной активации. При этом спонтанное повышение кислородзависимых метаболических процессов в нейтрофилах коррелировало с количеством пораженных висцеральных артерий (rs=0,25, p=0,028). Известно, что активация оксидативного метаболизма нейтрофилов может быть индуцирована липополисахаридами грамотрицательных кишечных бактерий (, , 1996), транслокация которых через кишечную стенку, по-видимому, усиливается в условиях хронической ишемии. Указанный факт в настоящее время расценивается как один из возможных механизмов прогрессирования сердечно-сосудистой патологии (, , и соавт., 2007; Tsunooka N., Hamada Y., Imagava H. et al., 2003).
Значительный интерес вызывает наблюдаемое снижение лизосомальной активности нейтрофилов по мере прогрессирования как абдоминального, так и системного атеросклероза. Известно, что одним из основных бактерицидных компонентов, содержащихся в лизосомах нейтрофилов, является миелопероксидаза (, , 2001). Истощение лизосомальной активности может быть сопряжено с повышенным высвобождением данного фермента нейтрофильными гранулоцитами. В настоящее время повышение активности миелопероксидазы в периферической крови рассматривается как один из факторов, способствующих развитию и прогрессированию коронарного атеросклероза (Morrow D. A., Sabatine M. S., Brennan M. L. et al., 2008). Данный феномен связан со способностью миелопероксидазы в присутствии Н2О2 и ионов Cl¯, Br¯, I¯ образовывать гипогалогениты – мощные биоцидные вещества, участвующие в окислительной модификации ЛПН и повреждении различных клеток (, , и соавт., 2008). Помимо этого, миелопероксидаза снижает биодоступность NO (Nicholls S. J., Hazen S. L., 2005).
Несмотря на то, что в настоящем исследовании приоритет отдан оценке роли иммунных механизмов в прогрессировании атеросклероза, было проведено изучение состояния других биологических систем у пациентов пожилого и старческого возраста с хроническими заболеваниями ЖКТ. Считается, что нарушение синтеза NO занимает ведущее место в патогенезе эндотелиальной дисфункции и, возможно, атеросклероза (Cooke J. P., 1996). При атеросклерозе активность эндотелиальной NOS снижена, однако общее количество оксида азота может быть даже увеличено, что связывают с повышением экспрессии iNOS (Wever R. M. et al., 1998). У обследованных больных с признаками атеросклероза в бассейне брюшной аорты уровень циркулирующих продуктов метаболизма NO повышен преимущественно за счет содержания нитратов (таб. 4). Следует отметить, что многие лекарственные средства, применяемые для терапии кардиоваскулярных заболеваний, способны влиять на высвобождение NO ( и соавт., 2002; W. H. van Gilst, 2007; Grossman E., Messerli F. H., 2004; Sudhir K., Chou T. N., Hutchison S. G. et al., 1996). Результаты проведенного исследования свидетельствуют о том, что пациенты с атеросклерозам в бассейне брюшной аорты достоверно чаще получали статины, β-адреноблокаторы, антагонисты кальция, ингибиторы ангитензинпревращающего фермента и тиазидные диуретики, чем пациенты без атеросклероза. Вместе с тем частота назначения данных препаратов не зависела от распространенности атеросклероза в указанном бассейне. О развитии дисфункции нитроксидергической системы при прогрессировании атеросклероза свидетельствует наличие прямой корреляционной зависимости между количеством пораженных сосудистых бассейнов у обследованных больных и общим содержанием метаболитов NO (rs=0,57, p=0,0001). Возрастание концентрации метаболитов оксида азота, в свою очередь, было сопряжено с увеличением активности фагоцитоза нейтрофилов и числа нейтрофилов (rs=0,17, p=0,018), способных спонтанно продуцировать активные формы кислорода. При этом лизосомальная активность нейтрофильных гранулоцитов снижалась по мере увеличения распространенности атеросклероза (rs=0,-25, p=0,0003).
Фагоцитирующие клетки являются одними из основных продуцентов не только оксида азота, но и активных форм кислорода – главного фактора их цитотоксичности (Di Virgilio F., 2004). Радикальные окислительные реакции, протекающие с участием активированных кислородных метаболитов, являются атерогенным фактором, так как вызывают модификацию липопротеинов плазмы крови и оказывают цитотоксическое и деструктивное действие на клетки и ткани (, , и соавт., 2008). По нашим данным увеличение распространенности атеросклероза как в бассейне брюшной аорты, так и в других сосудистых бассейнах сопровождалось увеличением содержания вторичных продуктов ПОЛ – изопропанолрастворимых КД и СТ (таблица 4). Уровень изопропанолрастворимых вторичных липопероксидов в сыворотке крови закономерно возрастал при увеличении активности и интенсивности спонтанного НСТ-теста нейтрофилов, свидетельствующего об активации их кислородзависимого метаболизма (rs=0,22, p=0,003 и rs=0,27, p=0,0002 соответственно).
У пациентов с атеросклерозом ветвей брюшной аорты отмечено снижение активности одного из изучаемых параметров АОЗ – каталазы эритроцитов. При этом распространенность атеросклероза в бассейне брюшной аорты увеличивалась по мере снижения активности данного фермента (rs=-0,26, p=0,0002). Полученные данные согласуются с результатами других исследований, свидетельствующих о том, что атеросклеротический процесс прогрессирует на фоне снижения уровня природных антиоксидантов в тканях (, , 2003; , , и соавт., 2008). Следует отметить, что активность СОД в сыворотке крови имела тенденцию к росту по мере увеличения распространенности атеросклероза. Такое разнонаправленное изменение активностей этих двух ферментов, согласно литературным данным, характерно для гипоксии (, 2003). Известно, что в результате супероксиддисмутазной реакции возможно образование пероксида водорода, под действием которого может наблюдаться инактивация каталазы (Pigeolet E., Corbisier P., Houbion A. et al., 1990). Кроме того, пероксид водорода является метаболическим предшественником агрессивного гидроксильного радикала, поэтому при дефиците каталазы высокая активность СОД служит дополнительным повреждающим фактором (, , 2010).
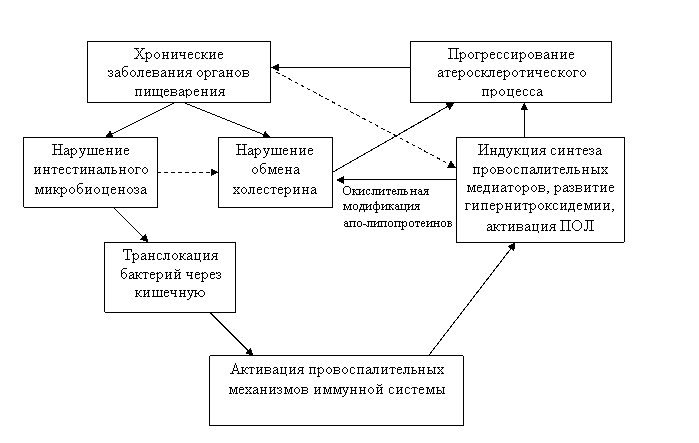
Рисунок 4. Участие иммунной системы в прогрессировании атеросклероза у больных пожилого и старческого возраста с хроническими заболеваниями органов пищеварения
Таким образом, полученные данные позволяют предположить, что участие иммунной системы в прогрессировании атеросклероза у больных пожилого и старческого возраста с патологией ЖКТ заключается в следующем (рис. 4). Хронические заболевания органов пищеварения служат факторами, способствующими индукции провоспалительных механизмов. У геронтологических больных в большинстве случаев болезни пищеварительной системы приводят к нарушениям интестинального микробиоценоза (Gregg C. R., 2002). При развитии синдрома избыточного бактериального роста микроорганизмы в большей степени способны к транслокации через кишечную стенку во внутреннюю среду организма (, , 2001). Клеточные продукты грамотрицательных кишечных бактерий активируют различные компоненты иммунной системы, запускают каскад синтеза провоспалительных цитокинов, индуцируют оксидативный метаболизм нейтрофилов с выходом свободных радикалов кислорода и других биологически активных соединений (, , 1998; , , 1996). Развитие иммунной дисфункции и оксидативного стресса способствует прогрессированию хронического воспаления сосудистой стенки, являющего основой атеросклеротического процесса. Помимо этого, заболевания органов пищеварения во многих случаях сопряжены с нарушениями липидного спектра крови. Наблюдаемое увеличение образования свободных радикалов и продуктов ПОЛ являются причиной модификации липопротеинов, что так же может вносить вклад в прогрессирование атеросклероза (Bhakdi S., 1998). В свою очередь, атеросклеротическое поражение бассейна брюшной аорты усугубляет патологические изменения ЖКТ и иммунные нарушения. Развитие сердечной недостаточности при коронарном атеросклерозе может приводить к венозному застою в стенках кишечника и способствовать изменениям интестинального микробиоценоза (, , и соавт., 2007).
В целом, полученные данные свидетельствуют о том, что прогрессирование атеросклероза у пациентов пожилого и старческого возраста с хроническими заболеваниями органов пищеварения сопровождается активацией провоспалительных механизмов иммунной системы и сопутствующей интенсификацией оксидативного стресса. В этой связи одним из вариантов патогенетической терапии данной категории больных является применение лекарственных средств, обладающих антиоксидантным действием. Следует отметить, что результаты исследований эффективности антиоксидантов при атеросклерозе противоречивы (, 2002). Однако многие авторы отмечают перспективность дальнейшего применения данной группы препаратов (Gote G., Tardif J.-C., Lesperance J. et al, 1999; Lankin V., Tikahaze A. K., Kukharchuk V. V., 2003). К числу наиболее эффективных и безопасных антиоксидантных средств относятся производные 3-оксипиридина – эмоксипин и мексидол ( и соавт., 2006, 2010; , , 2002; и соавт., 1999), эффективность применения которых у геронтологических пациентов с патологией органов пищеварения и висцеральным атеросклерозом до настоящего времени не исследована. Включение эмоксипина и мексидола в схему терапии больных с хронической патологией органов пищеварения и атеросклерозом брюшной аорты влияло на кислородзависимый метаболизм нейтрофилов, уменьшая их активность в спонтанном НСТ-тесте, и приводило к равновыраженному снижению вторичных липопероксидов (таб. 5). Способность производных 3-оксипиридина предупреждать активацию механизмов свободно-радикального окисления, влиять на биологические свойства мембран иммунокомпетентных клеток, по-видимому, обусловливает наблюдаемые сдвиги показателей системы врожденного иммунитета под действием этих препаратов (, , 2006).
В результате проведенного исследования было установлено, что включение эмоксипина в схему комплексного лечения пациентов приводило к существенному снижению абдоминальной боли. Мексидол оказывал аналогичное влияние на состояние нейтрофилов и липидной пероксидации, однако не вызывал значимых изменений клинической симптоматики. Не исключено, что это связано с наличием в структуре мексидола сукцината. Известно, что в процессе окисления янтарной кислоты выделяется перекись водорода, которая в условиях дефицита каталазы может поддерживать оксидативный стресс и за счет этого снижать выраженность терапевтического эффекта своего 3-оксипиридинового компонента.
Таблица 5
Влияние производных 3-оксипиридина на регресс клинической симптоматики и лабораторные показатели у больных пожилого и старческого возраста с хроническими заболеваниями органов пищеварения и атеросклерозом в бассейне брюшной аорты, M±m

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 |




