5. Предотвращение баротравмы. Баротравма приводит к развитию пневмотораксов, пневмомедиастинума, формированию микрокист в интерстиции легких (интерстициальная эмфизема) с развитием системной газовой эмболии, пневмоперитонеума, подкожной эмфиземы. Баротравме подвержены в основном интактные (вентилируемые) участки легочной ткани, где при проведении респираторной поддержки при остром повреждении легких и ОРДС пиковое давление достигает 140 см вод. ст., в то время как в соседних участках давление может не превышать 5-10 см вод. ст. При этом повреждающими факторами считаются пиковое давление в дыхательных путях и давление плато. Пиковое давление в дыхательных путях отражает податливость легочной ткани и сопротивление дыхательных путей, при этом с ростом сопротивления в дыхательных путях отмечается преимущественный рост пикового давления, в то время как при снижении податливости легочной ткани происходит преимущественный рост давления плато. При повышенном сопротивлении в дыхательных путях и высоком пиковом давлении прирост давления в альвеолах небольшой, поэтому вероятность баротравмы возрастает незначительно, а при росте давления плато (то есть снижении податливости легочной ткани) прирост давления в альвеолах значителен, соответственно резко возрастает вероятность баротравмы. Величина давления плато напрямую коррелирует с вероятностью летального исхода. Поэтому при проведении респираторной поддержки при ОПЛ и ОРДС необходимо в первую очередь избегать превышения давления плато.
6. Предотвращение прогрессирования органной легочной и системной воспалительных реакций – биотравмы. Предотвращение биотравмы базируется на предотвращении ее компонентов: баротравмы, волюмотравмы, ателектатической травмы, каждый из которых ведет к локальному высвобождению медиаторов воспаления (ФНО, интерлейкинов, лейкотриенов, вазоактивных веществ, прокоагулянтов, гамма-интерферона и т. д.) и выделению их в системный кровоток с формированием полиорганной дисфункции при тяжелом сепсисе. Применение протективной вентиляции легких позволяет предотвратить прогрессирование синдрома системной воспалительной реакции и полиорганной дисфункции при тяжелом сепсисе и уменьшить летальность, т. е. избежать вентилятор-индуцированного повреждения легких, вентилятор-индуцированной полиорганной недостаточности и «вентилятор-индуцированной смерти».
Параметры респираторной поддержки
Выбор названия режима респираторной поддержки при ОПЛ и ОРДС не является первостепенной задачей, так как в разных режимах возможен подбор параметров респираторной поддержки и дыхательного цикла в соответствии с показателями биомеханики дыхания, газовым составом артериальной и смешанной венозной крови, показателями гемодинамики и кислородтранспортной функции крови с учетом предотвращения вентилятор-индуцированного повреждения легких. Предпочтение должно отдаваться вспомогательным режимам вентиляции, в которых сам пациент по возможности инициирует максимальное количество вдохов, так как в этом случае улучшаются вентиляционно-перфузионные соотношения в легких, уменьшаются неблагоприятные эффекты на гемодинамику и легочное кровообращение, предотвращается атрофия дыхательных мышц, а дыхательная кривая соответствует потребностям пациента. Подбор параметров респираторной поддержки осуществляется для обеспечения необходимого пациенту потока, объема и давлений в дыхательных путях, а также для дозированной нагрузки на дыхательные мышцы.
Например, необходимые параметры респираторной поддержки такие как поток, дыхательный объем, инспираторное время, инспираторное давление (или давление плато), ПДКВ, среднее давление в дыхательных путях, соотношение вдоха к выдоху можно выдержать как в режиме управляемой вентиляции с заданным дыхательным объемом (vcCMV), так и в режимах вентиляции с управляемым давлением (pcCMV, BIPAP), режимах вспомогательной респираторной поддержки (SIMV+PS, CPAP+PS, СРАР, PPS).
Дыхательный объём (Vt)
Дыхательный объем в математическом смысле равен площади под кривой «поток-время», то есть является производным потока и инспираторного времени. Применение дыхательного объема 6 мл/кг идеальной массы тела приводит к значительному снижению летальности у пациентов с ОПЛ/ОРДС. При этом необходимо поддерживать адекватный минутный объем вентиляции за счёт регуляции частоты дыхания. Допустимо использование больших дыхательных объемов при высоком метаболизме, большом альвеолярном мертвом пространстве (например, при эмболии легочных сосудов) или высокой фракции шунта, когда недопустимо использование гиперкапнии, но дыхательный объем не должен превышать 10 мл/кг идеальной массы тела. Также возможно увеличение дыхательного объема до 10 мл/кг идеальной массы тела при восстановлении функции лёгких, увеличении податливости легочной ткани, высоком сопротивлении дыхательных путей. Применение больших дыхательных объемов приводит к вентилятор-индуцированному повреждению легких и прогрессированию легочной воспалительной реакции.
Минутный объём вентиляции (MV)
Этот параметр определяет удаление углекислоты из организма пациента. Величина минутного объёма вентиляции подбирается до достижения приемлемой PaCO2 и зависит от количества выделяемой углекислоты, величины альвеолярного мертвого пространства, шунта, состояния бронхиальной проходимости.
Частота дыхания (RR)
Находится в прямой связи с минутной вентиляцией и дыхательным объемом (MV = Vt * RR). При применении малых дыхательных объемов возможно увеличение частоты до 40 в мин. Однако следует учитывать, что регулировка минутного объема вентиляции частотой дыхания имеет свои ограничения, так как повышенная частота дыхания приводит к увеличению ауто-ПДКВ, увеличению вентиляции мертвого пространства, поэтому частота дыхания должна быть максимально уменьшена до достижения приемлемого РаСО2. Кроме того, в респираторах «старого парка», в которых независимая регулировка пиковой скорости инспираторного потока невозможна, при увеличении частоты дыхания увеличивается инспираторный поток и соответственно растет пиковое давление в дыхательных путях.
Скорость пикового инспираторного потока (PF), ускорение потока, время нарастания давления, профиль инспираторного потока
Средний устанавливаемый диапазон находится в пределах 40-80 л/мин. Пиковый инспираторный поток меньше 40 л/мин может быть установлен в режимах полностью управляемой вентиляции при нормальном сопротивлении в дыхательных путях. Пиковые потоки выше 80 л/мин устанавливаются при повышенном сопротивлении в дыхательных путях (например, при бронхообструкции) и значительных инспираторных усилиях пациента. При выборе скорости пикового инспираторного потока необходимо максимально его уменьшать для снижения пикового давления в дыхательных путях. При несоответствии установленной скорости пикового потока потребностям пациента при значительных инспираторных усилиях пациента на кривой «давление-время» возникает характерный провал – «потоковый голод», при возникновении которого необходимо увеличение установленной скорости инспираторного потока, так как нарушаются установленные параметры дыхательного цикла, что может приводить к коллабированию альвеол, ухудшению оксигенации и вентилятор-индуцированному повреждению легких. В современных респираторах также регулируется ускорение потока (или время нарастания давления до заданного) в режимах с устанавливаемым инспираторным давлением (pcCMV, BIPAP, PS), что в некоторых случаях позволяет приспособить параметры вентиляции к респираторным попыткам пациента.
Доказательных различий между профилями инспираторного потока нет, однако при нисходящей форме поток приближен к физиологическому, генерируются меньшие давления в дыхательных путях, быстрее достигается установленное инспираторное давление, улучшается распределение газа в негомогенной легочной ткани, так как разная скорость потока обеспечивает вентиляцию участков с разной постоянной времени. Однако современные респираторы способны моделировать дыхательный цикл таким образом, что все описанные выше преимущества могут быть получены при прямоугольной форме кривой потока.
Положительное давление конца выдоха (ПДКВ)
Подбор ПДКВ при ОПЛ/ОРДС вследствие тяжелого сепсиса осуществляется по общепринятым правилам, то есть исходя из концепции так называемого «оптимального ПДКВ», при котором достигается максимальная оксигенация и нет отрицательного влияния на гемодинамику.
Рисунок 3
Оптимальное ПДКВ с позиции транспорта кислорода.
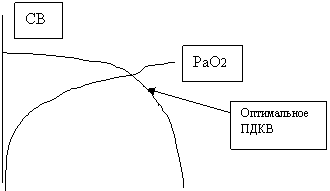

С точки зрения биомеханики дыхания цель ПДКВ – поддержание функциональной остаточной емкости выше объема закрытия (ФОЕ>ОЗ), то есть поддержание альвеол в расправленном состоянии (по методологии «Открытых легких» поддержание легких «открытыми»).
«Настройка» ПДКВ осуществляется согласно следующим принципам:
1. ПДКВ должно быть на 2 см вод. ст выше нижней точки перегиба на петле «давление-объем»;
2. При этом должен быть максимальный респираторный индекс;
3. Отсутствие угнетения гемодинамики (при наличии мониторинга центральной гемодинамики или косвенно при неинвазивной оценке гемодинамики).
При подборе ПДКВ при ОПЛ/ОРДС возможно как постепенное повышение ПДКВ с 5 см вод. ст до оптимального, так и постепенное снижение с 15 см вод. ст. до оптимального. Эмпирически доказано, что при ОПЛ/ОРДС цифры оптимального ПДКВ в большинстве случаев находятся в пределах 10-15 см вод. ст, поэтому использование ПДКВ менее 10 см вод. ст. нежелательно. Применение ПДКВ 10-15 см вод. ст. сочетании с вентиляцией малыми дыхательными объемами (6 мл/кг) приводит к умеренному повышению в плазме цитокинов, в отличие от сочетания низкого ПДКВ и дыхательного объема более 10 мл/кг, при котором значительно повышены концентрации цитокинов в плазме крови, поэтому применение такого сочетания при тяжелом сепсисе противопоказано.
Инспираторное время, инспираторная пауза, соотношение вдоха к выдоху, время нарастания давления
Регулировка этих временных параметров позволяет подстроить дыхательный цикл под биомеханические параметры пациента, то есть податливость легочной ткани, сопротивление дыхательных путей и постоянную времени (t), которая равна произведению величины податливости и сопротивления дыхательных путей и соответствует времени выражается в секундах. Теоретически доказано, что для достижения точки эластического равновесия респираторной системы в конце вдоха (то есть точки, в которой отсутствует положительное давление в альвеолах – ауто-ПДКВ) необходимо, чтобы время выдоха соответствовало трем постоянным времени.
Приблизительный расчет временных параметров возможен исходя из нижеприведенных формул:
Дыхательный цикл = время вдоха + время выдоха (1)
Время выдоха = 3* t (2)
ЧДД = 60 / (время вдоха+ 3* t) (3)
Инспираторное время в вентиляции с контролем по давлению (pcCMV, BIPAP) один из двух главных параметров дыхательного цикла, который определяет время, в течение которого поддерживается давление плато (инспираторное давление), соотношение вдоха к выдоху, дыхательный объем.
В вентиляции с контролем по объему (vcCMV) этот параметр может быть задан независимо, определяя соотношение вдоха к выдоху, продолжительность давления плато (инспираторной паузы), пиковый поток. При независимой регулировке скорости инспираторного потока и инспираторного времени в вентиляторах при изменении инспираторного времени изменяется время плато (инспираторной паузы). Алгоритмы установки временных параметров в разных вентиляторах реализованы по-разному. Во многих респираторах инспираторное время является производным параметром и прямая установка его невозможна.
Необходимо соблюдать неинвертированное соотношение вдоха к выдоху, то есть соотношение, меньше 1:1.2. Инверсное соотношение вдоха к выдоху применяется при условии сохраняющейся гипоксемии при условии оптимального ПДКВ, неудачных маневров рекрутирования альвеол и невозможности проведения вентиляции в положении лежа на животе или ее неэффективности.
Инспираторная пауза (плато) позволяет распределить газ между участками легких с разной постоянной времени. При ОРДС наиболее эффективно максимально быстрое достижение заданного давления плато и удержание его в течение всего времени вдоха, то есть использование инспираторной паузы приближенной к инспираторному времени. К режимам вентиляции легких, использующих этот принцип относятся все режимы с задаваемым давлением - pcCMV, BIPAP, PS, PPS, а также вентиляция с управляемым объемом и автоматической регулировкой скорости инспираторного потока (режим Autoflow).
В современных вентиляторах возможно регулировать время (скорость) нарастания давления до заданного в режимах с управляемым давлением. Скорость (время), с которой давление нарастает до заданного значения, определяется техническими характеристиками вентилятора, биомеханическими параметрами пациента и силой инспираторной попытки пациента. Это время нарастания давления обеспечивается разной скоростью потока, создаваемым вентилятором. Поэтому в некоторых вентиляторах устанавливается время нарастания давления, а в некоторых - ускорение потока. Чем меньше время нарастания (или выше значение ускорения потока), тем быстрее вентилятор достигнет установленного давления. Подбор этих параметров осуществляется индивидуально. При вентиляции с управляемым давлением необходимо быстрое достижение заданного давления. Но в режиме поддержки давлением несоответствующая усилию пациента скорость потока может вызывать увеличение работы дыхания, приводить к дискомфорту пациента и десинхронизации пациента с вентилятором. В исследованиях рассматриваются различные показатели комфорта пациента. При сильных инспираторных попытках пациента необходимо более быстрое нарастание давления и наоборот.
Однако не существует доказательств высокого уровня по рекомендациям подбора этих параметров.
Инспираторное давление (Pinsp)
В вентиляции с управляемым давлением (pcCMV, BIPAP) один из двух главных параметров дыхательного цикла, который определяет то давление, которое быстро достигается и остается неизменным на протяжении заданного инспираторного времени (Tinsp), таким образом в этих режимах вентиляция осуществляется на давлении плато, моделирование которого в режимах с управляемым объемом происходит при применении инспираторной паузы. Величина инспираторного давления и времени подбираются в соответствии с производными величинами - дыхательным объемом (см. выше) и соотношением вдоха к выдоху, при этом инспираторное давление не должно превышать 35 см вод. ст. В режиме поддержки давлением определяет давление, которое достигается при инспираторной попытке пациента. Инспираторное время в этом случае определяется пациентом, переключение со вдоха на выдох происходит при достижении фабрично-установленных критериев завершения (например, процента от пикового потока, предела времени вдоха) или попытке выдоха пациента.
При переходе с объемной вентиляции на вентиляцию с управляемым давлением необходимо придерживаться следующего алгоритма:
1. Установить инспираторное давление в соответствии с давлением плато в объемной вентиляции;
2. Установить инспираторное время для достижения необходимого соотношения вдоха к выдоху;
3. Мониторировать Vt;
4. Перенастроить инспираторное давление, если потребуется (недостаточный дыхательный объем, гиперкапния, гипоксемия);
5. Перенастроить инспираторное время, если потребуется изменение соотношения вдоха к выдоху.
При переходе с вентиляции в режиме CPAP+PS на вентиляцию с управляемым давлением необходимо придерживаться следующего алгоритма:
1. Установить инспираторное давление на уровне 12-15 см вод. ст. выше давления РЕЕР/СРАР;
2. Установить инспираторное время для достижения необходимого соотношения вдоха к выдоху;
3. Мониторировать Vt;
4. Перенастроить инспираторное давление, если потребуется (недостаточный дыхательный объем, гиперкапния, гипоксемия);
5. Перенастроить инспираторное время, если потребуется изменение соотношения вдоха к выдоху.
Ауто-ПДКВ
Явление, возникающее при неполном опорожнении альвеол на выдохе (например, при инверсном соотношении вдоха к выдоху), когда остаточный альвеолярный газ создает дополнительное к установочному ПДКВ положительное альвеолярное давление. В некоторых случаях позволяет дополнительно улучшить оксигенацию. Однако у ауто-ПДКВ преобладают отрицательные эффекты: угнетение гемодинамики, повышенный риск баротравмы, увеличение работы дыхания при вспомогательных режимах вентиляции. Отрицательные эффекты ауто-ПДКВ становятся наиболее выраженными при величине ауто-ПДКВ большей установочного ПДКВ. Поэтому использование ауто-ПДКВ в качестве терапевтического метода при ОРДС должно быть лимитировано выраженной гипоксемией при условии оптимального ПДКВ, неудачных маневров рекрутирования альвеол и невозможности проведения вентиляции в положении лежа на животе или ее неэффективности.
Инспираторная фракция кислорода (FiO2)
Необходимо использовать фракции кислорода менее 0.6. Использование инспираторных фракций кислорода более 0.6 приводит к токсическому действию на эпителий альвеол с нарушением синтеза сурфактанта и вентилятор-индуцированному повреждению легких.
Высокую инспираторную фракцию кислорода в дыхательной смеси (0.6 и более) следует использовать как временную меру при подборе параметров вентиляции легких и в случаях неэффективности всех возможных способов подержания оксигенации при РаО2 <60 мм рт. ст. и SaO2<93%.
Методы коррекции ОДН при тяжелом сепсисе с доказанным эффектом на летальность и вентилятор-индуцированное повреждение легких
1. Вентиляция малыми дыхательными объемами
Применение малых дыхательных объемов позволяет уменьшить проявления волюмотравмы и избежать высоких транспульмональных давлений. По данным крупнейшего мультицентрового рандомизированного контролируемого исследования, проведенного ARDSnet в 41 центре и включившего 861 пациента, использование малых дыхательных объемов (6 мл/кг массы тела) приводит к снижению летальности при ОПЛ/ОРДС на 8.8 % (снижение относительной летальности 22%). Это единственное исследование среди аналогов, в котором отмечались статистически достоверные разницы по величинам дыхательных объемов и давлениям плато среди групп с использованием доверительных интервалов, кроме того количество рандомизированных пациентов в этом исследовании значительно превышает сумму пациентов в других аналогичных исследованиях. Рекомендовано применение дыхательных объемов 6 мл/кг массы тела у пациентов с ОПЛ/ОРДС вследствие тяжелого сепсиса.
2. Применение оптимального ПДКВ
Оптимальное ПДКВ является одним из важнейших факторов защиты легких от вентилятор-индуцированного поражения легких (ателектатической травмы) и обеспечения оксигенации артериальной крови за счет поддержания альвеол «открытыми». Эмпирически доказано, что применение ПДКВ при ОПЛ/ОРДС менее 10 см вод. ст. приводит к увеличению летальности. Величины оптимального ПДКВ при ОПЛ/ОРДС преимущественно находятся в пределах 10-15 см вод. ст. Подбор ПДКВ осуществляется по петле «давление-объем» или кривой квазистатической податливости, при этом устанавливаемый ПДКВ должен быть на 2 см вод. ст. выше нижней точки перегиба на петле «давление-объем», при этом должен быть макисмальный респираторный индекс и минимальное угнетение гемодинамики.
3. Использование маневров рекрутирования альвеол
Маневр рекрутирования альвеол – терапевтический прием, направленный на расправление частично коллабированных (потенциально рекрутируемых, «нестабильных») альвеол. По данным многоцентровых рандомизированных контролируемых исследований с использованием компьютерной томографии рекрутирование альвеол позволяет значительно увеличить количество функционирующих альвеол, увеличить респираторный индекс и уменьшить фракцию шунта («открыть» легкие). Применение маневров рекрутирования осуществляется в ранней стадии ОРДС (до развития фибропролиферации), причем пациенты с «внелегочным» ОРДС лучше отвечают на маневр, чем пациенты с первичным поражением легких. Маневр рекрутирования может выполняться как в положении лежа на спине, так и в положении лежа на животе (более эффективно). Перед началом маневра пациенту вводят седативное вещество и миорелаксант и проводят анализ газового состава артериальной крови. Маневр осуществляется созданием постоянно положительного давления (CPAP, Pinsp) в 40 см вод. ст. на 30-40 секунд с последующим возвратом к установленным параметрам респираторной поддержки и подбором оптимального ПДКВ для предотвращения повторного коллабирования альвеол, которое составляет обычно в среднем 12-15 см вод. ст. В период выполнения маневра осуществляется мониторинг АД, ЧСС, SpO2. После маневра проводится повторный анализ газов артериальной крови. При отсутствии эффекта маневр можно повторить. Учитывая возможность «дерекрутирования» альвеол часто требуется повторное применении маневра через несколько часов.
4. Протективная вентиляция легких
Сочетание малых дыхательных объемов, маневров рекрутирования альвеол и оптимального ПДКВ за счет щадящего влияния на паренхиму легких получило название «протективной вентиляции легких». Эта методология приводит к уменьшению вентилятор-индуцированного повреждения легких при ОПЛ/ОРДС (баротравмы, волюмотравмы, ателектатической травмы и биотравмы), уменьшению транспульмонального давления и давления плато, отсутствию повышения цитокинов в плазме крови и снижению летальности при ОПЛ/ОРДС.
5. Вентиляция легких в положении лежа на животе
Вентиляция легких в положении лежа на животе приводит к вовлечению в газообмен нефункционирующих альвеол (рекрутированию), увеличению функциональной остаточной емкости легких, улучшению вентиляционно-перфузионных соотношений, уменьшению вентилятор-индуцированного повреждения легких и улучшению дренажной функции легких. По данным рандомизированных мультицентровых исследований выявлено значительное снижение летальности при применении вентиляции легких в положении лежа на животе при крайне тяжелом течении респираторного дистресс-синдрома, которое составило 24% в подгруппе с исходным респираторным индексом менее 88 мм рт. ст. и 30% в подгруппе с исходной оценкой по SAPS II более 49 баллов. Рекомендовано применение этого маневра всем пациентам, не имеющих противопоказаний к положению лежа на животе (скелетные вытяжения, лапаротомия). При крайне тяжелом течении дистресс-синдрома, «внелегочном» дистресс-синдроме применение вентиляции в положении лежа на животе является методом выбора.
Методы коррекции ОДН при тяжелом сепсисе
(с недоказанным эффектом на летальность)
1. Высокочастотная вентиляция легких
По методологии высокочастотная вентиляция легких является разновидностью протективной вентиляции легких, так как используются сверхмалые дыхательные объемы, создается высокое ауто-ПДКВ, практически не происходит повышения цитокинов в плазме крови. Однако отсутствуют доказательные исследования по применению ВЧ ИВЛ у пациентов с ОПЛ/ОРДС, поэтому оценка эффективности и безопасности ВЧ ИВЛ при ОПЛ/ОРДС оценивается врачами в каждом конкретном случае. Рекомендации по применению методики у пациентов с ОПЛ/ОРДС отсутствуют.
2. Вентиляция легких с инверсным соотношением вдоха к выдоху и допустимая гиперкапния
Вентиляция легких с инверсным соотношением вдоха к выдоху приводит к уменьшению шунта и улучшению оксигенации артериальной крови у пациентов с ОПЛ/ОРДС преимущественно за счет создания высоких ауто-ПДКВ. В исследованиях не получено различий при применении оптимального установочного ПДКВ и неинвертированного соотношения вдоха к выдоху по сравнению с ауто-ПДКВ и инверсным соотношением вдоха к выдоху. Но инверсное соотношение вдоха к выдоху менее комфортно для пациента, требует глубокой седации и миоплегии с риском возникающих при этом осложнений, а ауто-ПДКВ в большей степени угнетает гемодинамику, чем внешнее ПДКВ. Возникающая при таких режимах вентиляции допустимая гиперкапния может приводить к неблагоприятным неврологическим последствиям. Положительные эффекты допустимой гиперкапнии при ИВЛ изучены недостаточно, хотя некоторые авторы считают, что сама гиперкапния является защитным фактором при ОПЛ/ОРДС, приводя к уменьшению выработки цитокинов легкими. Учитывая угнетение гемодинамики и ухудшение распределения вентиляция/перфузия при глубокой седации вентиляция с инверсным соотношением вдоха к выдоху не может быть рекомендована как терапия выбора при ОПЛ/ОРДС при тяжелом сепсисе. Вопрос о применении допустимой гиперкапнии должен решаться индивидуально. Показания к применению этой методики должны быть строго ограничены, по возможности необходимо уменьшать сроки гиперкапнии, необходимо осуществлять тщательное мониторирование неврологического статуса и проводить глубокую медикаментозную седацию. Абсолютными противопоказаниями являются острый период тяжелой черепно-мозговой травмы, декомпенсированное заболевание головного мозга с развитием отека головного мозга (инфаркт мозга, кровоизлияние в мозг, опухоль мозга, эписиндром).
3. Ингаляционное применение оксида азота (II)
Рандомизированные мультицентровые контролируемые исследования по применению ингаляционного оксида азота (II) у пациентов с ОПЛ/ОРДС показали улучшение оксигенации во всех группах пациентов и улучшение выживаемости в некоторых группах пациентов (инспираторная фракция NO 5 ppm). Однако в этих исследованиях число пациентов, у которых сепсис являлся причиной повреждения легких, было невелико. Ингаляционная терапия оксидом азота (II) может быть рекомендована как терапия резерва у пациентов с тяжелым сепсисом.
4. Экстракорпоральная мембранная оксигенация
В ряде неконтролируемых исследований получены данные об улучшении оксигенации и выживаемости среди пациентов с крайне тяжелым течением острого респираторного дистресс-синдрома (средняя оценка по шкале Murray более 3 баллов и средним респираторным индексом менее 70 мм рт. ст.) Контролируемые исследования по применению этой методики не проводились. Экстракорпоральная мембранная оксигенация может быть рекомендована как терапия резерва у пациентов с крайне тяжелым течением ОРДС.
Неэффективные методы коррекции ОДН при тяжелом сепсисе
1. Неинвазивная вентиляция легких
Неинвазивная вентиляция легких показала полную неэффективность среди пациентов с тяжелым сепсисом. Во всех исследованиях пациенты с тяжелым сепсисом были интубированы. Одной из главных причин неудач неинвазивной вентиляции является развитие септической энцефалопатии, требующее проведения продленной глубокой медикаментозной седации, при которой применение неинвазивной вентиляции невозможно. Неинвазивная вентиляция не может быть рекомендована у пациентов с тяжелым сепсисом.
Повреждающие факторы при ИВЛ
Доказанными к настоящему времени факторами повреждения легких («факторы агрессии ИВЛ») являются:
1. Давление плато более 35 см вод. ст.;
2. Дыхательный объем более 10 мл/кг;
3. Инспираторная фракция кислорода более 0.6;
4. Инвертированное соотношение вдоха к выдоху.
5. Неадекватное ПДКВ.
Критерии адекватности ИВЛ
1. PaO2 более 60 мм рт. ст, SaO2 более 93%
2. PvO2 35-45 мм рт. ст, SvO2 более 55%
Критерии начала респираторной поддержки при тяжелом сепсисе
Абсолютные:
1. Отсутствие самостоятельного дыхания и патологические ритмы дыхания
2. Нарушение проходимости верхних дыхательных путей
3. Снижение респираторного индекса менее 200 мм рт. ст.
4. Септический шок
5. Нарушения гемодинамики (жизнеопасные нарушения ритма, стойкая тахикардия более 120 в мин, гипотензия)
Относительные (комбинация 2 и более факторов является показанием к началу респираторной поддержки)
6. Снижение респираторного индекса менее 300 мм рт. ст. при комбинации с другими критериями
7. Развитие септической энцефалопатии и отека головного мозга с угнетением сознания и нарушением ФВД
8. Гиперкапния или гипокапния (paCO2 менее 25 мм. рт. ст.)
9. Тахипноэ более 40 в мин (или 24 при обострении хронического обструктивного заболеваниях легкого) и прогрессирующее увеличение минутного объема вентиляции
10. Снижение ЖЕЛ менее 10 мл/кг массы тела
11. Снижение податливости менее 60 мл/см вод. ст.
12. Увеличение сопротивления дыхательных путей более 15 см вод. ст./л/с.
13. Усталость пациента, вовлечение вспомогательных дыхательных мышц
Критерии начала отмены респираторной поддержки
Начало снижения параметров респираторной поддержки возможно при регрессе патологического процесса в легких (ОПЛ/ОРДС, пневмонии) и устранения септического очага, поддерживающего системную воспалительную реакцию.
Критерии начала снижения респираторной поддержки:
· Ясное сознание, отсутствие неврологических признаков отека головного мозга (например, можно отучать больных в вегетативном состоянии) и патологических ритмов дыхания
· Респираторный индекс более 300 мм рт. ст
· Положительная динамика инфильтратов на рентгенограмме грудной клетки
· Стабильность гемодинамики и отсутствие жизнеопасных нарушений ритма при скорости введения дофамина (добутамина) менее 5 мкг/кг/мин, мезатона в любых дозировках
· Увеличивающаяся в динамике статистическая податливость
· Сопротивление дыхательных путей менее 10 см вод. ст./л/с
· Отсутствие нарушений кислотно-основного состояния
· Индекс Тобина (f/Vt) менее 105
· Лихорадка <38 град С
· Отсутствие выраженных проявлений ДВС-синдрома (клинически значимой кровоточивости или гиперкоагуляции)
При этом снижение респираторной поддержки производится поэтапно, на каждом этапе должны быть :
1 этап. Уменьшение инспираторной фракции кислорода (FiO2 меньше 0.4)
2 этап. Постепенное уменьшение аппаратных вдохов до нуля (если они были заданы) с установкой давления поддержки равным давлению плато аппаратного вдоха
3 этап. Постепенное снижение уровня инспираторного давления под контролем индекса Тобина (f/Vt должен быть меньше 105) до 4 см вод. ст. (при наличии эндотрахеальной трубки) или до нуля (при трахеостомической трубке).
4 этап. Постепенное снижение PEEP/CPAP по 1-2 см вод. ст. до нулевого уровня
Перевод пациента на полностью самостоятельное дыхание возможен при достижении минимального уровня респираторной поддержки (FiO2 менее 0.3, ПДКВ менее 5 см вод. ст., инспираторное давление менее 4 см вод. ст. от уровня ПДКВ, индекс Тобина менее 105) и достижении критериев адекватности вентиляции легких.
Основные причины неудач при отлучении от респиратора:
1. Продолжающийся респираторный дистресс-синдром (например, выраженная фибропролиферативная стадия ОРДС)
2. Неврологические причины (патологические ритмы дыхания, полинейропатия)
3. Нарушение питания пациента (истощение белковых и энергетических резервов)
4. Атрофия дыхательных мышц.
Протокол респираторной поддержки при тяжелом сепсисе
Таким образом, методы коррекции ОДН при тяжелом сепсисе могут быть разделены на высокоэффективные, приводящие к снижению летальности и уменьшению вентилятор-индуцированного повреждения легких – терапия выбора (доказательства категории А и В) и дополнительные, положительное влияние на летальность которых имеет невысокую категорию доказательности – терапия резерва.
Терапия выбора:
1. Применение дыхательного объема менее 10 мл/кг массы тела (рекомендуется 6 мл/кг)
2. Оптимальное ПДКВ (выше 10 см вод. ст.)
3. Предпочтительно применение вспомогательных режимов респираторной поддержки
4. Применение маневров открытия альвеол
5. При отсутствии эффекта от изложенного в пп.1-4 применение вентиляции в положении лежа на животе
Терапия резерва:
6. При отсутствии эффекта от изложенного в пп.1-5 применение инверсного соотношения вдоха к выдоху.
7. При отсутствии эффекта от изложенного в пп.1-6 ингаляционное введение NO в дозе 5 ppm
8. При снижении респираторного индекса менее 70 мм рт. ст. и отсутствии эффекта от изложенного в пп.1-6 применение экстракорпоральной мембранной оксигенации
Литература:
1. , , и др. Нарушения фибринолитической функции легких при респираторном дистресс-синдроме у больных перитонитом // Анест. и реаниматол. – 1991 - №5. - с.9-12.
2. , , и др. Содержание в крови и агрегация тромбоцитов при респираторном дистресс-синдроме взрослых // Анест. и реаниматол. – 1990 - №4. - с.8-11.
3. В кн.: Хирургические инфекции, под редакцией , , СПб, 2003, стр. 371-372)
4. , , и др. Изменение метаболической функции легких и содержание биологически активных веществ в крови больных респираторным дистресс-синдромом // Анест. и реаниматол. – 1992 - №1. - с.20-22.
5. , , Лапшина длительной искусственной вентиляции легких («отлучение» от аппарата ИВЛ). Функциональные критерии и методические принципы// Анест. и реаниматол. – 1995 - №6.
6. , , Лескин и вспомогательная вентиляция легких. - М.: Медицина, 200с.
7. , Золотокрылина респираторный дистресс-синдром.- М.: Медицина, 200с.
8. Abraham E, Baughman R, Fletcher E, et al. Liposomal prostaglandin E1 (TLC C-53) in acute respiratory distress syndrome: a controlled, randomized, double-blind, multicenter clinical trial. Crit Care Med 1999;27:.
9. Abraham E, Matthay MA, Dinarello CA, et al. Consensus conference definitions for sepsis, septic shock, acute lung injury, and acute respiratory distress syndrome: time for a reevaluation. Crit Care Med 2000;28:232-235.
10. Amato et al. Beneficial effects of the “open lung approach” with low distending pressures in ARDS. A prospective randomized trial on mechanical ventilation. Am J Respir Crit Care Med 1995;152:1835-46.
11. Amato MBP, Barbas CSV, Medeiros DM, et al. Effect of a protective-ventilation strategy on mortality in the acute respiratory distress syndrome. N Engl J Med 1998;338:347-354.
12. Antonelli M et al. A comparision of non-invasive positive-pressure ventilation and conventional mechanical ventilation in patients with acute respiratory failure. N Engl J Med 339:429-35, 1998.

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 |



