Цефотаксим
Цефтриаксон
Имипенем
Меропенем
Фторхинолон1
Цефепим
K. pneumoniae
P. vulgaris,
Имипенем
Меропенем
Амикацин
Цефепим Цефоперазон/сульбактам
Цефотаксим
Цефтриаксон
Ципрофлоксацин
Enterobacter spp., Citrobacter spp.,
Serratia spp.
Имипенем
Меропенем
Цефепим
Амикацин
Цефотаксим
Цефтриаксон Ципрофлоксацин
Acinetobacter spp.
Имипенем
Меропенем
Цефоперазон/сульбактам
Ампициллин/сульбактам
Цефтазидим + амикацин
Ципрофлоксацин + амикацин
P.aeruginosa
Меропенем
Цефтазидим +/- амикацин
Цефепим +/- амикацин
Имипенем
Цефоперазон/сульбактам +/- амикацин
Ципрофлоксацин +/- амикацин
Burkholderia cepacia
Меропенем
Ципрофлоксацин
Цефтазидим
Цефоперазон
Ко-тримоксазол
Stenotrophomonas maltophilia
Ко-тримоксазол
Тикарциллин/клавуланат Доксициклин
Candida spp.
Флуконазол
Амфотерицин В
Каспофунгин
Обозначения: ОЧ – оксациллиночувствительные штаммы; ОР – оксациллинорезистентные штаммы
1 левофлоксацин, моксифлоксацин, офлоксацин, пефлоксацин, ципрофлоксацин
При пневмококковом сепсисе в качестве препаратов начальной терапии следует рассматривать цефалоспорины III поколения, учитывая возрастающую частоту штаммов S.pneumoniae, со сниженной чувствительностью к бензилпенициллину. В последние годы регистрируются также штаммы S.pneumoniae, устойчивые к цефалоспоринам III –IV поколений и, крайне редко, к карбапенемам, поэтому при планировании антибиотикотерапии следует резервировать ванкомицин, к которому резистентности не отмечено.
Среди грамотрицательных бактерий в этиологии внутрибольничного сепсиса преобладают энтеробактерии (Enterobacteriaceae). Наибольшие проблемы возникают при выделении штаммов энтеробактерий, характеризующихся множественной резистентностью, причем частота таких штаммов в стационаре в последние годы существенно увеличилась.
Основным механизмом резистентности Klebsiella pneumoniae (реже E.coli) к бета-лактамам является продукция бета-лактамаз расширенного спектра (БЛРС), гидролизующих незащищенные пенициллины, цефалоспорины I-III поколения и частично IV поколения. Клинически важным является документированный факт снижения клинической эффективности цефалоспоринов I, II и III поколений, а также фторхинолонов и аминогликозидов при выделении штаммов-продуцентов БЛРС. Наиболее надежным режимом терапии сепсиса, вызванного Klebsiella spp., в настоящее время следует признать назначение карбапенемов на раннем этапе лечения. При нетяжелой инфекции в качестве альтернативы возможно назначение цефепима, показавшего хорошую эффективность при инфекциях, вызванных БЛРС-продуцентами.
Другим важным механизмом резистентности грамотрицательных бактерий является индуцибельная гиперпродукция хромосомных бета-лактамаз класса С, гидролизующие защищенные пенициллины и цефалоспорины I-III поколения. Данный механизм резистентности характерен для Enterobacter spp., Citrobacter freundii, Serratia marcescens, P.vulgaris, P.rettgeri. В отношении этих микроорганизмов сохраняют надежную активность цефепим и карбапенемы.
Большие сложности возникают при проведении антибактериальной терапии сепсиса, вызванного неферментирующими микроорганизмами – Acinetobacter spp., Pseudomonas spp. Оба характеризуются множественными механизмами резистентности к антибактериальным средствам разных классов и быстрым формированием устойчивости в процессе терапии. Наиболее надежными препаратами в случае выделения Acinetobacter spp. являются карбапенемы и цефоперазон/сульбактам. Чувствительность этого микроорганизма к цефепиму и ципрофлоксацину плохо прогнозируема, к другим бета-лактамным антибиотикам обычно наблюдается устойчивость.
Общепринятым стартовым режимом терапии псевдомонадной инфекции является цефтазидим в сочетании с амикацином. Данные рекомендации основаны на сохранение достаточного уровня чувствительности P.aeruginosa к цефтазидиму (70-90%) в большинстве медицинских учреждений. Наименьший уровень устойчивости P.aeruginosa в стационарах различных регионов нашей страны отмечается к меропенему и цефепиму (чувствительны более 90% штаммов), которые следует рассматривать в качестве альтернативных средств, а при тяжелом сепсисе с ПОН – в качестве средств 1-го ряда. В то же время настораживают отдельные сообщения о возрастании в последние 2-3 года резистентности P.aeruginosa к имипинему, ципрофлоксацину, ингибитор-защищенным бета-лактамам.
Анаэробные микроорганизмы имеют клиническое значение не при всех формах сепсиса, а главным образом при локализации первичного очага в брюшной полости (преимущественно грамотрицательные – Bacteroides spp.) или мягких тканях (Clostridium spp. и другие). В этих случаях оправдано назначение режимов антибактериальной терапии с антианаэробной активностью. Некоторые антибиотики широкого спектра проявляют высокую активность в отношении анаэробных микроорганизмов (защищенные бета-лактамы, карбапенемы) и могут применяться в режиме монотерапии. Цефалоспорины, аминогликозиды и фторхинолоны (кроме моксифлоксацина) клинически значимой активностью против анаэробов не обладают, поэтому должны сочетаться с антианаэробными препаратами – метронидазолом или линкозамидами (клиндамицин, линкомицин). В последние годы клиническое значение линкозамидов как антианаэробных антибиотиков снижается из-за широкого распространения устойчивости Bacteroides spp. Клиндамицин сохраняет значение в схемах терапии инфекций мягких тканей (особенно некротизирующие инфекции), при которых существенна роль клостридиальной флоры (сохраняется хорошая чувствительность к клиндамицину который также подавляет продукцию бактериями токсинов), а также остеомиелита с учетом хорошего проникновения препарата в костную ткань. В остальных случаях при смешанных инфекциях в качестве антианаэробного препарата предпочтительнее использовать метронидазол.
Грибковый сепсис относится к наиболее тяжелым формам заболевания с высоким уровнем летальности (50% и выше). Под грибковым сепсисом обычно подразумевается кандидемия и острый диссеминированный кандидоз. Кандидемией называется однократное выделение Candida spp. при посеве крови, полученной в период подъема температуры тела > 380C или при наличии других признаков системной воспалительной реакции. Под острым диссеминированным кандидозом понимается сочетание кандидемии с культуральными или гистологическими признаками поражения глубоких тканей или выделение Candida spp. из двух и более стерильных в норме локусов.
К сожалению, возможности адекватной терапии грибкового сепсиса ограничены в настоящее время тремя препаратами – амфотерицином В, флуконазолом и каспофунгином. Для практических целей важно иметь представление о родовой принадлежности кандид, так как некоторые из них (C. glabrata, C. krusei) могут быть резистентны к азолам (флуконазол), однако остаются чувствительными к амфотерицину В и каспофунгину. Амфотерицин В может применяться в виде оригинального препарата или его липосомальной формы. Последний препарат обладает существенно более низкой токсичностью по сравнению с оригинальным препаратом. Каспофунгин является новым препаратом, обладающим высокой активностью в отношении возбудителей острого диссеминированного кандидоза.
Применение антибактериальной терапии не означает необходимости одновременного назначения противогрибковых препаратов с целью профилактики инфекции вызванной грибами (категория доказательности C). Применение антимикотиков для первичной профилактики инвазивного кандидоза рекомендуется только для пациентов с высоким риском возникновения этого осложнения, в частности у хирургических пациентов с повторной перфорацией кишечника.
Активность азолов равна активности амфотерицина В (категория доказательности A). При этом необходимо учитывать наличие резистентности к азолам у C. krusei (природная) и у C. glabrata (приобретенная). У пациентов, которые получали продолжительные повторные курсы антигрибковой терапии, были выделены C. albicans, резистентные к азолам. Имеются данные о целесообразности назначения амфотерицина В в режиме стартовой терапии у пациентов с нестабильными гемодинамическими показателями (категория доказательности С). Комбинированное применение азолов и амфотерицина В не улучшило результатов лечения инвазивного кандидоза (категория доказательности B).
Рекомендованные дозы антибактериальных средств при лечении сепсиса указаны в таблице 5.
Таблица 5
Дозы внутривенных антибиотиков для эмпирической терапии сепсиса
Пенициллины
Бензилпенициллин
Ампициллин
Оксациллин
1-2 млн ЕД 6 раз в сутки (стрептококковые инфекции); 4 млн ЕД 6-8 раз в сутки (газовая гангрена, менингит)
2 г 4-6 раз в сутки
2 г 4-6 раз в сутки
Цефалоспорины I-III поколения без антисинегнойной активности
Цефазолин
Цефотаксим
Цефтриаксон
Цефуроксим
2 г 2-3 раза в сутки
2 г 3-4 раза в сутки1
2 г 1 раз в сутки1
1,5 г 3 раза в сутки
Цефалоспорины III-IV поколения с антисинегнойной активностью
Цефепим
Цефтазидим
Цефоперазон
2 г 2 раза в сутки
2 г 3 раза в сутки
2-3 г 3 раза в сутки
Карбапенемы
Имипенем
Меропенем
Эртапенем
0,5 г 4 раза в сутки или 1 г 3 раза в сутки
0,5 г 4 раза в сутки или 1 г 3 раза в сутки
1 г 1 раз в сутки
Комбинации β-лактамов с ингибиторами β-лактамаз
Амоксициллин/клавуланат
1,2 г 3-4 раза в сутки
Ампициллин/сульбактам
1,5 г 3-4 раза в сутки
Тикарциллин/клавуланат
3,2 г 3-4 раза в сутки
Цефоперазон/сульбактам
4 г 2 раза в сутки
Аминогликозиды
Амикацин
Гентамицин
Нетилмицин
15 мг/кг в сутки2
5 мг/кг в сутки2
4-6 мг/кг в сутки2
Фторхинолоны
Левофлоксацин
Моксифлоксацин
Офлоксацин
Пефлоксацин
Ципрофлоксацин
мг 1 раз в сутки
400 мг 1 раз в сутки
400 мг 2 раза в сутки
400 мг 2 раза в сутки
400-600 мг 2 раза в сутки
Препараты с антистафилококковой активностью
Ванкомицин
Линезолид
Рифампицин
Фузидиевая кислота
1 г 2 раза в сутки
600 мг 2 раза в сутки
300-450 мг 2 раза в сутки
500 мг 4 раза в сутки
Препараты с антианаэробной активностью
Клиндамицин
Линкомицин
Метронидазол
600-900 мг 3 раза в сутки
600 мг 3 раза в сутки
500 мг 3-4 раза в сутки
Препараты с противогрибковой активностью
Флуконазол
Амфотерицин В
Амфотерицин В липосомальный
Каспофунгин
6-12 мг/кг/сутки - внутривенная инфузия со скоростью не более 10 мл/мин
0,6-1,0 мг/кг/сутки - внутривенная инфузия в 400 мл 5% раствора глюкозы со скоростью 0,2-0,4 мг/кг/час
3 мг/кг 1 раз в сутки
В первый день – 70 мг 1 раз в сутки, затем – по 50 мг 1 раз в сутки
1 При инфекциях ЦНС суточную дозу следует увеличить в два раза
2 Суточная доза может вводиться в одно или 2-3 введения
Путь введения антимикробных средств
При сепсисе предпочтительным является внутривенное введение антибактериальных средств. Убедительных данных в пользу внутриартериального или эндолимфатического введения антибиотиков не имеется.
Комбинированное применение антибактериальных препаратов
Убедительных данных в пользу рутинного назначения комбинаций антибактериальных препаратов не получено. В последнем опубликованном мета-анализе приводятся данные, что при сепсисе комбинация бета-лактамов с аминогликозидами не имеет преимуществ по сравнению с монотерапией бета-лактамами как в плане клинической эффективности так и развития резистентности. Одинаковая клиническая эффективность монотерапии и комбинированной терапии показана для сепсиса, вызванного Enterobacteriaceae и P.aeruginosa.
Продолжительность антибактериальной терапии
Антибактериальная терапия сепсиса проводится до достижения стойкой положительной динамики состояния пациента и исчезновения основных симптомов инфекции. В связи с отсутствием патогномоничных признаков бактериальной инфекции, абсолютные критерии прекращения антибактериальной терапии установить сложно. Обычно вопрос о прекращении антибиотикотерапии решается индивидуально на основании комплексной оценки динамики состояния пациента. В общем виде критерии достаточности антибактериальной терапии сепсиса могут быть представлены следующим образом:
· положительная динамика основных симптомов инфекции;
· отсутствие признаков системной воспалительной реакции;
· нормализация функции желудочно-кишечного тракта;
· нормализация количества лейкоцитов в крови и лейкоцитарной формулы.
· отрицательная гемокультура.
Сохранение только одного признака бактериальной инфекции (лихорадка или лейкоцитоз) не является абсолютным показанием для продолжения антибактериальной терапии. Изолированная субфебрильная лихорадка (максимальная дневная температура в пределах 37,9°С) без ознобов и изменений в периферической крови может быть проявлением постинфекционной астении или небактериального воспаления после оперативного вмешательства и не требует продолжения антибактериальной терапии. Так же как и сохранение умеренного лейкоцитоза (9-12 х 109/л) при отсутствии сдвига влево и других признаков бактериальной инфекции.
Обычные сроки антибактериальной терапии хирургических инфекций различной локализации (кожи и мягких тканей, перитонит, НПивл) составляют от 5 до 10 дней. Более длительная антибиотикотерапия не желательна из-за развития возможных осложнений лечения, риска селекции резистентных штаммов и развития суперинфекции. В недавно опубликованных результатах контролируемого двойного-слепого исследования показана одинаковая клиническая и бактериологическая эффективность 8 и 15 дневной терапии НПивл, при этом риск селекции резистентных штаммов был выше при более длительном курсе лечения.
При отсутствии стойкого клинико-лабораторного ответа на адекватную антибактериальную терапию в течение 5-7 дней, необходимо проведение дополнительного обследования (УЗИ, КТ и др.) для выявления осложнений или очага инфекции другой локализации.
В определенных клинических ситуациях требуются более длительные режимы антибактериальной терапии. Обычно это рекомендуется для инфекций, локализующихся в органах и тканях, в которых терапевтические концентрации антибиотиков трудно достижимы, следовательно, имеется более высокий риск персистирования возбудителей и рецидивов инфекции. Это относится, прежде всего, к остеомиелиту, инфекционному эндокардиту, вторичному гнойному менингиту. Кроме того, при инфекциях, вызванных S. aureus, обычно также рекомендуют более длительные курсы антибактериальной терапии – 2-3 недели. Разработанные рекомендации по антибактериальной терапии сепсиса относятся к наиболее характерным и часто встречающимся в хирургической практике внебольничным и нозокомиальным бактериальным инфекциям. Вместе с тем некоторые сложные клинические ситуации не рассматриваются в настоящих рекомендациях, так как с трудом поддаются стандартизации. В этом случае вопрос о тактике лечения следует решать совместно со специалистом по антимикробной химиотерапии.

4. РЕСПИРАТОРНАЯ ТЕРАПИЯ ПРИ ТЯЖЕЛОМ СЕПСИСЕ
Список сокращений:
ALI – острое (паренхиматозное) повреждение легких
ARDS – острый респираторный дистресс-синдром
BIPAP – вентиляция с двухфазным положительным давлением в дыхательных путях, вариант вентиляции с управляемым давлением
С – растяжимость
CMV – принудительная вентиляция
СPAP – постоянное положительное давление в дыхательных путях
E – эластичность (величина, обратная податливости)
FiO2 – инспираторная фракция кислорода
I/E – соотношение вдоха к выдоху
МАР – среднее давление в дыхательных путях
PaCO2 – парциальное давление углекислоты в артериальной крови
PaO2 – парциальное давление кислорода в артериальной крови
Paw – давление, создаваемое вентилятором
PAV (PPS)– пропорциональная вспомогательная вентиляция
pcCMV (PCV)– принудительная вентиляция с управляемым давлением
PC-IRV – принудительная вентиляция с управляемым давлением и инверсным соотношением вдоха к выдоху
РЕЕР – положительное давление конца выдоха
PF – пиковый поток
Pinsp – инспираторное давление
PIP – пиковое давление в дыхательных путях
Pplateau – давление инспираторной паузы (давление плато)
PPS (PAV) – пропорциональная поддержка давлением, пропорциональная вспомогательная вентиляция
PS – режим поддержки давлением
R – сопротивление дыхательных путей
RAMP – скорость нарастания потока при вспомогательной вентиляции
RR – частота дыхания
SaO2 – насыщение гемоглобина кислородом в артериальной крови
SIMV – синхронизированная перемежающаяся принудительная вентиляция
Tinsp – инспираторное время
V – объем
V’ – поток
vcCMV – принудительная вентиляция с управляемым объемом
МV – минутный объем вентиляции
Vt – дыхательный объем
ЖЕЛ – жизненная емкость легких
ОДН – острая дыхательная недостаточность
ОЗ – объем закрытия
ОПЛ – острое паренхиматозное повреждение легких
ОРДС –острый респираторный дистресс-синдром
ПДКВ – положительное давление в конце выдоха
ФОЕ – функциональная остаточная емкость
ЭЗДП – экспираторное закрытие дыхательных путей
t - постоянная времени (C*R)
Определения и эпидемиология
Синдром системной воспалительной реакции при сепсисе приводит к неспецифическому поражению паренхимы легких и проявляется развитием острого повреждения легких (ОПЛ) или острого респираторного дистресс-синдрома (ОРДС). По принятому в 1994 году на Европейско-Американской согласительной конференции определению ОПЛ/ОРДС представляют собой повреждение лёгких полиэтиологического характера и характеризуются:
· острым началом,
· прогрессирующей артериальной гипоксемией,
· двусторонней инфильтрацией лёгочных полей на рентгенограмме органов грудной клетки,
· прогрессирующим снижением податливости лёгочной ткани при отсутствии признаков острой левожелудочковой сердечной недостаточности – кардиогенного отека легких (ДЗЛК £ 18 мм. рт. ст.).
При этом снижение респираторного индекса (PaO2/FiO2) менее 300 мм рт. ст. соответствует острому повреждению легких, а его снижение менее 200 мм рт. ст. – острому респираторному дистресс-синдрому. Важно отметить негомогенность поражения легочной ткани при этих состояниях – пораженные альвеолы находятся рядом с интактными.
Для объективной оценки степени тяжести повреждения легких и стратификации пациентов с ОПЛ/ОРДС целесообразно использовать шкалу, предложенную J. Murray (1988).
Таблица 1
Шкала оценки тяжести повреждения легких. (J. Murray)
1. Рентгенография грудной клетки
Баллы
3. Респираторный индекс (PaO2/FiO2), мм рт. ст.
Баллы
Нет инфильтрации
0
≥ 300
0
Инфильтрация в одном квадранте
1
225-299
1
Инфильтрация в двух квадрантах
2
175-224
2
Инфильтрация в трех квадрантах
3
100-174
3
Инфильтрация в четырех квадрантах
4
<100
4
2. Податливость респираторной системы, мл/см вод. ст.
Баллы
4. ПДКВ, см вод. ст.
Баллы
>80
0
≤5
0
60-79
1
6-8
1
40-59
2
9-11
2
20-39
3
12-14
3
≤19
4
≥15
4
Для оценки тяжести повреждения легких сумму баллов по шкале делят на 4. Оценка в нуль баллов – отсутствие признаков повреждения легких, 0.1-2.5 – поражение легких средней степени тяжести, более 2.5 баллов соответствует тяжелому течению ОРДС.
Клинико-лабораторные признаки паренхиматозной дыхательной недостаточности выявляют более, чем у 50% больных с сепсисом, а при тяжелом сепсисе эта статистика близка к 100 %.
В зависимости от этиологии ОРДС подразделяют на «легочный» дистресс-синдром (к которому относится ОРДС вследствие первичного поражения легких, например, при ушибе легких, аспирации, утоплении, пневмонии, поражении легких токсинами, в том числе высокими концентрациями кислорода) и «внелегочный» ОРДС (поражение легких при тяжелом сепсисе, политравме, операций с искусственным кровообращением, массивной кровопотере, панкреатите, ДВС-синдроме, черепно-мозговой травме, ожоговой болезни, некоторых инфекционных заболеваниях, эмболиях малого круга кровообращения, иммунологических реакциях). Это имеет большое практическое значение, так как эти варианты отличаются течением воспалительного процесса. При «легочной» этиологиии ОРДС преобладает гомогенное поражение легочной ткани, вовлеченные в воспалительный процесс альвеолы заполнены экссудатом и вследствие этого потенциальная способность к открытию этих альвеол минимальна. При внелегочном дистресс-синдроме в воспалительный процесс вовлечена вся легочная ткань, но поражение легких негомогенно – коллабированные альвеолы находятся рядом с вентилируемыми и нестабильными, причем количество нестабильных (потенциально рекрутируемых альвеол) велико, вследствие этого может быть получен хороший эффект от методов респираторной терапии, направленных на открытие нестабильных альвеол и поддержание их в открытом состоянии. Таким образом, эффективность некоторых приемов современной респираторной терапии при ОРДС вследствие непрямого поражения может не соответствовать эффективности тех же маневров при прямом повреждении легких. Однако, у пациентов с тяжелым сепсисом может наблюдаться сочетание этиологических факторов в различных комбинациях. Например, тяжелая политравма с ушибом легких и тяжелым сепсисом, аспирационная пневмония и сепсис, или внебольничная пневмония и сепсис. То есть, этиология ОРДС при сепсисе часто носит смешанный характер.
Легочная и системная воспалительная реакции
Как известно, развивающийся при сепсисе ССВР характеризуется выбросом большого количества медиаторов воспаления и активацией нейтрофилов и макрофагов, вызывающих отек и повреждение эндотелия, «капиллярную протечку», нарушения коагуляции и фибринолиза с микротромбированием сосудов и формированием органной дисфункции.
При ССВР первой мишенью является паренхима легких, что приводит к нарушению вентиляционно-перфузионых соотношений в легких, воспалительному процессу в легочной ткани, нарушению синтеза сурфактанта, коллабированию альвеол и нарушению газообмена.
Однако легкие при ОРДС участвуют в выработке цитокинов и выделяют эти вещества в системный кровоток, приводя к усилению ССВР и прогрессированию ПОН. Доказано выделение паренхимой легких в кровоток фактора некроза опухоли, интерлейкина-1, интерлейкина-6, интерлейкина-10, гамма-интерферона, простагландинов, лейкотриенов, кининов, каскада комплемента, лактата и других биологически активных веществ, усиливающих системную воспалительную реакцию, активации нейтрофилов, выделения ими протеолитических ферментов и свободных радикалов с системным повреждением эндотелия. Таким образом, кроме системной воспалительной реакции при сепсисе возникает и локальная органная воспалительная реакция, усиливающая системную. В случае острого повреждения легких и острого респираторного дистресс-синдрома эта локальная воспалительная реакция носит название легочной воспалительной реакции.
Рисунок 1
Механизмы повреждения паренхимы легких при ОРДС
(объяснения в тексте).
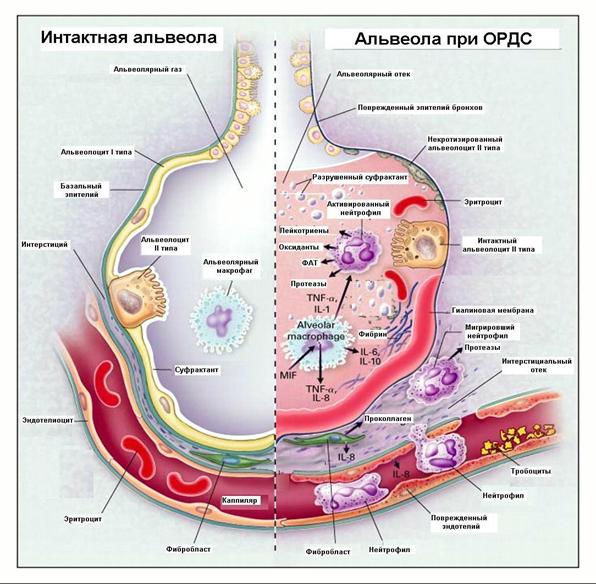
Применяемая при ОПЛ и ОРДС респираторная поддержка может приводить к усилению легочной воспалительной реакции (вентилятор-индуцированному повреждению легких) за счет баротравмы, волюмотравмы, ателектатического повреждения и биотравмы, прогрессированию ССВР и синдрома полиорганной недостаточности («вентилятор-индуцированная ПОН»). В конечном итоге неправильно подобранные параметры респираторной поддержки при тяжелом сепсисе приводят к увеличению летальности («вентилятор-индуцированная смерть»).
Таким образом, в задачи респираторной поддержки при сепсисе, кроме обеспечения газообмена, уменьшения работы дыхания и снижения потребления кислорода дыхательными мышцами входит и предотвращение вентилятор-индуцированного повреждения легких – баротравмы, волюмотравмы и ателектатической травмы, что препятствует прогрессированию легочной и системной воспалительной реакции.
Задачи респираторной поддержки при тяжелом сепсисе
1. Оптимизация газообмена
· Обеспечение альвеолярной вентиляции (т. е. артериального pCO2 и pH). Осуществляется подбором величины минутной вентиляции легких до достижения нормокапнии (нормовентиляции), т. е. paCO2 35-45 мм рт. ст. В случае крайне тяжелого течения дистресс-синдрома при невозможности поддержания оксигенации другими способами (неэффективности ПДКВ, маневров рекрутирования альвеол, вентиляции легких в положении лежа на животе), при отсутствии неврологических противопоказаний (острый период черепно-мозговой травмы, повышенное внутричерепное давление, опухоль головного мозга, инфаркт мозга, кровоизлияние в мозг и т. д.) возможно применение умеренной («допустимой») гиперкапнии до величин paCO2 100 мм рт. ст., однако показания к применению этой методики должны быть строго ограничены, по возможности необходимо уменьшать сроки гиперкапнии, необходимо осуществлять тщательное мониторирование неврологического статуса и проводить глубокую медикаментозную седацию. У пациентов с предсуществующей хронической дыхательной недостаточностью (например, при ХОБЛ) величина paCO2 определяется в индивидуальном порядке. Нарастание величины paCO2 в динамике у больных с респираторным дистресс-синдромом коррелирует с вероятностью неблагоприятного исхода. Допускается применение гипокапнии (гипервентиляции) при повышенном внутричерепном давлении в соответствии с протоколами лечения соответствующих заболеваний.
· Обеспечение артериальной оксигенации (т. е. артериального pO2).
Осуществляется подбором параметров респираторной поддержки с целью максимального вовлечения в газообмен нефункционирующих альвеол различными способами (оптимальное ПДКВ, оптимальное инспираторное давление и время, маневр «рекрутирования» альвеол, вентиляция легких в положении лежа на животе, высокочастотная вентиляция легких, инверсное соотношение вдоха к выдоху) и поддержания функциональной остаточной емкости легких большей объема закрытия легких, предотвращения отрицательных эффектов на гемодинамику и легочное кровообращение, предотвращения вентилятор-индуцированного повреждения легких. При оценке оксигенирующей функции легких используется респираторный индекс (paO2/FiO2), величина которого (при условии, что потребление кислорода, сердечный индекс, концентрация гемоглобина в крови и постоянны и отсутствия сдвига кривой диссоциации оксигемоглобина), прямо пропорциональна количеству функционирующих альвеол. Минимально достаточным следует считать PaO2 60 мм рт. ст. и SaO2 93%. Не имеет смысла поддержание PaO2 выше физиологических величин (100 мм рт. ст), так как повышения доставки кислорода к органам не происходит, а применение высоких инспираторных фракций кислорода оказывает токсичное влияние на легкие. При подборе параметров респираторной поддержки для оценки функционального состояния альвеол необходимо ориентироваться на следующие параметры:
1) респираторный индекс, повышение которого указывает на вовлечение в газообмен ранее нефункционирующих альвеол, то есть раскрытие альвеол и поддержание их открытыми («рекрутирование», «мобилизация» альвеол).
2) РaCO2, уменьшение которого также свидетельствует об увеличении объема вентилируемых альвеол, т. е. уменьшении шунта,
3) давление плато (при вентиляции с управляемым объемом), которое обратно пропорционально податливости и прямо пропорционально эластичности респираторной системы,
4) дыхательный объем (при вентиляции с управляемым давлением), который прямо пропорционален податливости и обратно пропорционален эластичности респираторной системы,
5) расчетные показатели податливости респираторной системы и петлю «давление –объем».
Оксигенация артериальной крови при ИВЛ зависит от среднего давления в альвеолах, измерение которого в клинической практике невозможно, поэтому используется аналог – среднее давление в дыхательных путях. Подбор параметров дыхательного цикла позволяет управлять средним давлением в дыхательных путях. Необходимо поддерживать оптимальное среднее давление в дыхательных путях и уменьшать пиковое давление и давление плато, то есть разница между средним давлением и давлением плато и средним давлением и пиковым давлением должна быть минимальна.
2. Уменьшение работы дыхания и снижение потребления кислорода дыхательными мышцами. Цель - уменьшение повышенной вследствие сниженной податливости легочной ткани или повышенного сопротивления дыхательных путей работы дыхания, при которой значительно возрастает потребление кислорода дыхательными мышцами и кислородная задолженность.
3. Предотвращение динамического перераздувания альвеол – волюмотравмы. Использование при респираторной поддержке высоких дыхательных объемов приводит к перераздуванию альвеол, повреждению паренхимы легких, увеличению проницаемости легочных капилляров, повреждению эндотелия капилляров легких и активации медиаторов воспаления, приводя к развитию легочной и прогрессированию системной воспалительной реакции, сдавлению легочных капилляров с нарушением микроциркуляции легких, нарушению вентиляционно-перфузионных соотношений и формированием легочной гипертензии и повышению нагрузки на правый желудочек сердца. При этом большее внимание при подборе параметров респираторной поддержки следует уделять не величине дыхательного объема, а давлению плато - производному показателю, величина которого при респираторной поддержке напрямую коррелирует с вероятностью летального исхода. Необходим такой подбор параметров респираторной поддержки, чтобы давление плато не превышало 30 см вод. ст. При остром повреждении легких (респираторном дистресс-синдроме) рекомендуется использование дыхательных объемов 6 мл/кг идеальной массы тела (методология малых дыхательных объемов), при этом необходимая минутная вентиляция поддерживается увеличением частоты дыхания. При использовании таких дыхательных объемов в большинстве случаев давление плато не превышает 30 см вод. ст. Распознавание перераздувания альвеол возможно по петле «давление –объем», на которой при появлении перераздувания альвеол появляется верхняя точка перегиба («крыло птицы»). При отсутствии верхней точки перегиба на петле «давление-объем» и давлении плато меньшем 30 см вод. ст. возможно применение более высоких дыхательных объемов с учетом биомеханических свойств респираторной системы и физиологических потребностей пациента, не превышающих 10 мл/кг массы тела. При уменьшении дыхательного объема для поддержания PaCO2 на прежнем уровне необходимо увеличить частоту дыхания, принимая во внимание возникающее при этом ауто-ПДКВ.
4. Предотвращение коллабирования альвеол и мелких дыхательных путей на выдохе – ателектатической травмы. Ателектатическая травма возникает при циклическом открытии альвеол и мелких дыхательных путей на вдохе и коллабированием их на выдохе вследствие истощения запасов сурфактанта и увеличении вследствие этого сил поверхностного натяжения и объема закрытия легких. Ателектотравма приводит к дополнительному повреждению альвеол, эндотелия капилляров, увеличению проницаемости капилляров легких и выдавливанию сурфактанта из альвеол в дыхательные пути с усилением коллабирования альвеол (ателектазирование). Цель предотвращения ателектатической травмы в увеличении функциональной остаточной емкости легких (больше объема закрытия легких) и перемещения точки начала вдоха по петле «давление-объем» выше нижней точки перегиба. Для увеличения ФОЕ используется оптимальное положительное давление конца выдоха (ПДКВ), тщательный подбор которого по петле «давление-объем», кривой квазистатической податливости и газам артериальной крови позволяет уменьшить проявления ателектатической травмы и восстанавливать функциональность альвеол. ПДКВ приводит к повышению среднего давления в дыхательных путях, тем самым увеличивая среднее альвеолярное давление, от которого зависит оксигенация артериальной крови, при этом повышение пикового давления и давления плато незначительно, поэтому вклад ПДКВ в вентилятор-индуцированное повреждение легких минимален. Таким образом, дыхательный объем при вентиляции легких должен колебаться в некоторых очень небольших пределах между нижней и верхней точками перегиба петли давление-объем», что патофизиологически обосновывает использование малых дыхательных объемов. Такая методология, получившая название протективной вентиляции легких, уменьшает проявления легочной воспалительной реакции и предотвращает прогрессирование синдрома системной воспалительной реакции и полиорганной дисфункции при тяжелом сепсисе.
Рисунок 2
Клиническое применение петли «давление-объем»

Объем

 А В
А В

 D
D

4. Нижняя точка перегиба – соответствует лучшему ПДКВ с точки зрения биомеханики
5. Работа по инициации дыхания.
 О С Давление
О С Давление

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 |



