Кристаллические формы.
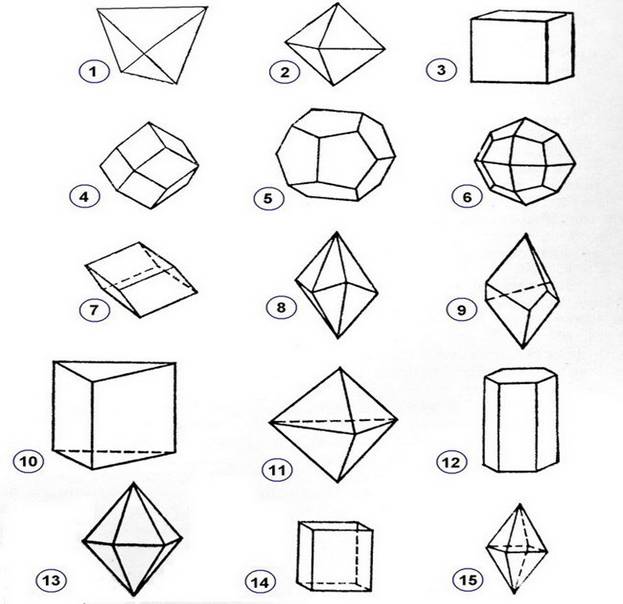
1. Тетраэдр 2. Октаэдр 3. Куб 4. Ромбододекаэдр 5. Пентагондодекаэдр 6. Тетрагонтриоктаэдр7. Ромбоэдр 8. Скаленоэдр 9. Трапецоэдр 10. Трехгранная призма 11. Трехгранная бипирамида. 12. Шестигранная призма 13. Шестигранная бипирамида 14. Четырехгранная призма. 15. Четырехгранная бипирамида.
Классическим примером кубической формы кристалла служит - пирит:

Кубический облик имеют, так же: галит, флюорит. Призматическая форма характерна для диопсида, берилла. Дипирамидальная - циркону; октаэдрическая - алмазу.
В минералогии принято, при описании формы указывать:
· наличие на гранях характерной штриховки, к примеру, тот же пирит;
· сдвоен ли кристалл, двойники;
· сколько у кристалла зон и направлений роста, т. к. бывают кристаллы, особенно у кварца, когда кристалл растет в двух противоположных направлениях и при этом образуются две головки;
· имеются ли фантомы, это тот случай, когда в нутри одного кристалла, начинает расти другой;
· сохранность кристаллов, имеются ли следы растворения;
· указывают состояние граней, есть ли сросшиеся, потерянные и т. п.
Штриховка на гранях - является характерным свойством того или иного минерала. Штриховки бывают:
1. Поперечная параллельная (у Кварца).
2. Продольная параллельная (турмалин, эпидот).
3. Пересекающаяся (магнетит).
Морфология (внешний вид) минералов зависит и от условий их образования. Наиболее правильные и характерные формы, присущи свободно растущим кристаллам, монокристаллам, когда нет помех для идеальной, свободной кристаллизации вешества. Всяческие помехи при кристаллизации могут привести к различным откланениям, и как следствие к необычному, порой даже не узнаваемому виду минерала.
Агрегаты.
 Если камень состоит из нескольких минералов одного и того же происхождения, то это называется агрегат. Самый распространенный пример агрегатов это - гранит, в состав которого входят зерна различных минералов.
Если камень состоит из нескольких минералов одного и того же происхождения, то это называется агрегат. Самый распространенный пример агрегатов это - гранит, в состав которого входят зерна различных минералов.
Агрегаты бывают, зернистые, землистые, шестоватые, волокнистые. пластинчатые, чешуйчатые.
Зернистые агрегаты различаются по величине зерна: крупнозернистые  (размер зерна более 5 мм в поперечнике), среднезернистые (зерна от 1 до 5 мм), мелкозернистые (с зернами менее 1 мм). По характеру распределения составляющих их зерен разделяются на: равномернозернистые и неравномерозернистые.
(размер зерна более 5 мм в поперечнике), среднезернистые (зерна от 1 до 5 мм), мелкозернистые (с зернами менее 1 мм). По характеру распределения составляющих их зерен разделяются на: равномернозернистые и неравномерозернистые.
на фото: Среднезернистый, равномернозернистый агрегат.
Землистые агрегаты, в основном характерны для рыхлых, порошковатых минералов. К таким относятся и часть осадочных горных пород - глины (каолин), бокситы.
Другие, основные формы выделения минералов:
Друзы (щетки) - незакономерные сростки правильных, хорошо образованных кристаллов, выросших в полостях (пустотах) горных пород.

на фото: Друза кристаллов.
Конкреции - шаровидное или неправильной формы стяжение с радиальнолучистым или скорлуповатым строением. Образуются путем отложения вешества вокруг какой либо основы, затравки, иногда такой затравкой служат органические остатки. Рост конкреции происходит от центра к краям, при этом приток откладываемого вещества происходит наоборот, от краев к центру. Как правило, форма выделения в виде конкреции характерно для минералов образуемых в осадочных породах. Самыми характерными минералами, которые чаще вего образуются в виде конкреций, являются: сферосидерит, марказит и фосфориты.
Секреции (жеоды, миндалины) - форма отложения минералов в полостях горных пород. Здесь рост минералов направлен от краев к центру. Жеодами называют секреции, размер которых более 2 см. в диаметре, все, что меньше, называют миндалинами. Такая форма выделения, как правило, имеет плотно заросшие края и пустой центр.

на фото: агатовая жеода с горным хрусталем.
Дендриты - форма минералов, имеющая ветвистое, древовидное строение. Зачастую такая конструкция напоминает отпечаток растения. Отсюда и название. Дендриты образуются благодаря отложению частиц питающих растворов по тонким трещинкам вмещающей породы. Дендриты очень частая форма выделения самородной меди и окислов марганца. Последние могут создавать причудливые, пейзажные рисунки на кремнистых известняках.
Оолиты – агрегат, состоящий из мелких шариков, размер которых может достигать 2 см. В разрезе, такие шарики имеют концентрическое или радиальнолучистое строение. Оолиты образуются в водной среде, когда раствор вещества группируется вокруг песчинок, пузырьков воздуха. К оолитам, так же относят все минералы, имеющие оолитовое строение, независимо от условий образования.
Почковидные агрегаты или натеки – распространены среди поверхностных образований. Могут иметь вид сосулек растущих сверху (сталактиты) или растущих снизу (сталагмиты). Натечная форма выделения встречается у малахита, гематита, халцедона.

на фото: Почковидный агрегат халцедона.
Минералы могут выделяться и в виде корочек, налетов, выцветов. Такая форма специфична для поверхностных условий образования минералов.
Налеты и примазки - тонкие пленки различных вторичных минералов, покрывающие поверхность кристаллов или пород. Таковы, например, пленки лимонита на кристаллах горного хрусталя.
Выцветы - переодически появляющиеся в сухую погоду и исчезающие в дожди рыхлые корочки, пленки, часто пушистые или моховидные. Эти образования сложены чаще всего легкорастворимыми водными хлоридами, сульфатами разных металлов или другими воднорастворимыми солями.
Землистые массы - рыхлые, мягкие, мучнистые агрегаты аморфного или скрытокристаллического строения. Чаще всего образуются при химическом выветривании горных пород или в зоне окисления руд (напр. руд марганца).
Псевдоморфозы. Псевдоморфозами называют минералы, которые, образуясь, имеют не свойственные им формы. Классическим примером является псевдоморфоза лимонита по пириту. Рождение такой формы, происходит так: пирит (FeS2) попав в зону окисления, разрушается и переходит в гидроокисел железа (Fe2O3 x nH2O), лимонит, который и заполняет оставшуюся от выщелачивания форму пирита.
Параморфоза – та же псевдоморфоза, только минерал, который замещает исходный, имеет идентичный с исходным минералом химический состав.
3. ОПРЕДЕЛЕНИЕ СОЛЕВОГО СОСТАВА ВОДЫ.
В водных растворах подавляющее большинство солей существует в виде ионов. В природных водах преобладают три аниона (гидрокарбонат HCO3-, хлорид Cl - и сульфат SO42-) и четыре катиона (кальций Ca2+, магний Mg2+, натрий Na+ и калий K+) - их называют главными ионами. Хлорид-ионы придают воде солёный вкус, сульфат-ионы, ионы кальция и магния - горький, гидрокарбонат-ионы безвкусны. Они составляют в пресных водах свыше 90-95 %, а в высокоминерализованных - свыше 99 % всех растворенных веществ. Обычно нижним пределом концентрации для главных ионов считают 1 мг/л, поэтому в ряде случаев, например для морских и некоторых подземных вод, к главным компонентам можно отнести также Br-, B3+, Sr3+ и др. Отнесение ионов K+ к числу главных является спорным. В подземных и поверхностных водах эти ионы, как правило, занимают второстепенное положение. Только в атмосферных осадках ионы K+ могут играть главную роль.
Однако ионная форма главных компонентов свойственна в полной мере лишь маломинерализованным водам. При увеличении концентрации между ионами усиливается взаимодействие, направленное на ассоциацию, т. е. процесс, обратный диссоциации. При этом образуются ассоциированные ионные пары, например MgHCO3+, CaHCO3+.
Под влиянием климатических и других условий химический состав природных вод изменяется и приобретает характерные черты, иногда специфические для различных видов природных вод (атмосферные осадки, реки, озера, подземные воды).
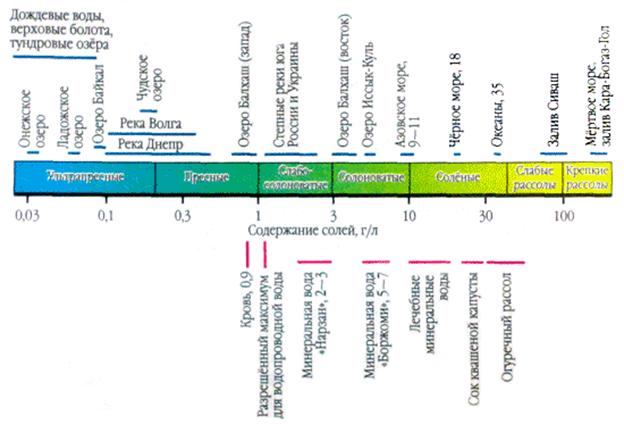
Атмосферные осадки из всех природных вод наименее минерализованы, но по химическому составу растворенных в них веществ они не менее разнообразны, чем другие природные воды. Источником их состава являются аэрозоли атмосферы. Ионный состав их довольно разнообразен. При колебаниях средней многолетней минерализации атмосферных осадков в европейской части России в пределах 10-20 мг/л и экстремальных значениях для всей территории 3-4 и 50-60 мг/л ионный состав характеризуется пестротой, причем среди анионов большей частью преобладает SO42- или HCO3-, а среди катионов в зависимости от степени удаленности от побережья Ca2+ или Na+. Непосредственно у побережья при ветре, дующем с моря, в результате ветрового механического выноса солей концентрация хлора в осадках бывает повышенной. По мере удаления от побережья относительная концентрация Cl - падает, а SO42-, Ca2+ и Mg2+, наоборот, повышается. Причиной повышения содержания SO42- и Ca2+ является обогащение атмосферы аэрозолями континентального происхождения. По мере продвижения в глубь континента часть морских аэрозолей вымывается. Наибольшие изменения испытывает концентрация SO42-. Если увеличение содержания Ca2+ и Na+ связано, скорее всего, с минеральной пылью почв и пород, на поверхности которых всегда присутствуют эти соли, то увеличение содержания SO42- обусловлено, с одной стороны, окислением SO2 и H2S, с другой - поднятием сернокислых солей с засоленных поверхностей.
Не поддаются даже приблизительной оценке громадные количества солевых частиц, поднимаемых с почв, соленых озер, поверхности льда, удобрений и, наконец, выбрасываемых химическими и металлургическими производствами, и выбрасываемые в атмосферу в результате другой деятельность людей, а в дальнейшем вымываемые осадками.
Воды большинства рек принадлежат к гидрокарбонатному классу. По составу катионов эта вода имеет почти исключительно преобладание кальция; гидрокарбонатные воды с преобладанием магния и натрия - крайне редкое явление. Из природных вод гидрокарбонатного класса наиболее распространены воды малой минерализации (суммарное содержание солей до 200 мг/л).
Реки с водой, относящейся к сульфатному классу, сравнительно малочисленны. Они распространены преимущественно в степной полосе и частично в полупустынях. В составе катионов природных вод сульфатного класса, так же как и в водах гидрокарбонатного класса, преобладает кальций. Однако ряд рек сульфатного класса имеет преобладание натрия. По минерализации воды сульфатного класса значительно превосходят воды гидрокарбонатного класса. Речные сульфатные воды с малой (общее количество солей до 200 мг/л) и средней (общее количество солей с 200 до 500 мг/л) минерализацией встречаются сравнительно редко. Наиболее характерна для этих рек повышенная (общее количество солей с 500 до 1000 мг/л), а иногда и высокая (общее количество солей более 1000 мг/л) минерализация воды.
Реки, воды которых относятся к хлоридному классу, встречаются почти так же редко, как и реки, в воде которых преобладают сульфаты. К этой территории относятся преимущественно степные районы и полупустыни. Преобладающими катионами природных вод хлоридного класса являются главным образом ионы натрия. Воды хлоридного класса отличаются высокой минерализацией - свыше 1000 мг/л, реже от 500 до 1000 мг/л.
1. Название образца воды _________________________________
2. Взятие пробы_______________ глубина (см) ______________
3. Объем воды (V) 1000 мл
Задача 1. Определение общей суммы водорастворимых солей.
1. Номер бюкса _______________
2. Масса бюкса _____________________
3. Масса бюкса с сухим остатком _________________________________
4. .Масса сухого остатка (а) ______________________________________
5. Общая сумма солей в % (Х) ____________________________
X = | а х V х 100 | = % |
Д |
где а - сухой остаток в граммах,
д - объем воды, взятый для анализа
Расчет_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________Задача 2. Задача 2. Определение общей щелочности воды (НСО3).
Ход анализа. 1. После определения щелочности, вызываемой нормальными карбонатами (если она была), в тот же стаканчик прибавляют 2-3 капли метилоранжа и титруют 0,02 н. раствором Н2SO4 до появления слабо-розового окрашивания.
2. Чтобы точно определить конец титрования в другую коническую колбочку берут 25 мл пробы и прибавляют 2-3 капли метилоранжа. Эта колбочка служит для сравнения изменения окраски титруемой жидкости. Обе колбочки должны стоять на листе белой бумаги. Надо тщательно следить за изменением окраски в колбочке, в которую приливают кислоту. Как только жидкость в ней порозовеет – титрование окончено.
3. Вычислить общую щелочность в процентах НСО3 в вычисляют по формуле:
1. Объем пробы, взятый для анализа (д) ____________________________
2. Количество 0,02н р-ра Н2SО4, затраченное на титрование_____________
3. Поправка к титру 0,02н Н2SО4 (к) __________ Нормальность (н) _______
4. Объем воды (V) 1000 мл
5. Пересчет в проценты - 0,061
НСО3 = | а х V х н х 100 х к | = м/экв. на литр |
Д |
Расчет______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Задача 3. Определение содержания хлоридов (Сl¯)
Определяют хлор-ион путем титрования водной вытяжки 0,01 н. раствором AgNO3 с индикатором 10%-ным раствором К2СrО4.
Ход анализа.
1. В колбы, где определяют НСО-3 в качестве индикатора добавляют по 1 мл 10%-ного раствора К2СrО4.
2. Титруют одну из порций 0,01 н. раствором АgNO3 до красновато-бурого окрашивания. Вторая порция раствора должна находиться рядом, и с ней все время надо сравнивать оттенок титруемой жидкости.
При прибавлении к титруемому раствору азотнокислого серебра происходит образование нерастворимого белого осадка АgCl по уравнению:
NaCl+AgNO3=AgCl+NaNO3.
Как только весь хлор-ион превратится в АgCl, каждая последующая капля АgNO3 будет вступать в реакцию с К2СrО4 и придаст жидкости не исчезающий при взбалтывании красно-бурый оттенок, что связано с красным цветом образующегося хромовокислого серебра:
2АgNO3+K2CrO4=AgCrO4+2KNO3
Начало появления неисчезающей красновато-бурой окраски и показывает окончание титрования.
1. Объем воды взятый для анализа (д) ____________________________
2. Мл 0,02н р-ра АgNO3, затраченное на титрование (а) _________________
З. Поправка к титру АgNO3 - (к) ____________________________________
4. Общий объем воды (V) 1000 мл
5.Содержание хлоридов (С1¯) ____________________________
Сl¯ = | а х н х V х 100 х к | = м/экв. на литр |
Д |
Расчет ________________________________________________________
______________________________________________________________
______________________________________________________________
______________________________________________________________
Задача 4. Определение сульфатов (SO4) с применением хлористого бензедина.
Ход анализа.
Для анализа берут 25 мл пробы, переносят ее в колбу емкостью 250-300 мл, к пробе небольшими порциями приливают 10 мл 0,1н раствора хлористого бензедина. В осадок выпадает сернокислый бензедин, его отделяют фильтрованием через плотный фильтр (синяя лента), промывают осадок несколько раз дистиллированной водой.
К полученному фильтрату прибавляют 2-3 капли фенолфталеина и титруют 0,1н р-ром NаОН до появления розовой окраски, не исчезающей в течение 1 минуты. Получают величину - (в).
Одновременно проводят холостое титрование. Пипеткой берут 10 мл хлористого бензедина, переносят в колбу, разбавляют в 3 раза дистиллированной водой, прибавляют 3 капли фенолфталеина и титруют 0,1н р-ром NаОН до появления розовой окраски. Получают величину (а).
Содержание сульфатов (SO4) вычисляют но формуле:
SO4= | (а – в) х н х V х 100 х К | = м/экв. на литр |
Д |
SO4 м-экв. х 0,048 = %
Форма записи:
1. Объем воды для анализа (д) ___________________________________
2. Мл хлористого бензедина на взаимодействие сульфатов _____________________
3. Количество 0,1н NаОН затраченное на титрование 10 мл хлористого бензедина (а) ______________________________________________________
4. Количество 0,1н р-ра NаОН, затраченное на титрование остатка хлористого бензедина после осаждения сульфатов (в) ______________________________
5.Объем воды (V) 1000 мл
Расчет_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Задача 5. Определение суммы кальция и магния трилонометрическим методом.
Ход анализа. 1. В две конические колбочки объемом по 250 мл пипеткой берут по 25 мл водной вытяжки.
2. Прилить в каждую колбочку по 75 мл дистиллированной воды, лишенной ионов Са, Мg и Cu.
3. Добавить по 5-10 капель 1%-ного раствора солянокислого гидроксиламина (NН2ОН·НСl), по 2-3 капли 1%-ного раствора сульфида натрия (Nа2S·9Н2О), по 5 мл хлоридно-аммиачного буфера и по 10-15 капель индикатора хромогена черного.
4. Оттитровать содержимое одной из колб 0.05 н. раствором трилона Б. Вторая колба служит для сравнения окраски. При титровании раствор необходимо все время перемешивать. Красный цвет вытяжки вблизи точки эквивалентности приобретает лиловую окраску, после чего титровать следует медленно. Конец титрования устанавливают по появлению синего цвета титруемой жидкости.
Содержание Са+Мg в миллиэквивалентах вычисляют по формуле:
1. Объем воды, взятый для анализа (д) ____________________________
2. Прилито мл 2% аммиачного буферного раствора ____________________
3. Количество мл трилона Б, затраченное на титрование (а) _____________
4. Нормальность трилона Б __________ поправка к титру (к) ____________
5. Объем воды (V) 1000 мл
Са++ + Мg++ = | а х н х 100 х V х к | = м/экв. |
Д |
Расчет_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Задача 6. Определение содержания кальция в водной пробе.
Ход анализа. 1. Взять пипеткой по 25 мл водной вытяжки, в две конические колбочки объемом по 250 мл.
2. Прилить в каждую колбочку по 75 мл дистиллированной воды, лишенной Са и Сu.
3. Добавить в колбочки по 5-10 мл водного раствора гидроксиламина, по 2-3 капли 1%-ного раствора сульфида натрия, по 2 мл 10%-ного раствора КОН или NаОН (для доведения рН раствора до 12) и примерно 0,2-0,3 г индикатора мурексида.
4. Оттитровать содержимое одной из колб 0.05 н. раствором трилона б до перехода ярко-розовой окраски в фиолетовую. Титровать надо медленно при постоянном помешивании. Содержание Са в мг-экв на 1000 мл воды высчитывают по формуле:
1. Объем воды, взятый для анализа (д) _________________________
2. Объем воды (V) 1000 мл
3. Количество мл трилона Б, затраченное за титрование (а) __________
4. Нормальность трилона Б ________________________________
5. Индикатор - мурексид, подщелачивание - 10% р-р NаОН - 1 мл.
Са++= | а х н х V х 100 х к | = м/экв. на литр. |
Д |
Вычисление магния: (Са++ + Мg++) - Са++= Мg++
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Пересчет в проценты: Са++(м-экв) х 20,04 = %
Мg++ (м-экв) х 12,16 = %
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Nа вычисляют по разности:
Са++ + Мg++ + Nа+ + К+ = СО3¯ ¯ + НСО3¯ + Сl¯ + SO4¯ ¯
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Определение ионов Na и К в водной вытяжке связано с аналитическими трудностями. Поэтому обычно вычисляют только их суммарное содержание или определяют на пламенном фотометре (методика приведена нами при описании метода определения поглощенных Na и К).
Имеющиеся химические методы определения Na и К очень сложны. Поэтому, если пламенного фотометра нет, Na и К обычно не определяют, а их содержание вычисляют по разности между суммой эквивалентов анионов (СО3, НСО3, SО4, Сl) и катионов Са и Мg.
В водных вытяжках количество натрия обычно сильно превышает количество калия, поэтому при расчета всю полученную сумму принимают за один натрий. Для перевода Nа в проценты величину, определенную по разности (в мг-экв), умножают на 23 (эквивалентный вес натрия) и делят на 1000.
В расчетах допускают, что все другие анионы и катионы встречаются в столь незначительных количествах, что ими можно пренебречь. В некоторых засоленных почвах иногда встречаются в значительных количествах другие катионы, поэтому определение Nа+К по разности не всегда дает хорошие результаты и надо иметь ввиду, что полученные данные имеют относительное значение.
Результаты анализа водной вытяжки сводят в таблицу, где содержание анионов и катионов выражают в процентах и мг-экв на 1000 г.
Свободная таблица результатов анализа водной вытяжки.
Образец № | минерализация, г/л | Содержание | |||||||||||
Анионы | Катионы | ||||||||||||
НСО3 | Сl | SО4 | Са | Мg | Nа | ||||||||
мг-экв/л | мг/л | мг-экв/л | мг/л | мг-экв/л | мг/л | мг-экв/л | мг/л | мг-экв/л | мг/л | мг-экв/л | мг/л | ||
Контрольная задача.
Качественный состав солей: СО3 – 1,60%, НС03 – 0,85%, Сl - 2,56%, SO4 – 2,65%, Nа- 4,63%, (Са++ + Мg++)- 3,03%. Определить степень и химизм солей.
Вопросы по теме.
1. Что представляет собой водный раствор, каков его состав?
2. Какое практическое значение имеет анализ воды?
3. Какие соли называются токсичными?
4. Какие соли называются нетоксичными
Работа проверена ________________________
Оценка работы _______________________________
4. ОПРЕДЕЛЕНИЕ ОБЩЕЙ ЖЕСТКОСТИ ВОДЫ
Жёсткость воды вспоминается в первую очередь с накипью и умягчителем воды — прибором, который должен справляться с жёсткой водой и препятствовать образованию накипи.

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 |



