Неспецифической основой всех адаптивных реакций являются изменения энергетического обмена. Именно обеспеченность или недостаток энергии определяют дальнейшую цепь регуляторных, метаболических и структурных изменений в организме. СДГ – один из ключевых ферментов цикла трикарбоновых кислот. Она является одним из основных маркеров энергообеспеченности клетки и организма в целом. Среднее значение СДГ в группе детей с острым пиелонефритом в активную фазу заболевания было в 1,1 раза ниже, чем в контрольной группе (р<0,05), что является отражением снижения процессов энергообмена в клетках, в том числе иммунокомпетентных и клетках почечной паренхимы (таб. 3).
В группе детей с хроническим процессом активность СДГ (таб. 3) была в 1,2 раза ниже как по сравнению с группой контроля (р<0,01), и в 1,2 раза ниже по сравнению с группой острого пиелонефрита (р<0,01). Более выраженные изменения процессов аэробного метаболизма у детей с обострением хронического процесса можно объяснить длительным течением заболевания, ведущим к истощению компенсаторных механизмов. Выявленные изменения свидетельствуют о нарушении окислительного фосфорилирования и энергосинтезирующих процессов в иммунокомпетентных клетках детей, больных пиелонефритом.
Для обоснования путей коррекции выявленных метаболических нарушений было проведено изучение корреляционных взаимоотношений между содержанием МЭ и активностью ИМС у детей с пиелонефритом. Анализ полученных данных показал, что концентрация гемоглобина (Hb) статистически значимо коррелировала с содержанием I¯ (rs=0,6, p<0,05), Coс (rs=0,45, p<0,05), Сuс (rs=0,54, p<0,05) и Cuэл (rs=0,61, p<0,05), Pbс (rs=0,47, p<0,05). Сильная корреляционная зависимость показана между числом эритроцитов и содержанием йодидов (rs=0,68, p<0,05), Coс (rs=0,39, p<0,05). Число лейкоцитов отрицательно коррелировало с Coс (rs=-0,33, p<0,05) и Pbс (rs=-0,65, p<0,05). Отрицательные зависимости определялись между числом лейкоцитов и концентрацией Coэл (rs=-0,86, p<0,05), Liэл (rs=-0,69, p<0,05), Mnэл (rs=-0,8, p<0,05). Положительная корреляция имела место между числом лейкоцитов и концентрацией Liэл (rs=0,51, p<0,05), Mnс (rs=0,77, p<0,05) и Pbэл (rs=0,9, p<0,05).
Ранговая корреляция Спирмена между концентрацией МЭ и показателями ИМС выявило наличие отрицательной связи между содержанием I¯ и активность МП (rs=0,3, p<0,05), Сос и активность МП (rs=0,3, p<0,05), показателями НСТсп (rs=0,7, p<0,05) и НСТст (rs=0,4, p<0,05). Положительная корреляционная зависимость слабой силы выявлена между концентрация Сuс и показателями активности СДГ, МП, а отрицательные разной степени выраженности – с показателями НСТ (rs=-0,3 p<0,05). Содержание марганца в сыворотке и форменных элементах крови имела взаимоотношения различной силы и направленности практически со всеми показателями ИМС. Свинец сыворотке крови отрицательно коррелировал с показателем НСТст (rs=-0,3, p<0,05), а содержание свинца форменных элементов положительно коррелировало с активностью МП (rs=0,3, p<0,05), НСТсп (rs=0,6, p<0,05) и НСТст (rs=0,4, p<0,05).
Таким образом, микроэлементный статус у детей с пиелонефритом характеризуется снижением концентрации активных йодид-ионов в крови, снижением содержания лития, свинца и повышением концентрации меди в сыворотке крови на фоне снижения концентрации меди, марганца и свинца в форменных элементах крови, что связано с функционированием ИМС.
Анализ влияния содержания микроэлементов на обострение хронической патологии почек выявил, что содержание йодидов ниже 10 мкмоль/л увеличивает относительный шанс обострения хронического пиелонефрита в 3,4 раза (ОШ=3,4, р χ2=0,029), а высокое содержание меди в сыворотке крови – в 2,1 раза (ОШ=2,1, рχ2=0,041).
Таким образом, проведенное нами исследование у детей с пиелонефритом выявили особенности функционального состояния ИМС, как при остром, так и при хроническом течении.
 Активность микробицидной системы, ее функциональное состояние обеспечивается соотношением ряда ферментативных систем, в том числе окислительно-восстановительной миелопероксидазной системой, гидролитическими ферментами – кислой фосфатазой. Немаловажная роль принадлежит ферментам энергообмена, в частности сукцинатдегидрогеназе иммунокомпетентных клеток. ИМС нейтрофильных гранулоцитов была представлена в виде дескриптивной, функционально-структурной модели (рис. 1).
Активность микробицидной системы, ее функциональное состояние обеспечивается соотношением ряда ферментативных систем, в том числе окислительно-восстановительной миелопероксидазной системой, гидролитическими ферментами – кислой фосфатазой. Немаловажная роль принадлежит ферментам энергообмена, в частности сукцинатдегидрогеназе иммунокомпетентных клеток. ИМС нейтрофильных гранулоцитов была представлена в виде дескриптивной, функционально-структурной модели (рис. 1).
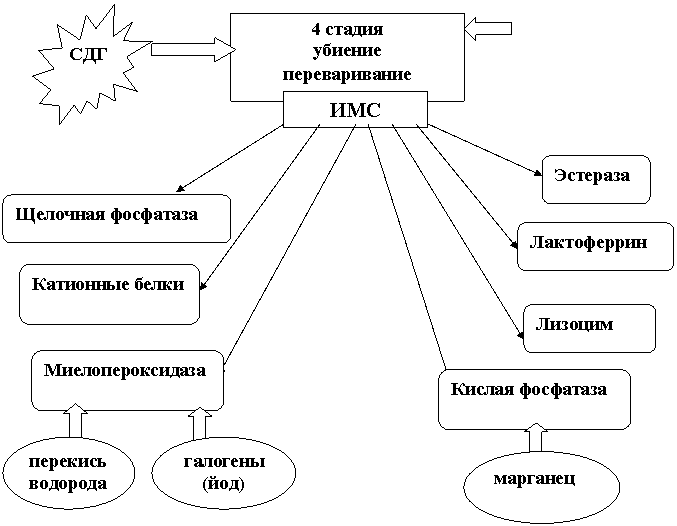
Рис. 1. Дескриптивная модель ИМС нейтрофильных гранулоцитов крови
Согласно такой модели, функциональное состояние этой системы определяется характером взаимоотношений основных ферментных систем ИМС и эссенциальных микроэлементов. Дескриптивная модель работы ИМС предложена (1994) и дополнена по результатам проведенного исследования. Кажется целесообразным, наряду с дисбалансом микроэлементов, влияющим на работу микробицидной системы, учитывать процессы энергообеспечения клетки на примере работы СДГ, так как процессы биосинтеза, идущие в нейтрофиле на ранних этапах созревания клетки, требуют определенных энергетических затрат. Недостаток или обеспеченность энергией также может влиять на дальнейшую работу ИМС.
Микробно-воспалительные заболевания почек, как любой патологический процесс в организме, нарушает состояние динамического равновесия процессов свободно-радикального окисления липидов. Была проведена оценка процессов СРО у больных с острым и хроническим пиелонефритом в активную фазу заболевания и стадию ремиссии. Группу сравнения составили дети с острым и хроническим пиелонефритом в стадии ремиссии, длительность которой была более 6 месяцев.
Хронический пиелонефрит в период разгара характеризуется более выраженной степенью окислительного стресса, проявляющуюся большей склонностью к СРО, повышением концентрации гидроперекисей (как в крови так и моче), увеличением скорости накопления свободных радикалов (табл. 5). Вместе с тем выражено угнетение антиоксидантной системы защиты. Чрезмерная активация СРО, вероятно, может возникать вследствие неконтролируемого течения воспалительного процесса и истощения эндогенных механизмов антиоксидантной защиты.
Таблица 5
Показатели ХМЛ (отн. ед) у детей с острым и хроническим пиелонефритом в активной фазе и стадии ремиссии (M±m)
|
Показатели |
Острый пиелонефрит |
Хронический пиелонефрит | ||
|
активная фаза n=48 |
ремиссия n=11 |
обострение n=31 |
ремиссия n=18 | |
|
Кровь | ||||
|
S sp |
0,34±0,008* |
0,12±0,02 |
0,39±0,009* |
0,198±0,015 |
|
S ind1(Fe2+) |
0,708±0,018* |
0,248±0,04 |
0,817±0,02* |
0,422±0,03 |
|
h 1 инд. (Fe2+) |
0,372±0,008* |
0,12±0,03 |
0,445±0,01* |
0,21±0,03 |
|
S ind2 (люминол-Н2О2) |
0,584±0,018* |
0,198±0,04 |
0,701±0,02* |
0,301±0,035 |
|
h 2 инд. (люминол-Н2О2) |
0,414±0,01* |
0,137±0,03 |
0,499±0,01* |
0,233±0,027 |
|
Моча | ||||
|
S sp |
0,022±0,0005* |
0,007±0,001 |
0,024±0,0008 |
0,033±0,01 |
|
S ind1 |
0,05±0,001* |
0,038±0,002 |
0,055±0,002 |
0,049±0,02 |
|
h 1 |
0,153±0,005* |
0,06±0,007 |
0,177±0,008* |
0,102±0,009 |
Примечание: * - р<0,01, по сравнению с группой в стадии ремиссии
Активная фаза хронического пиелонефрита, по сравнению с патологией почек в состоянии ремиссии, характеризовалась интенсификацией процессов СРО в организме в целом и в почках, в частности. Наблюдался прирост всех исследуемых параметров ХЛ в 1,9-2,0 раз (р<0,05).
У детей с острой формой заболевания в активную фазу процесса также выявили интенсификацию процессов СРО, но более выраженную. Отмечается прирост всех показателей в 3-3,5 раза, по сравнению с группой детей в стадии ремиссии. Выявленные изменения позволяют нам говорить о том, что острый воспалительный процесс, как явление острого респираторного взрыва, является одним из сильных дестабилизирующих факторов для организма.
Прирост активности процессов СРО в группе с детей с хроническим течением заболевания был ниже, чем у детей с острым пиелонефритом. Однако, при сравнении их между собой мы видим, что хроническое течение процесса приводит к более выраженным сдвигам. Значение показателей ХЛ в 1,2 раза выше, чем при остром процессе.
Сравнивая интенсивность процессов СРО в обеих группах наблюдения в стадию ремиссии, отмечено, что исходный уровень активности процессов СРО выше в группе детей с хроническим течением заболевания. Таким образом, можно предположить, что клинико-лабораторная ремиссия, подтвержденная общепринятыми в клинике методами, не соответствует истинному процессу, протекающему в организме. Возможно, дестабилизация процессов СРО связана с морфофункциональными изменениями почечной паренхимы, сохранением возбудителя заболевания в ткани и, как следствие, поддержанием воспаления на тканевом уровне. Такой вялотекущий процесс, без явных клинико-лабораторных изменений, ведет к дальнейшему прогрессированию пиелонефрита. Исходное напряжение в системе СРО приводит в дальнейшем к истощению запасов компонентов антиоксидантной системы и нарушению компенсаторных возможностей организма.
Таким образом, острое начало или обострение хронического пиелонефрита у детей характеризовалось большей интенсивностью процессов свободно-радикального окисления (р<0,05) по сравнению с группой детей в стадии ремиссии. Выявленные изменения позволяют дать патогенетическое обоснование использования в комплексной терапии пиелонефрита препаратов, оказывающих модулирующий эффект на процессы СРО.
Полученные данные о наличии явного или скрытого дефицита йодидов, обусловленный нехваткой его поступления из окружающей среды и влияющий на функционировании ИМС у детей с пиелонефритом, свидетельствуют о необходимости использования в комплексном лечении детей с микробно-воспалительными заболеваниями почек препаратов йода. Для этого был использован препарат «Йодомарин».
Помимо этого, в связи с выявленным снижением энергоообеспеченности иммунокомпетентных клеток крови у детей с пиелонефритом, в качестве универсального мессенджера, запускающего процессы внутриклеточной и внеклеточной сигнальной трансдукции, когда нет необходимости назначать высокие дозы препарата, был использован препарат из группы регуляторов энергообмена – «Янтарь-Бэби».
Возможность и эффективность применения «Йодомарина» в комплексной терапии детей с пиелонефритом прослежена на 3-х группах больных. Первая, контрольная группа (n=30) получала общепринятую стандартную терапию, которая включала в себя назначение антибиотика широкого спектра действия, с последующим переходом на терапию уросептиком. Стартовая антибактериальная терапия пиелонефрита в 77,5% и 62% случаях соответственно начиналась с назначения цефалоспорина 3 поколения – препарата Цефотаксим. Длительность курса терапии у детей с острым и хроническим пиелонефритом в среднем составила 9,2±0,2 дня и 8,7±0,26 дня соответственно. При необходимости, после получения результатов бактериологического исследования мочи проводилась коррекция антибактериальной терапии. Терапия уросептиками проводилась согласно полученной чувствительности, в 70,8% и 60,3% наблюдений был назначен уросептик - Фурагин.
Вторая группа детей – больные острым пиелонефритом (n=29) и больные хроническим пиелонефритом (n=19), наряду со стандартом лечения дополнительно получали препарат «Йодомарин» (100-200 мг в зависимости от возраста) в течение 10 дней. Третья группа – больные острым пиелонефритом (n=30) и больные хроническим пиелонефритом (n=30), наряду с антибиотикотерапией дополнительно получали препарат «Янтарь-Бэби» 3 раза в день после еды из расчета 1 мг/кг в пересчете на янтарную кислоту ежедневно. Продолжительность приема препарата составила 10 дней.
С целью оценки степени йоддефицита в динамике процесса проведена оценка концентрации йодид-ионов в крови (таб. 6) и степени йодурии через 10 дней после лечения (табл. 7).
Таблица 6
Уровень йодид-ионов крови у детей с пиелонефритом (мкмоль/л)
|
Группы наблюдения |
Острый пиелонефрит |
Хронический пиелонефрит |
|
М±m |
М±m | |
|
До лечения |
12,14±1,76 |
12,55±1,53 |
|
После стандартной терапии |
13,39±1,7 |
10,59±1,52 |
|
Терапия в сочетании с Йодомарином |
47,16±7,67* |
56,61±9,8* |
Примечание: * - достоверность различий р<0,001, по сравнению с группой до лечения
Таблица 7
Уровень йодурии у детей с пиелонефритом (мкг/л)
|
Группы наблюдения |
Острый пиелонефрит |
Хронический пиелонефрит |
|
Me (min-max) |
Me (min-max) | |
|
До лечения |
60,3 (34-100) |
44 (32-64,5)* |
|
После стандартной терапии |
39 (5,82-68,4) |
44 (25-67,2) |
|
Терапия в сочетании с Йодомарином |
49,6 (19-67,2)* |
46 (25-71,7) |
Примечание: * - достоверность различий р<0,05
Как следует из представленных данных, на фоне стандартного лечения пиелонефрита, концентрация йодид-ионов у детей оставалась на низком уровне и сопровождалось снижением показателя йодурии у детей с острым пиелонефритом в 1,5 раза, отражая состояние среднетяжелого йоддефицита, что вероятно связано с потреблением микроэлемента в ходе воспалительного процесса в организме. Наряду с этими изменениями выявлено снижение активности МП (р<0,001), стимулятором которой является йод (табл. 8, 9) и СДГ (р<0,001). Это можно объяснить естественным процессом истощения ферментативных систем на фоне воспалительной реакции, при этом быстрое истощение активности фермента может вести к незавершенности процессов фагоцитоза и, как следствие, хронизации воспалительного процесса в почечной паренхиме.
Таблица 8
Активность ферментов лейкоцитов крови у детей
с острым пиелонефритом в зависимости от вида терапии
|
Показатели |
До лечения n=89 |
Стандартное лечения n=30 |
+ Йодомарин n=29 |
+ Янтарь-Бэби n=30 |
|
СДГ, гр/кл |
21,7±0,76 |
18,2±0,54* |
20,1±0,79 |
21,2±0,77 |
|
МП, усл. ед. |
194,7±1,1 |
188,0±1,7* |
193,0±1,5 |
192,7±2,9 |
|
КФн, усл. ед. |
150,8±2,8 |
142,3±3,3 |
147,1±2,6 |
149,2±3,7 |
|
НСТсп., усл. ед. |
27,89±4,1 |
20,6±2,7 |
15,7±1,37 |
28,7±5,5 |
|
НСТст., усл. ед. |
38,14±5,2 |
24,1±2,9* |
21,78±2,38 |
38,2±5,4 |
|
ФР |
9,72±2,7 |
5,6±3,2 |
6,3±2,5 |
9,5±5,4 |
Примечание: * - р<0,001 по сравнению с группой до лечения
В группе детей, получавших дополнительно «Йодомарин», уровень активных йодидов в процессе лечения повышался в 3,9 и 4,5 раза при остром и хроническом пиелонефрите соответственно (табл. 6, 7).

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 |



