ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
Государственное образовательное учреждение
высшего профессионального образования
«Томский политехнический университет»
ёв,
ОБЩАЯ ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ
Химические процессы и реакторы
Учебное пособие
Издательство ТПУ
![]() Томск 2008
Томск 2008
УДК 6 Ш 33 | |
Ш 33 | Б., Общая химическая технология. Химические процессы и реакторы: учебное пособие. – Томск: Изд-во ТПУ, 2008. – 180 с. |
В учебном пособии дано определение химической технологии как науки и объекта её исследования – химического производства. Рассмотрены теоретические закономерности химических процессов и основы теории химических реакторов, общие принципы разработки химико-технологических процессов на основе системного подхода.
Пособие подготовлено на кафедре общей химической технологии, соответствует программе дисциплины и предназначено для студентов специальностей 240801 «Машины и аппараты химических производств», 240403 «Химическая технология природных энергоносителей и углеродных материалов», 240304 «Химическая технология тугоплавких неметаллических и силикатных материалов», 240401 «Химическая технология органических веществ» Института дистанционного образования.
УДК 6
Рекомендовано к печати Редакционно-издательским
советом Томского политехнического университета
Рецензенты:
– заведующий кафедрой ХТТ ТПУ, профессор,
доктор технических наук;
– заведующий лабораторией пластовых нефтей
«Томск НИПИнефть, профессор, доктор геолого-минералогических наук, кандидат технических наук.
![]() © Томский политехнический университет, 2008
© Томский политехнический университет, 2008
 ОГЛАВЛЕНИЕ
ОГЛАВЛЕНИЕ
Введение
Глава 1. ХИМИКО-ТЕХНОЛОГИЧЕСКИЙ ПРОЦЕСС
И ЕГО СОДЕРЖАНИЕ
§ 1.2. Стехиометрия химических реакций
§ 1.3. Технологические критерии эффективности
химико-технологического процесса
Вопросы и упражнения для повторения и самостоятельной работы
Глава 2. ТЕРМОДИНАМИЧЕСКИЕ РАСЧЕТЫ
ХИМИКО-ТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВ
§ 2.1. Равновесие химических реакций
§ 2.2. Способы смещения равновесия
§ 2.3. Зависимость константы равновесия от температуры
§ 2.4. Расчет равновесия по термодинамическим данным
Вопросы и упражнения для повторения и самостоятельной работы
§ 3.1. Скорость гомогенных химических реакций
§ 3.2. Зависимость скорости химических реакций
от концентрации реагентов. Кинетические уравнения
§ 3.3. Способы изменения скорости простых и сложных реакций
Вопросы и упражнения для повторения и самостоятельной работы
Глава 4. ОБЩИЕ СВЕДЕНИЯ О ХИМИЧЕСКИХ РЕАКТОРАХ
§ 4.1. Моделирование химических реакторов
и протекающих в них химических процессов
§ 4.2. Структура математической модели химического реактора
§ 4.3. Уравнение материального баланса для элементарного объема
проточного химического реактора
§ 4.4. Классификация химических реакторов и режимов их работы
Вопросы и упражнения для повторения и самостоятельной работы
Глава 5. ХИМИЧЕСКИЕ РЕАКТОРЫ С ИДЕАЛЬНОЙ СТРУКТУРОЙ
ПОТОКА В ИЗОТЕРМИЧЕСКОМ РЕЖИМЕ
§ 5.1. Реактор идеального смешения
§ 5.2. Реактор идеального вытеснения
§ 5.3. Сравнение эффективности проточных реакторов
идеального смешения и идеального вытеснения
§ 5.4. Каскад реакторов идеального смешения
Вопросы и упражнения для повторения и самостоятельной работы
Глава 6. ТЕПЛОПЕРЕНОС В ХИМИЧЕСКИХ РЕАКТОРАХ
§ 6.1. Уравнение теплового баланса.
Тепловые режимы химических реакторов
§ 6.2. Проточный реактор идеального смешения
в неизотермическом режиме
§ 6.3. Тепловая устойчивость химических реакторов
§ 6.4. Оптимальный температурный режим
и способы его осуществления в промышленных реакторах
Вопросы и упражнения для повторения и самостоятельной работы
Глава 7. ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ
§ 7.1. Общие особенности
§ 7.2. Диффузионные стадии
§ 7.3. Гетерогенные некаталитические процессы
в системе «газ – твердое вещество»
§ 7.4. Гетерогенные процессы в системе «газ – жидкость»
Вопросы и упражнения для повторения и самостоятельной работы
Глава 8. ГЕТЕРОГЕННО-КАТАЛИТИЧЕСКИЕ ПРОЦЕССЫ
§ 8.1. Общие представления о катализе
§ 8.2. Технологические характеристики твердых катализаторов
§ 8.3. Основные стадии и кинетические особенности
гетерогенно-каталитических процессов
Вопросы и упражнения для повторения и самостоятельной работы
СПИСОК ЛИТЕРАТУРЫ
Введение
Под технологией в широком значении этого слова понимают научное описание методов и средств производства в какой-то отрасли промышленности. Например, методы и средства обработки металлов составляют предмет технологии металлов, методы и средства изготовления машин и аппаратов – предмет технологии машиностроения. Процессы механической технологии основаны преимущественно на механическом воздействии, изменяющем внешний вид или физические свойства обрабатываемых веществ, но не влияющем на их химический состав. Процессы химической технологии включают в себя химическую переработку сырья, основанную на сложных по своей природе химических и физико-химических явлениях.
Химическая технология – наука о наиболее экономичных и экологически обоснованных методах химической переработки сырых природных материалов в предметы потребления и средства производства.
Современная химическая технология, используя достижения естественных и технических наук, изучает и разрабатывает совокупность физических и химических процессов, машин и аппаратов, оптимальные пути осуществления этих процессов и управления ими при промышленном производстве различных веществ, продуктов, материалов, изделий.
Химическая технология базируется, прежде всего, на химических науках, таких, как физическая химия, химическая термодинамика и химическая кинетика, но в то же время не просто повторяет, а развивает закономерности этих наук в приложении к крупномасштабным промышленным процессам. Поэтому химическая технология немыслима без тесной связи с экономикой, физикой, математикой, кибернетикой, прикладной механикой, другими техническими науками.
Развитие химической технологии как науки неотделимо от ее практических приложений. Химическая промышленность – одна из ведущих отраслей материального производства. Новые открытия и технологические разработки быстро становятся достоянием практики, тесно связывают науку с производством, и эта взаимная связь позволяет более рационально использовать сырье и топливно-энергетические ресурсы, создавать новые безотходные производства, в которых химико-технологические процессы протекают с высокими скоростями в оптимальных условиях, с получением продуктов высокого качества.
Учебный курс «Общая химическая технология» входит в цикл общепрофессиональных дисциплин и представляет собой введение в химическую технологию как науку. Целью курса является знакомство с химическим производством – сложной химико-технологической системой, а также рассмотрение общих проблем анализа и синтеза химических производств. Соответственно, обобщающее начало в курсе преобладает над описательным.
В задачи курса входит общее знакомство с химическим производством, его структурой и компонентами, изучение основ химических процессов и химических реакторов, освоение общих методов анализа и синтеза химического производства как химико-технологической системы, знакомство с некоторыми конкретными химическими производствами, на примере которых предметно демонстрируются теоретические положения курса. Значительное место уделяется физико-химическим и технологическим аспектам анализа процессов в химическом производстве, в основном в химических реакторах, и организации химико-технологических процессов.
Методологической основой изучения материала курса «Общая химическая технология» являются основные научные методы исследования химико-технологических процессов – математическое моделирование и системный анализ, базирующиеся на закономерностях протекающих химических и фазовых превращений, явлений переноса теплоты и вещества, равновесия, сохранения энергии и массы в сложных реагирующих системах, что делает представленный материал не просто изложением сведений о процессах и явлениях химической технологии, а их исследованием и разработкой.
Глава 1
ХИМИКО-ТЕХНОЛОГИЧЕСКИЙ ПРОЦЕСС
И ЕГО СОДЕРЖАНИЕ
Химико-технологический процесс представляет собой совокупность операций, позволяющих получить целевой продукт из исходного сырья. Все эти операции входят в состав трех основных стадий, характерных практически для каждого химико-технологического процесса.
На первой стадии проводят операции, необходимые для подготовки исходных реагентов к проведению химической реакции. Реагенты переводят, в частности, в наиболее реакционноспособное состояние. Например, известно, что скорость химических реакций сильно зависит от температуры, поэтому часто реагенты до проведения реакции нагревают. Газообразное сырье для повышения эффективности процесса и уменьшения размеров аппаратуры подвергают компримированию до определенного давления. Чтобы устранить побочные явления и получить продукт высокого качества, исходное сырье подвергают очистке от посторонних примесей, пользуясь методами, основанными на различии физических свойств (растворимость в различных растворителях, плотность, температуры конденсации и кристаллизации и т. д.). При очистке сырья и реакционных смесей широко применяют явления тепло - и массообмена, гидромеханические процессы. Могут быть использованы и химические методы очистки, основанные на химических реакциях, в результате которых ненужные примеси превращаются в легко отделимые вещества.
Соответствующим образом подготовленные реагенты на следующей стадии подвергают химическому взаимодействию, которое может состоять из нескольких этапов. В промежутках между этими этапами иногда необходимо вновь использовать тепломассообменные и другие физические процессы. Например, при производстве серной кислоты диоксид серы частично окисляют до триоксида, затем реакционную смесь охлаждают, извлекают из нее путем абсорбции триоксид серы и вновь направляют ее на окисление.
В результате химических реакций получают смесь продуктов (целевых, побочных, попутных) и не прореагировавших реагентов. Заключительные операции последней стадии связаны с разделением этой смеси, для чего вновь применяют гидромеханические, тепло - и массообменные процессы, например: фильтрование, центрифугирование, ректификацию, абсорбцию, экстракцию и т. д. Продукты реакции направляют на склад готовой продукции или на дальнейшую переработку; не прореагировавшее сырье вновь используют в процессе, организуя его рецикл.
На всех этапах, а особенно на заключительных, проводят также рекуперацию вторичных материальных и энергетических ресурсов. Потоки газообразных и жидких веществ, попадающих в окружающую среду, подвергают очистке и обезвреживанию от опасных примесей. Твердые отходы либо направляют на дальнейшую переработку, либо размещают для хранения в безопасных для окружающей среды условиях.
Таким образом, химико-технологический процесс в целом – это сложная система, состоящая из единичных связанных между собой процессов (элементов) и взаимодействующая с окружающей средой.
Элементами химико-технологической системы являются перечисленные выше процессы тепло - и массообмена, гидромеханические, химические и т. д. Их рассматривают как единичные процессы химической технологии.
Важной подсистемой сложного химико-технологического процесса является химический процесс.
Химический процесс представляет собой одну или несколько химических реакций, сопровождаемых явлениями переноса теплоты, массы и импульса, оказывающих влияние как друг на друга, так и на протекание химической реакции.
Анализ единичных процессов, их взаимного влияния позволяет разработать технологический режим.
Технологическим режимом называется совокупность технологических параметров (температуры, давления, концентраций реагентов и т. д.), определяющих условия работы аппарата или системы аппаратов (технологической схемы).
Оптимальные условия ведения процесса – это сочетание основных параметров (температуры, давления, состава исходной реакционной смеси и т. д.), позволяющее получить наибольший выход продукта с высокой скоростью или обеспечить наименьшую себестоимость при соблюдении условий рационального использования сырья и энергии и минимизации возможного ущерба окружающей среде.
Единичные процессы протекают в различных аппаратах – химических реакторах, абсорбционных и ректификационных колоннах, теплообменниках и т. д. Отдельные аппараты соединены в технологическую схему процесса.
Технологическая схема – рационально построенная система единичных аппаратов, соединенных различными видами связей (прямых, обратных, последовательных, параллельных), позволяющая получить заданный продукт заданного качества из природного сырья или полуфабрикатов.
Технологические схемы бывают открытыми и закрытыми, могут содержать байпасные (обводные) потоки и рециклы, позволяющие повышать эффективность функционирования химико-технологической системы в целом.
Разработка и построение рациональной технологической схемы – важная задача химической технологии.
§ 1.1. Классификация химических реакций,
лежащих в основе промышленных
химико-технологических процессов
В современной химии известно большое число различных химических реакций. Многие из них осуществляются в промышленных химических реакторах и, следовательно, становятся объектом изучения химической технологии.
Чтобы облегчить изучение близких по природе явлений, в науке принято их классифицировать по общим признакам. В зависимости от того, какие признаки взяты при этом за основу, существует несколько видов классификации химических реакций.
Важным видом классификации является классификация по механизму осуществления реакции. Различают простые (одностадийные) и сложные (многостадийные) реакции, в частности параллельные, последовательные и последовательно-параллельные.
Простыми называют реакции, для осуществления которых требуется преодоление лишь одного энергетического барьера (одна стадия).
Сложные реакции включают в себя несколько параллельных или последовательных стадий (простых реакций).
Реальные одностадийные реакции встречаются чрезвычайно редко. Однако некоторые сложные реакции, проходящие через ряд промежуточных стадий, удобно считать формально простыми. Это возможно в тех случаях, когда промежуточные продукты реакции в условиях рассматриваемой задачи не обнаруживаются.
Классификация реакций по молекулярности учитывает, сколько молекул участвует в элементарном акте реакции; различают моно-, би - и тримолекулярные реакции.
Вид кинетического уравнения (зависимости скорости реакции от концентраций реагентов) позволяет проводить классификацию по порядку реакции. Порядком реакции называется сумма показателей степеней у концентраций реагентов в кинетическом уравнении. Существуют реакции первого, второго, третьего, дробного порядков.
Химические реакции различают также по тепловому эффекту. При протекании экзотермических реакций, сопровождающихся выделением теплоты (Q > 0), происходит уменьшение энтальпии реакционной системы (∆H < 0); при протекании эндотермических реакций, сопровождающихся поглощением теплоты (Q < 0), происходит увеличение энтальпии реакционной системы (∆H > 0).
Для выбора конструкции химического реактора и способов управления проведением процесса существенное значение имеет фазовый состав реакционной системы.
В зависимости от того, сколько (одну или несколько) фаз образуют исходные реагенты и продукты реакции, химические реакции делят на гомофазные и гетерофазные.
Гомофазными называют реакции, в которых исходные реагенты, стабильные промежуточные вещества и продукты реакции находятся в пределах одной фазы.
Гетерофазными называют реакции, в которых исходные реагенты, стабильные промежуточные вещества и продукты реакции образуют более чем одну фазу.
В зависимости от зоны протекания реакции делятся на гомогенные и гетерогенные реакции.
Понятия «гомогенная» и «гетерогенная» реакции не совпадают с понятиями «гомофазный» и «гетерофазный» процессы. Гомогенность и гетерогенность реакции отражает в определенной степени ее механизм: протекает ли реакция в объеме какой-то одной фазы или на поверхности раздела фаз. Гомофазность и гетерофазность процесса позволяют лишь судить о фазовом составе участников реакции.
В случае гомогенных реакций реагенты и продукты находятся в одной фазе (жидкой или газообразной) и реакция протекает в объеме этой фазы. Например, окисление оксида азота кислородом воздуха в производстве азотной кислоты – газофазная реакция, а реакции этерификации (получение эфиров из органических кислот и спиртов) – жидкофазные.
При протекании гетерогенных реакций, по меньшей мере, один из реагентов или продуктов находится в фазовом состоянии, отличающемся от фазового состояния остальных участников, и при ее анализе обязательно должна учитываться поверхность раздела фаз. Например, нейтрализация кислоты щелочью – это гомофазный гомогенный процесс. Каталитический синтез аммиака – это гомофазный гетерогенный процесс. Окисление углеводородов в жидкой фазе газообразным кислородом представляет собой гетерофазный процесс, но протекающая химическая реакция является гомогенной. Гашение извести СаО + Н2О ![]() Са(ОН)2, при котором, все три участника реакции образуют отдельные фазы, а реакция идет на границе раздела воды и оксида кальция, является гетерофазным гетерогенным процессом.
Са(ОН)2, при котором, все три участника реакции образуют отдельные фазы, а реакция идет на границе раздела воды и оксида кальция, является гетерофазным гетерогенным процессом.
В зависимости от того, применяются или не применяются для изменения скорости реакции специальные вещества – катализаторы, различают каталитические и некаталитические реакции и соответственно химико-технологические процессы. Подавляющее большинство химических реакций, на которых основаны промышленные химико-технологические процессы, – это каталитические реакции.
§ 1.2. Стехиометрия химических реакций
Для описания химических реакций, лежащих в основе промышленных химико-технологических процессов, используют основные законы химии – законы стехиометрии, химического равновесия, химической кинетики. В гл. 2 и 3 рассмотрены основные принципы использования законов химической термодинамики и химической кинетики в технологии. В этом параграфе кратко изложены основы использования законов стехиометрии.
Стехиометрия – это учение о соотношениях масс или объемов реагирующих веществ. В основе стехиометрии лежат законы Авогадро, Гей-Люссака, а также сохранения массы, эквивалентов, постоянства состава, кратных соотношений.
Соотношения, в которых вещества вступают в реакцию, называют стехиометрическими. Законы стехиометрии в химии могут быть использованы в расчетах, связанных с формулами веществ, а также с нахождением теоретически возможных масс получающихся продуктов реакции.
Стехиометрическое уравнение реакции отвечает законам сохранения. Оно может быть записано как в привычном виде (слева – реагенты, справа – продукты)
аА + bВ = rR + sS, (I)
так и в соответствии с алгебраическими правилами в виде
–аА – bВ + rR + sS = 0 (II)
или еще в более общем виде
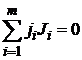 . (1.1)
. (1.1)
В такой записи знак стехиометрического коэффициента ji позволяет определить, является ли данное вещество реагентом (тогда стехиометрический коэффициент отрицателен: ji < 0) или продуктом реакции (тогда ji > 0).
Если реакция сложная и состоит из п независимых последовательных или параллельных стадий, то стехиометрия реакции может быть выражена системой из п уравнений типа уравнения (1.1):
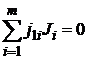 ;
;
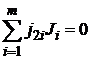 ; (1.2)
; (1.2)
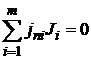 .
.
В соответствии с алгебраическими правилами каждое из этих уравнений может быть умножено на любую константу (кроме нуля) и смысл этих уравнений не изменится.
Если при стехиометрических расчетах количество вещества выражают в молях, то они сводятся к сравнительно простым стехиометрическим балансам. Например, если протекает реакция
2А + В ![]() 2R, (III)
2R, (III)
то в соответствии с законами стехиометрии всегда на каждые 2 моль вступившего в реакцию вещества А одновременно вступит в реакцию 1 моль вещества В и образуется 2 моль продукта R.
Если исходные количества участников реакции (I) составляют nA,0, nB,0 и nR,0, а текущие количества пА, пB и nR, то для любого момента времени будут справедливы как стехиометрические соотношения
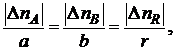
так и другие вытекающие из них соотношения, называемые стехиометрическими балансами, например
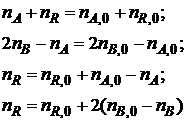
и др.
Следует иметь в виду, что для стехиометрических расчетов и составления стехиометрических балансов не имеет значения, является реакция обратимой или необратимой. Стехиометрический расчет ведется в предположении, что реакция может пройти до конца.
Стехиометрические балансы позволяют решить задачу о количестве независимых реакций в случае протекания сложных многостадийных реакций. При анализе механизма протекания таких реакций важно выделить независимые реакции, которые не могут быть получены простым алгебраическим суммированием двух или большего количества отдельных стадий.
§ 1.3. Технологические критерии эффективности
химико-технологического процесса
Об эффективности осуществления любого промышленного процесса судят прежде всего по экономическим показателям, таким, как приведенные затраты, себестоимость продукции и т. д. Естественно, что окончательная оценка эффективности химико-технологического процесса выводится из этих критериев. Однако они характеризуют весь процесс в целом, его конечный результат, не входя в детальное рассмотрение внутренней сущности, особенностей процесса.
Для оценки эффективности отдельных этапов процесса необходимо помимо общих экономических показателей использовать такие критерии эффективности, которые более полно отражали бы химическую и физико-химическую сущность явлений, происходящих в отдельных аппаратах технологической схемы.
В качестве таких показателей принято, прежде всего, использовать степень превращения исходного реагента, выход продукта, селективность. Они с разных сторон характеризуют полноту использования возможностей осуществления конкретной химической реакции.
Степень превращения. Степень превращения реагента показывает, насколько полно в химико-технологическом процессе используется исходное сырье.
Степень превращения – это доля исходного реагента, использованного на химическую реакцию.
Степень превращения реагента J
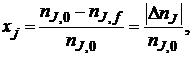
где nJ, 0 – количество реагента J в исходной реакционной смеси;
пJ, f – количество реагента J в реакционной смеси, выходящей из аппарата или находящейся в реакторе; ∆nJ – изменение количества реагента J в ходе химической реакции.
Чаще всего в химической реакции участвует не один, а два реагента (или даже больше). Степень превращения может быть рассчитана по первому, второму или третьему реагенту, причем в общем случае не обязательно получаются равные результаты.
Если протекает реакция (I), то в соответствии с ее стехиометрическим уравнением изменения количеств ее участников ∆nJ связаны между собой следующими соотношениями:
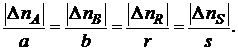 (1.3)
(1.3)
Степени превращения реагентов А и В, участвующих в реакции (I):
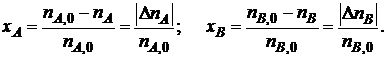 (1.4)
(1.4)
Из уравнений (1.3) и (1.4) следует
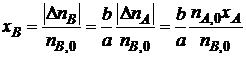 ,
,
или 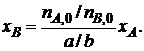 (1.5)
(1.5)
Уравнение (1.5) устанавливает связь между степенями превращения реагентов А и В и позволяет рассчитать неизвестную степень превращения одного реагента, зная степень превращения другого.
Если 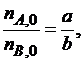 т. е. реагенты А и В взяты для проведения реакции в стехиометрическом соотношении (количество реагентов А и В соотносится между собой как соответствующие этим веществам стехиометрические коэффициенты в уравнении реакции), то степени превращения хА и хВ равны между собой: хА = хВ.
т. е. реагенты А и В взяты для проведения реакции в стехиометрическом соотношении (количество реагентов А и В соотносится между собой как соответствующие этим веществам стехиометрические коэффициенты в уравнении реакции), то степени превращения хА и хВ равны между собой: хА = хВ.

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 |



