|
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
Государственное образовательное учреждение
высшего профессионального образования
«Самарский государственный технический университет»
________________________________________________________________________________
ОКИСЛЕНИЕ
Практикум
Самара 2006
УДК 547.057
Окисление: Практикум / , ; Самар. гос. техн. ун-т. Самара, 2006. 90с.
Рассмотрены методы окисления различных классов органических соединений. Обсуждается механизм большинства реакций окисления. Представлены характеристики основных окислителей, используемых в органическом синтезе. Приводятся методики окисления спиртов, фенолов, альдегидов, кетонов и ароматических углеводородов.
Для студентов химико-технологических и химических специальностей.
SBN -1
Библиогр.: 11 назв.
Печатается по решению редакционно-издательского совета Самарского государствен-ного технического университета
Рецензент: канд. хим. наук
ISBN 5-7964-
Ó , , 2006
Ó Самарский государственный технический университет, 2006
ОГЛАВЛЕНИЕ
Введение………………………………………………………………….. | 4 |
1. Характеристика некоторых окислителей………………………… | 5 |
2. Окисление алканов и циклоалканов……………………………… | 11 |
3. Окисление алкенов…………………………………………………... | 14 |
3.1. синтез эпоксидов…………………………………………………….. | 14 |
3.2. Вакер-процесс………………………………………………………... | 16 |
3.3. синтез вицинальных диолов………………………………………… | 16 |
3.4. окисление с расщеплением углеродного скелета по двойной связи. Озонирование……………..…………………………………. | 18 |
3.5. аллильное окисление алкенов………………………………………. | 21 |
4. Окисление алкинов……………………………………………........... | 22 |
5. Окисление ароматического кольца………………………………... | 22 |
5.1. гидроксилирование аренов………………………………..………… | 23 |
5.2. синтез хинонов………………………………………………………. | 24 |
5.3. окислительное расщепление аренов……………………………..…. | 27 |
5.4. окисление боковых цепей в ароматических соединениях………... | 28 |
5.5. окислительное сочетание фенолов…………………………………. | 32 |
5.6. окисление одноатомных фенолов в двухатомные…………..…….. | 34 |
6. Окисление галогенпроизводных углеводородов………………… | 34 |
7. Окисление одноатомных спиртов………………………………….. | 36 |
8. Расщепление α-гликолей и родственных соединений…………... | 42 |
9. Окисление альдегидов………………………………………………. | 44 |
10. Окисление кетонов…………………………………………………. | 47 |
11. Окисление карбоновых кислот…………………………………… | 53 |
12. Окисление простых эфиров……………………………………….. | 56 |
13. Окисление эпоксидов………………………………………………. | 57 |
14. Окисление серосодержащих соединений………………………… | 58 |
14.1. окисление тиолов…………………………………………………... | 58 |
14.2. окисление сульфидов………………………………………………. | 58 |
15. Окисление азотсодержащих соединений………………………… | 60 |
15.1. окисление аминов………………………………………………….. | 60 |
15.2. окисление гидразинов, гидразонов, оксимов, гидроксиламинов и азобензолов………………………………………………………. | 63 |
16. Приготовление некоторых окислителей………………………… | 66 |
17. Экспериментальная часть…………………………………………. | 69 |
18. Вопросы и упражнения для самоконтроля……………………… | 85 |
Библиографический список…………………………………………… | 88 |
ВВЕДЕНИЕ
Под окислением в органической химии понимают процессы, приводящие к обеднению соединения водородом или обогащению его кислородом. При этом происходит отнятие от молекулы электронов. Соответственно, под восстановлением понимают отрыв от органической молекулы кислорода или присоединение к ней водорода.
В окислительно-восстановительных реакциях окислителями являются соединения, обладающие большим сродством к электрону (электрофилы), а восстановителями – соединения, имеющие склонность к отдаче электронов (нуклеофилы). Легкость окисления соединения возрастает вместе с ростом его нуклеофильности.
При окислении органических соединений, как правило, полной передачи электронов и соответственно изменения валентности атомов углерода не происходит. Поэтому понятие степени окисления – условного заряда атома в молекуле, вычисленного, исходя из предположения, что молекула состоит только из ионов – носит лишь условный, формальный характер.
При составлении уравнений окислительно-восстановительных реакций необходимо определить восстановитель, окислитель и число отдаваемых и принимаемых электронов. Как правило, коэффициенты подбирают, используя метод электронно-ионного баланса (метод полуреакций).
В этом методе рассматривают переход электронов от одних атомов или ионов к другим с учетом характера среды (кислая, щелочная или нейтральная), в которой протекает реакция. Для уравнивания числа атомов кислорода и водорода вводят или молекулы воды и протоны (если среда кислая), или молекулы воды и гидроксид-ионы (если среда щелочная).
Таким образом, при написании полуреакций восстановления и окисления нужно исходить из состава ионов, действительно имеющихся в растворе. Вещества малодиссоциирующие, плохо растворимые или выделяющиеся в виде газа следует писать в молекулярной форме.
В качестве примера рассмотрим процесс окисления этилена разбавленным водным раствором перманганата калия. В ходе данной реакции этилен окисляется до этиленгликоля, а перманганат калия восстанавливается до диоксида марганца:
С2H4 + KMnO4 → C2H6O2 + MnO2
![]() Полуреакция восстановления: MnO4¯ + 2H2O + 3e → MnO2 + 4OH¯ 2
Полуреакция восстановления: MnO4¯ + 2H2O + 3e → MnO2 + 4OH¯ 2
Полуреакция окисления: С2H4 + 2OH− − 2e → C2H6O2 3
Окончательно имеем в ионном виде:
2MnO4¯ + 4H2O + 3C2H4 + 6OH¯ → 2MnO2 + 8OH¯ + 3C2H6O2
После проведения необходимых сокращений подобных членов, записываем уравнение в молекулярном виде:
3C2H4 + 2KMnO4 + 4 H2O = 3C2H6O2 + 2MnO2 + 2KOH.
1. ХАРАКТЕРИСТИКА НЕКОТОРЫХ ОКИСЛИТЕЛЕЙ
Кислород
Кислород воздуха находит широкое применение в технологических процессах, так как является наиболее дешевым окислителем. Но окисление кислородом воздуха сопряжено с трудностями, связанными с контролем процесса, который протекает в различных направлениях. Окисление обычно проводят при высокой температуре в присутствии катализаторов.
Озон
Озон O3 применяют для получения альдегидов и кетонов, если их затруднительно получить другими способами. Чаще всего озон применяют для установления структуры ненасыщенных соединений. Получают озон при действии тихого электрического разряда на кислород.
Перманганат калия
Перманганат калия – наиболее часто применяемый окислитель. Реактив растворим в воде (6.0% при 20ºС), а также в метаноле, ацетоне и уксусной кислоте. Для окисления применяют водные (иногда ацетоновые) растворы KMnO4 в нейтральной, кислой или щелочной среде. При проведении процесса в нейтральной среде в реакционную массу добавляют соли магния, алюминия или пропускают углекислый газ для нейтрализации выделяющегося во время реакции гидроксида калия. Реакцию окисления KMnO4 в кислой среде чаще всего ведут в присутствии серной кислоты. Щелочную среду при окислении создает образующийся во время реакции KOH, либо его изначально добавляют в реакционную массу. В слабощелочной и нейтральной средах KMnO4 окисляет по уравнению:
KMnO4 + 3e + 2H2O = K+ + MnO2 + 4OH¯
в кислой среде:
KMnO4 + 5e + 8H+ = K+ + Mn2+ + 4H2O
Перманганат калия используется для получения 1,2-диолов из алкенов, при окислении первичных спиртов, альдегидов и алкиларенов до карбоновых кислот, а также для окислительного расщепления углеродного скелета по кратным связям.
На практике обычно используется довольно большой избыток (более чем 100%) KMnO4. Это объясняется тем, что в обычных условиях KMnO4 частично разлагается на диокид марганца с выделением O2. Раствор KMnO4 в 0.08 М серной кислоте разлагается в 20 раз быстрее, чем нейтральный раствор. Однако щелочная среда, как и присутствие диоксида марганца, также ускоряет распад.
Окислители на основе Cr(VI)
Наиболее часто используется оксид хрома (VI) и хромовая смесь. Смесь, состоящая из 1 моля дихромата, 4 молей серной кислоты и соответствующего количества воды, называется хромовой смесью Бекмана (из K2Cr2O7) или Килиани (из Na2Cr2O7). Окисление проводят как на холоду, так и при повышенной температуре. Окрашивание реакционной массы в зеленый цвет (Cr3+) указывает на окончание реакции. 100 г хромовой смеси Бекмана (состоящей из 60 г K2Cr2O7, 80 г конц. H2SO4 и 270 г воды) соответствует 2.4 г активного кислорода. Окисление дихроматами в кислой среде протекает согласно уравнению:
Cr2O72- + 14H+ + 6e = 2Cr3+ + 7H2O
Окисление соединениями Cr(VI) используют для синтеза ароматических кислот из соответствующих алкилбензолов, хинонов из анилинов, дигидроксибензолов, нафталинов и антраценов, карбоновых кислот из первичных спиртов и кетонов из вторичных.
Азотная кислота
Азотная кислота представляет собой бесцветную жидкость с плотностью 1.526 г/см3 при 15ºС, т. пл. -42ºС, т. кип. 83.8ºС. При перегонке обычной продажной кислоты вначале отгоняется вода, а при 120.5ºС отгоняется азеотроп (пл. 1.40), содержащий около 70% HNO3. Усиление окисляющего действия азотной кислоты достигается прибавлением катализаторов (солей железа, ртути, солей молибденовой и ванадиевой кислот, нитритов). Окисление обычно проводят в растворителях, инертных к действию HNO3, например, хлорбензоле, нитробензоле, дихлорметане и др. При использовании азотной кислоты необходимо иметь в виду, что наряду с реакцией окисления может иметь место и реакция нитрования.
Концентрированную (65-95%-ную) азотную кислоту применяют для окислительного расщепления кратных углерод-углеродных связей, получения соответствующих карбоновых кислот из альдегидов и первичных спиртов, синтеза двухосновных кислот из алициклических спиртов и кетонов.
Разбавленную (10-25%-ную) азотную кислоту используют при окислении метиленовой группы в диарилметанах в карбонильную, при окислении альдегидной или первичной спиртовой группы в моносахаридах в карбоксильную, превращении бензиловых спиртов в соответствующие кислоты ароматического ряда и др.
Гипохлориты, хлораты и броматы
Окисление гипохлоритами проводят обычно в щелочной среде. Раствор гипохлорита натрия приготовляют насыщением раствора NaOH хлором при 0ºС или из продажного гипохлорита кальция:
Ca(ClO)2 + Na2CO3 → CaCO3↓ + 2 NaClO
Окисление происходит за счет выделяющегося атома кислорода:
NaOCl = NaCl + [O]
Из хлоратов наиболее часто используют соли натрия или калия в нейтральных или слабокислых растворах. Окисляемое вещество в виде раствора (например, в уксусной кислоте) или в виде взвеси в воде нагревают с водным раствором окислителя до температуры немного выше 40ºС. В некоторых случаях окисление ведут в присутствии катализаторов (соли Сu, Fe, Cr, V, Ce, Os, Ru).
Из соединений брома в качестве окислителя часто используется бромат калия KBrO3, например, при синтезе хинонов из двухатомных фенолов.
Персульфаты
При окислении в нейтральной среде взвесь окисляемого вещества в водном растворе персульфата нагревают до кипения при перемешивании. При окислении в щелочной среде персульфат добавляют к щелочному раствору окисляемого вещества. При окислении в кислой среде персульфат добавляют к раствору окисляемого вещества в кислоте в присутствии каталитических количеств солей серебра.
В качестве окислителей чаще всего используют персульфаты калия, натрия и аммония. Пероксодисульфат калия K2S2O8 при температуре около 100ºС начинает разлагаться с выделением кислорода, растворим в воде (5.03% при 20ºС).
Кислота Каро
Кислота Каро H2SO5 (мононадсерная кислота) получается действием серной кислоты на персульфат калия или натрия при 0ºС:
K2S2O8 + H2SO4 + H2O = H2SO5 + 2 KHSO4
Водный раствор кислоты постепенно гидролизуется с образованием серной кислоты и пероксида водорода; раствор кислоты Каро в конц. серной кислоте также постепенно разлагается с выделением O2 и O3.
Мононадсерную кислоту применяют для избирательного окисления ароматических аминов в нитрозосоединения, а также для окисления кетонов в сложные эфиры.
Надкислоты
Перуксусную и пермуравьиную кислоты получают реакцией 25-90%-ного пероксида водорода с соответствующей карбоновой кислотой по следующей реакции:
RCOOH + H2O2 = RCOOOH + H2O
В случае уксусной кислоты это равновесие устанавливается относительно медленно, и для ускорения образования перкислоты обычно в качестве катализатора добавляют серную кислоту. Муравьиная кислота достаточно сильна сама по себе для того, чтобы обеспечить быстрое установление равновесия.
Пертрифторуксусная кислота, получаемая в смеси с трифторуксусной кислотой реакцией трифторуксусного ангидрида с 90%-ным пероксидом водорода, еще более сильный окислитель. Аналогичным образом из уксусного ангидрида и пероксида водорода можно получить перуксусную кислоту.
Особой популярностью пользуется твердая м-хлорпербензойная кислота, поскольку она относительно безопасна в обращении, достаточно стабильна и может храниться длительное время.
Окисление происходит за счет выделяющегося атома кислорода:
RCOOOH = RCOOH + [O]
Надкислоты применяют для получения эпоксидов из алкенов, а также лактонов из алициклических кетонов.
Тетраацетат свинца
Тетраацетат свинца получается при нагревании свинцового сурика в уксусной кислоте по уравнению:
Pb3O4 + 8 CH3COOH = Pb(CH3COO)4 + 2 Pb(CH3COO)2
В процессе окисления тетраацетат свинца отщепляет две ацетоксигруппы:
Pb(CH3COO)4 + 2e = Pb(CH3COO)2 + 2 CH3COO¯
Окисление проводят в растворе уксусной кислоты или в виде взвеси в бензоле.
Тетраацетат свинца применяют для окислительного расщепления α-гликолей в карбонильные соединения, а также для окисления по бензильному положению.
Иодная кислота и ее соли
HIO4·2H2O представляет собой бесцветные сильно гигроскопичные кристаллы, хорошо растворимые в воде, растворимые в этаноле и мало растворимые в диэтиловом эфире. Выше температуры плавления (122ºС) кислота разлагается. Водный раствор на воздухе желтеет и сильно пахнет озоном. Окисление обычно ведут в водных растворах или в растворе метанола, диоксана или уксусной кислоты.
Иодную кислоту, а также ее соли периодат калия KIO4 и натрия NaIO4 применяют в основном для окисления 1,2-диолов в соответствующие карбонильные соединения.
Диоксид селена
SeO2 представляет собой белое кристаллической вещество; на воздухе, соприкасаясь с пылью, окрашивается в красноватый цвет вследствие восстановления до металлического селена, гигроскопичен, выше 300ºС возгоняется. Диоксид селена обладает избирательностью окислительного действия. SeO2 растворим в органических растворителях и окисление проводят обычно в водном спирте или водном диоксане.
SeO2 = Se + 2 [O]
Окисление сопровождается выделением из реакционной массы красноватого осадка селена.
Диоксид селена избирательно окисляет активированные метильные и метиленовые группы, находящиеся по соседству с карбонильной группой или двойной связью.
Пероксид водорода
Пероксид водорода – бесцветная жидкость, cмешивается с водой, этанолом и диэтиловым эфиром. 30%-ный раствор H2O2 называется пергидролем. Высококонцентрированный препарат может реагировать с органическими веществами со взрывом. При хранении разлагается на кислород и воду. Стойкость пероксида водорода возрастает с разбавлением. Для окисления применяют водные растворы различной концентрации (от 3 до 90%) в нейтральной, кислой или щелочной средах.
H2O2 = H2O + [O]
Действием этого реагента на α,β-непредельные карбонильные соединения в щелочной среде получают соответствующие эпоксиальдегиды и кетоны, окислением карбоновых кислот в кислой среде синтезируют надкислоты. 30%-ный раствор H2O2 в уксусной кислоте окисляет алкены в 1,2-диолы.
Оксид серебра
Оксид серебра (I) получают из нитрата серебра и раствора гидроксида натрия, выделившийся осадок часто затем растворяют в избытке аммиака и получают аммиачный комплекс [Ag(NH3)2]OH, растворимый в воде (реактив Толленса). Аммиачный раствор оксида серебра нельзя долго хранить, так как при стоянии образуется взрывчатый нитрид серебра Ag3N. Окисление протекает по схеме:
Ag2O = 2 Ag + [O]
Раствор, приготовленный из 12 г AgNO3, 20 г NaOH и 52 мл 25%-ного аммиака, соответствует 0.564 г активного кислорода.
Оксид серебра применяют для превращения в соответствующие карбоновые кислоты альдегидов, содержащих помимо карбонильных другие чувствительные к окислению группировки, а также для получения хинонов из многоатомных фенолов.
Диоксид свинца
Диоксид свинца PbO2 получают непосредственно перед применением действием хлорной извести на нитрат или ацетат свинца (II):
Pb(NO3)2 + CaOCl2 + H2O = PbO2 + 2 HNO3 + CaCl2
Окисление проводят в слабокислой среде.
Ароматические амины и двухатомные фенолы окисляются диоксидом свинца в соответствующие хиноны. Чаще всего реагент используют для окисления в бензиловые спирты ди - и триарилметанов.
Диоксид марганца
Диоксид марганца MnO2 представляет собой порошок черного цвета нерастворимый в воде. Используется в основном для селективного окисления аллиловых и пропаргиловых спиртов в альдегиды и кетоны в нейтральной среде, а также в реакциях дегидрирования и окисления азотсодержащих соединений.
Тетраоксиды рутения и осмия
Тетраоксид осмия OsO4 – порошок от белого до бледно-желтого цвета с т. пл. 40.6ºС; т. кип. 131.2ºС. Возгоняется уже при комнатной температуре, растворим в воде (7.47 г в 100 мл при 25ºС), ССl4 (250 г в 100 г растворителя при 20ºС). В присутствии органических соединений чернеет вследствие восстановления до OsO2.
RuO4 представляет собой золотисто-желтые призмы с т. пл. 25.4ºС, заметно возгоняется при комнатной температуре. Умеренно растворим в воде (2.03 г в 100 мл при 20ºС), очень хорошо растворим в CCl4. Более сильный окислитель, чем OsO4. Выше 100ºС взрывается. Как и тетраоксид осмия обладает большой токсичностью и высокой стоимостью.
Данные окислители применяются для окисления алкенов в α-гликоли в мягких условиях.
Нитрат аммония-церия (IV)
(NH4)2[Ce(NO3)6] представляет собой оранжево-красные кристаллы, хорошо растворимые в воде (58.5% при 25ºС) и этаноле. Используется для окисления замещенных толуолов в бензальдегиды.
Диметилсульфоксид (ДМСО)
Диметилсульфоксид (CH3)2SO – бесцветная гигроскопичная жидкость с т. пл. 18.5ºС и т. кип. 189ºС. При кипячении при атмосферном давлении постепенно диспропорционирует на диметилсульфид и диметилсульфон, поэтому перегоняют его в вакууме.
ДМСО (в комбинации с различными электрофильными агентами) широко используется для окисления спиртов, алкилгалогенидов, оксиранов и др.
Диоксираны
Наиболее часто используются диметилдиоксиран и метил(трифторметил)-диоксиран.
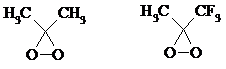
Диоксираны чаще всего получают in situ из соответствующих кетонов и KHSO5 (или K2SO4·KHSO4·2KHSO5 (оксона)) в слабощелочной среде:
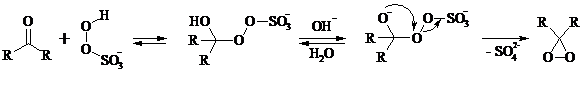
Диоксираны отличаются высокой реакционной способностью, сочетающейся с хорошей селективностью, и используются для окисления неактивированных С–Н-связей в алканах, при получении эпоксидов из алкенов, для окисления аминов, оксимов, сульфидов, сульфоксидов и др.
Помимо вышеперечисленных окислителей в органическом синтезе используется и ряд других соединений: молекулярная сера, селен, хлоранил (2,3,5,6-тетрахлор-1,4-бензохинон), 2,3-дихлор-5,6-дициано-1,4-бензохинон (в реакциях дегидрирования), пероксид никеля NiO2, пероксид калия K2O2, пербораты, галогены, N-бромсукцинимид (NBS), соли ртути (II), меди (II) и железа (III), ацетат и нитрат таллия (III), висмутат натрия NaBiO3, Mn(CH3COO)3, Ag2CO3 на целите и др.
2. ОКИСЛЕНИЕ АЛКАНОВ И ЦИКЛОАЛКАНОВ
Окисление алканов и циклоалканов протекает по радикальному механизму. Окисление проводят молекулярным кислородом в присутствии различных катализаторов (соли Mn, Co, Cr, Fe, V2O5 и др.). Первичными продуктами окисления являются гидропероксиды ROOH. Взаимодействие кислорода с молекулой алкана происходит по всем возможным направлениям, но преимущественно затрагивается третичный атом углерода. Окисление протекает по схеме:
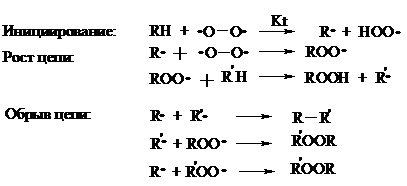
В условиях проведения процесса окисления гидропероксиды обычно подвергаются разложению, причем первоначально происходит разрыв наиболее слабой связи O–O.
![]()
Разложение третичных гидропероксидов сопровождается отщеплением одного из радикалов и образованием кетонов:
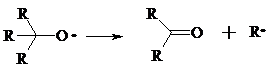
Разложение вторичных гидропероксидов зависит от температурных условий. При низкой температуре образуется смесь альдегида и кетона:
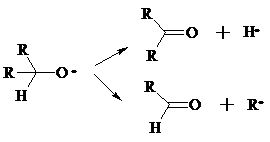
при высокой температуре основными продуктами являются альдегиды:
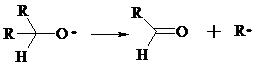
Первичные гидропероксиды дают при разложении смесь альдегидов:
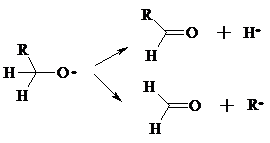
Кроме карбонильных соединений при разложении гидропероксидов образуются и спирты в результате отрыва атома водорода от молекулы алкана алкоксидным радикалом:
![]()
Образующиеся карбонильные соединения и спирты могут далее окисляться до карбоновых кислот.
Природные газы и низкокипящие фракции нефти при окислении под большим давлением (10-20 МПа) в присутствии металлических катализаторов и температуре 390-400°С дают метанол в качестве главного продукта реакции:
CH4 + O2 → CH3OH
Бутан окисляют в уксусную кислоту кислородом воздуха в присутствии ацетата кобальта (II), выход уксусной кислоты составляет 50%:
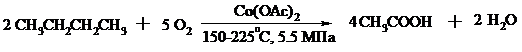
В промышленности также используют и окисление высших алканов кислородом воздуха при 100-150°С в присутствии ацетата марганца как катализатора. Окисление происходит при продувании тока воздуха через расплавленный парафин, содержащий соль марганца. В результате разрыва углерод-углеродной связи образуется сложная смесь кислот с нормальной цепью:
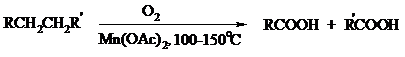
Кислоты отделяют от непрореагировавшего парафина растворением в водной щелочи с последующей нейтрализацией минеральной кислотой.
Циклоалканы окисляются в основном подобно алканам. Так, например, превращение циклогексана в циклогексилгидропероксид под действием кислорода в присутствии солей кобальта происходит по радикальному механизму, где роль инициатора цепного процесса выполняет кислород:
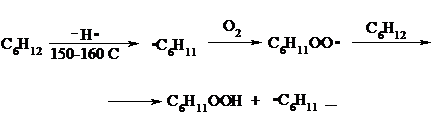
Образующийся из гидропероксида под действием соли кобальта (II) алкоксильный радикал далее превращается в циклогексанол:

или циклогексанон:

Возможны, однако, и другие реакции с участием алкоксильного радикала, например b-распад, сопровождающийся раскрытием шестичленного цикла:
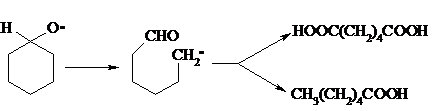
Циклогексанол и циклогексанон могут также подвергаться дальнейшему окислению с раскрытием цикла и образованием, в частности, адипиновой кислоты.
С помощью диоксиранов алканы и циклоалканы могут быть селективно окислены по третичному атому углерода с образованием спиртов:
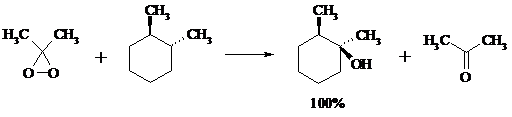
Первичные и вторичные неактивированные С–Н-связи алканов также могут подвергаться окислению по действием диоксирана в присутствии трифторуксусного ангидрида.
3. ОКИСЛЕНИЕ АЛКЕНОВ
3.1. СИНТЕЗ ЭПОКСИДОВ
Под действием перкислот (перуксусной, пермуравьиной, м-хлорпербензойной, пертрифторуксусной и др.) алкены окисляются в α-окиси, или оксираны (реакция Прилежаева). Электронодонорные заместители при двойной связи облегчают протекание реакции. Процесс окисления протекает стереоспецифично, и α-окись сохраняет ту же конфигурацию, что и исходный алкен.
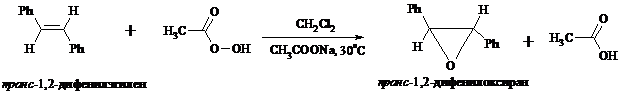
Процесс носит синхронный, согласованный характер и протекает по схеме:
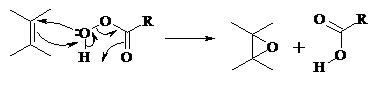
Альтернативный метод эпоксидирования заключается во взаимодействии алкена с нитрилом и 90%-ным пероксидом водорода:

Окись этилена получают прямым окислением этилена кислородом воздуха в присутствии серебра, нанесенного на оксид алюминия или карбид кремния:
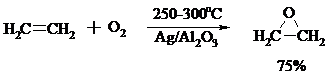
Окись этилена легко отделяется от этилена при растворении в воде с последующей перегонкой.
Все попытки получения окиси пропилена прямым окислением пропилена кислородом на серебряном катализаторе были безуспешны, поскольку окислению подвергались С-Н-связи метильной группы в аллильном положении к двойной связи. В результате был разработан альтернативный промышленный метод синтеза окиси пропилена, известный под названием халкон-процесса. В халкон-процессе пропилен окисляется до его оксида под действием трет-бутилгидропероксида. Необходимый гидропероксид образуется в результате окисления изобутана в жидкой фазе кислородом при 120-150ºС и давлении 3 МПа. Далее он реагирует с пропиленом в жидкой фазе при 120-140ºС и давлении 3.5 МПа в присутствии солей молибдена как катализатора.
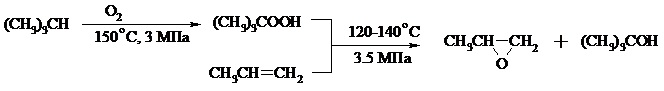
Выход окиси пропилена в расчете на пропилен составляет 90%.
Эпоксиды могут быть получены с высоким выходом при действии на алкены диоксиранов:

3.2. ВАКЕР-ПРОЦЕСС
В Вакер-процессе этилен окисляют в водном растворе хлористоводородной кислоты, содержащем хлориды палладия (II) и меди (II). Протекающие при этом реакции описываются следующими уравнениями:

или суммарно:
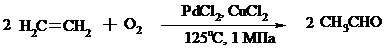
Таким образом, в процессе окисления расходуется только кислород.
Помимо этилена многие другие монозамещенные и 1,2-дизамещенные алкены окисляются в альдегиды и кетоны хлоридом палладия. В случае 1,1-дизамещенных алкенов обычно получаются неудовлетворительные результаты.
Если вместо воды в Вакер-процессе использовать уксусную кислоту, то образуется винилацетат:
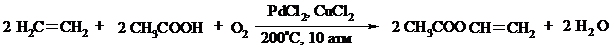
Смесь этилена и уксусной кислоты окисляется в газовой фазе в присутствии палладиевого катализатора при 200ºС и давлении 10 атм, выход винилацетата достигает 90-95%.
3.3. СИНТЕЗ ВИЦИНАЛЬНЫХ ДИОЛОВ
При взаимодействии алкенов в слабощелочной среде с разбавленным раствором KMnO4 в водных органических растворителях (ацетоне, этаноле и др.) при 0-10ºС образуются вицинальные диолы с выходами 30-75% (реакция Вагнера).
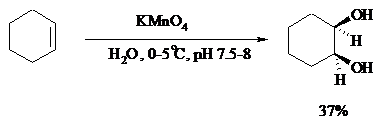
Первоначально образуется циклический эфир марганцевой кислоты, который немедленно гидролизуется до диола:

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 |




