Приемник охлаждают смесью снега с солью, так как отгоняющийся в процессе реакции изомасляный альдегид очень летуч. После прибавления всей окислительной смеси реакционную массу нагревают еще 20 мин. Дистиллят, собравшийся в приемнике, перегоняют, собирая фракцию от 59 до 69ºС. Эту фракцию перегоняют еще раз, собирают альдегид с т. кип. 61.5-62.5°С.
Выход около 19 г (61%).
Изомасляный альдегид – бесцветная жидкость с характерным запахом, т. пл. -66ºС, т. кип. 64.2-64.6ºС, d, nD20 1.3730. Смешивается с органическими растворителями, растворимость в воде 10% при 20˚С. Образует азеотропную смесь с водой (т. кип. 60.5ºС, 5% воды по массе).
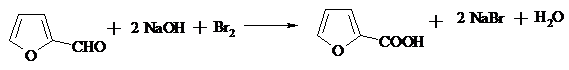
17.11. ПИРОСЛИЗЕВАЯ КИСЛОТА
Реактивы | Посуда и приборы | ||
фурфурол | 9.6 г | трехгорлая колба на 100 мл | |
гидроксид натрия | 15 г | механическая мешалка | |
бром | 5.6 мл | термометр | |
конц. соляная кислота | капельная воронка | ||
колба Бунзена | |||
воронка Бюхнера |
В трехгорлой колбе с мешалкой и термометром растворяют 15 г (0.375 моль) твердого гидроксида натрия в 50 мл воды. Охлаждают раствор до 0ºС смесью льда и соли и добавляют по каплям при перемешивании 5.6 мл (17.4 г, 0.109 моль) брома (температура реакционной смеси не должна превышать +5ºС). К полученному раствору гипобромита в течение 1 ч добавляют по каплям 9.6 г (8.3 мл, 0.1 моль) свежеперегнанного фурфурола, поддерживая температуру ниже +5ºС. Продолжают перемешивание 2 ч при той же температуре и осторожно подкисляют реакционную массу предварительно охлажденной до 0ºС концентрированной соляной кислотой до кислой реакции среды. Отфильтровывают выпавший осадок, промывают его холодной подкисленной HCl водой и высушивают сначала на воздухе, а затем в вакуум-эксикаторе над прокаленным хлористым кальцием.
Выход 8 г (65%).
Пирослизевая (фуран-2-карбоновая кислота) – бесцветное кристаллическое вещество с т. пл. 126-128ºС, возгоняется.
17.12. АНТРАХИНОН

Реактивы | Посуда и приборы | ||
антрацен | 1.25 г | круглодонная колба на 250 мл | |
уксусная кислота | 75 мл | двурогий форштос | |
хромовый ангидрид | 5 г | обратный холодильник | |
раствор карбоната натрия | капельная воронка | ||
колба Бунзена | |||
воронка Бюхнера |
В круглодонной колбе, снабженной двурогим форштосом с обратным холодильником и капельной воронкой, растворяют при кипячении 1.25 г (7 ммоль) тонко растертого антрацена в 55 мл ледяной уксусной кислоты. В течение 1 ч при постоянном кипячении прибавляют из капельной воронки раствор 5 г (50 ммоль) хромового ангидрида в 5 мл воды и 20 мл ледяной уксусной кислоты. После охлаждения реакционную смесь разбавляют 140 мл воды. Через 1 ч отфильтровывают выпавший антрахинон, промывают его водой, разбавленным раствором соды, снова водой и сушат на воздухе. Полученный сырой антрахинон перекристаллизовывают из ледяной уксусной кислоты.
Выход 1 г (70%).
Антрахинон – светло-желтые кристаллы с т. пл. 287ºС. Растворимость: в этаноле – 5% (18ºС), 22.5% (78ºС), толуоле – 1.92% (15ºС), 25.6% (100ºС), воде – 0.006% (50ºС).
17.13. ОКТАНАЛЬ
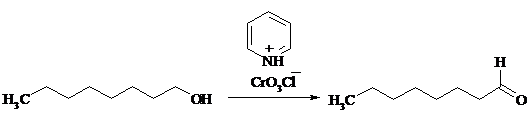
Реактивы | Посуда и приборы | ||
хлорхромат пиридиния | 32.3 г | круглодонная колба на 500 мл | |
абс. дихлорметан | 220 мл | двурогий форштос | |
октанол-1 | 13 г | механическая мешалка | |
абс. диэтиловый эфир | 350 мл | установка для простой перегонки | |
силикагель | 20 г | установка для перегонки в вакууме |
К суспензии 32.3 г (0.15 моль) хлорхромата пиридиния в 200 мл безводного дихлорметана при тщательном перемешивании в один прием прибавляют 13 г (0.1 моль) октанола-1, растворенного в 20 мл дихлорметана. Смесь перемешивают при комнатной температуре 1.5 ч.
Затем к смеси прибавляют 200 мл безводного диэтилового эфира, эфирный раствор декантируют, черный осадок промывают эфиром (3 раза по 50 мл). Объединенные эфирные фазы фильтруют через 20 г силикагеля. Растворитель отгоняют на водяной бане, а остаток фракционируют под вакуумом водоструйного насоса на колонке Вигре длиной 20 см, собирая фракцию 63-64ºС/12 мм рт. ст. Выход 10.7 г (84%).
Октаналь – бесцветная жидкость с резким запахом, при сильном разбавлении приобретает апельсиновый запах, т. пл. -27ºС, т. кип. 173ºС, 81ºС/32 мм рт. ст., d, nD20 1.4217. Растворим в большинстве органических растворителей, не растворим в воде.
17.14. ТЕРЕФТАЛЕВАЯ КИСЛОТА
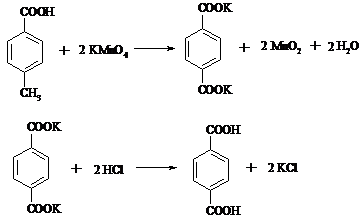
Реактивы | Посуда и приборы | ||
n-толуиловая кислота | 1 г | круглодонная колба на 100 мл | |
перманганат калия | 2.4 г | двурогий форштос | |
10%-й раствор KOH | 10 мл | капельная воронка | |
этанол | обратный холодильник | ||
конц. соляная кислота | колба Бунзена | ||
воронка Бюхнера | |||
коническая колба на 100 мл |
В круглодонной колбе, снабженной двурогим форштосом с капельной воронкой и обратным холодильником, растворяют 1 г (7.4 ммоль) n-толуиловой кислоты в разбавленном растворе гидроксида калия и при кипячении постепенно прибавляют из капельной воронки раствор 2.4 г (15.2 ммоль) KMnO4 в 50 мл воды. Смесь кипятят 3 ч.
Если малиновый цвет раствора KMnO4 не исчезнет после продолжительного кипячения, то к нему по каплям добавляют этанол. Осадок MnO2 отфильтровывают, дважды промывают его на фильтре горячей водой (по 5 мл). Объединенные фильтраты нагревают в конической колбе почти до кипения и терефталевую кислоту осаждают из раствора, прибавляя конц. соляную кислоту до кислой реакции среды. Терефталевую кислоту отфильтровывают, промывают на фильтре водой и высушивают.
Выход около 1.1 г (90%).
Терефталевая кислота – бесцветное кристаллическое вещество, при температуре выше 300ºС возгоняется, т. пл. 427ºС (в запаянном капилляре). Растворимость при 25ºС (г в 100 г растворителя): в воде – 0.0019, CH3COOH – 0.035, CH3OH – 0.1, ДМФА – 6.7, ДМСО – 20.0, H2SO4 – 2.0.
17.15. ДЕГИДРОДИВАНИЛИН

Реактивы | Посуда и приборы | ||
ванилин | 3 г | круглодонная колба на 500 мл | |
FeSO4·7H2O | 0.1 г | механическая мешалка | |
персульфат натрия | 2.5 г | колба Бунзена | |
5%-ный раствор NaOH | 20 мл | воронка Бюхнера | |
соляная кислота | химический стакан на 100 мл |
В круглодонной колбе на 500 мл, снабженной механической мешалкой, растворяют при нагревании 3 г (19.7 ммоль) ванилина в 200 мл воды, раствор охлаждают до комнатной температуры и при энергичном перемешивании прибавляют сначала 0.1 г FeSO4·7H2O, потом 2.5 г (10.5 ммоль) Na2S2O8. Через 30 мин выпавший осадок отфильтровывают и еще влажным растворяют в 20 мл 5%-ного раствора гидроксида натрия. Из полученного раствора (при необходимости фильтруют) подкислением соляной кислотой высаживают дегидродиванилин.
Выход 2.9 г (97%).
Дегидродиванилин (2,2’-дигидрокси-3,3’-диметокси-5,5’-диформилдифенил) – бесцветные кристаллы, плохо растворимые в воде и большинстве органических растворителей, т. пл. 305ºС (в запаянном капилляре 315°С).
17.16. БЕНЗАЛЬДЕГИД
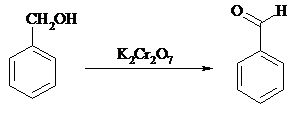
Реактивы | Посуда и приборы | ||
бензиловый спирт | 10.8 г | колба круглодонная, трехгорлая на 500 мл | |
бензол (толуол) | 160 мл | холодильник шариковый | |
дихромат калия | 29.4 г | глицериновый затвор | |
насыщенный раствор NaHCO3 | механическая мешалка | ||
двурогий форштос | |||
капельная воронка | |||
делительная воронка | |||
установка для фракционной перегонки |
В трехгорлую колбу, снабженную обратным холодильником, капельной воронкой и термометром, помещают 10.8 г (0.1 моль) бензилового спирта, 100 мл бензола (либо толуола) и 20 мл воды. При перемешивании в течение 30 мин при 70-75ºС прибавляют раствор 29.4 г (0.1 моль) дихромата калия в 100 мл воды. Смесь перемешивают при 70-75ºС еще в течение 8 ч. Органическую фазу отделяют, водную экстрагируют бензолом (3 раза по 20 мл). Бензольные растворы объединяют, промывают последовательно водой, насыщенным раствором гидрокарбоната натрия, снова водой и экстракт сушат сульфатом магния. Смесь разгоняют с дефлегматором, фракция с т. кип. 176-180ºС представляет собой бензальдегид, выход 9.1 г (86%).
Бензальдегид – бесцветная жидкость с запахом горького миндаля, т. пл. -26ºС, т. кип. 179ºС, d, nD20 1.5460. Растворим в спирте, плохо – в воде (~0.3%), на воздухе быстро окисляется в бензойную кислоту.
17.17. ТРИМЕТИЛУКСУСНАЯ КИСЛОТА
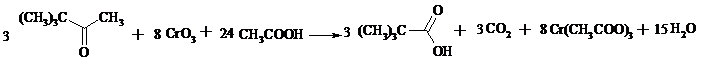
Реактивы | Посуда и приборы | ||
пинаколин | 29 г | колба круглодонная, трехгорлая на 500 мл | |
уксусная кислота | 45 мл | обратный холодильник | |
CrO3 | 20 г | механическая мешалка | |
конц. раствор NaOH | глицериновый затвор | ||
делительная воронка | |||
установка для перегонки с водяным паром | |||
установка для перегонки в вакууме |
Раствор 29 г (0.29 моль) пинаколина в 15 мл ледяной уксусной кислоты помещают в трехгорлую колбу емкостью 500 мл, снабженную механической мешалкой, обратным холодильником и термометром. Затем нагревают содержимое колбы до 100°С (при 50-80ºС окисление вообще не идет) и по каплям прибавляют через обратный холодильник в течение 30 мин заранее приготовленный раствор CrO3 в водной уксусной кислоте (20 г (0.2 моль) CrO3 растворяют в 10 мл воды и, когда растворение закончится, добавляют 25 мл ледяной уксусной кислоты). Реакционную смесь разбавляют 200 мл воды, нейтрализуют концентрированным раствором NaOH и подвергают перегонке с водяным паром. Полученную кислоту отделяют в делительной воронке, сушат над безводным CaCl2 и перегоняют в вакууме, собирая фракцию с т. кип. 75-78ºС при 20 мм рт. ст. Выход около 23 г (75%).
Триметилуксусная (пивалиновая) кислота – бесцветное кристаллическое вещество, т. пл. 35.5ºС, т. кип. 164ºС. Растворима в воде, спирте, диэтиловом эфире.
17.18. n-НИТРОАЦЕТОФЕНОН
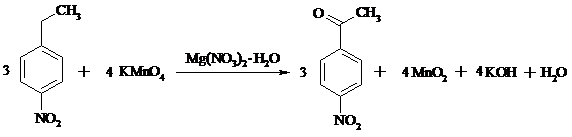
Реактивы | Посуда и приборы | ||
n-нитроэтилбензол | 15.1 г | колба круглодонная, трехгорлая на 500 мл | |
Mg(NO3)2·6H2O | 50 г | механическая мешалка | |
перманганат калия | 25 г | колба Бунзена | |
воронка Бюхнера |
В круглодонную трехгорлую колбу емкостью 500 мл, снабженную мешалкой, термометром и обратным холодильником, помещают раствор 50 г (0.194 моль) гексагидрата нитрата магния в 200 мл воды и 15.1 г (0.1 моль) n-нитроэтилбензола. Смесь подогревают до температуры 60ºС и, при энергичном перемешивании, небольшими порциями добавляют к ней 25 г (0.16 моль) хорошо измельченного перманганата калия, прибавляя каждую следующую порцию только после обесцвечивания раствора. По окончании добавления перманганата смесь перемешивают при температуре 60ºС еще в течение 2 ч, затем повышают температуру до 90ºС и быстро фильтруют горячей через воронку Бюхнера. Осадок диоксида марганца тщательно промывают небольшим количеством кипящей воды. Из фильтрата выделяется масло, которое при охлаждении затвердевает. Выделившиеся кристаллы отфильтровывают и сушат на воздухе. Выход ~ 7 г (42%).
n-Нитроацетофенон – светло-желтое кристаллическое вещество с т. пл. 78-80ºС, т. кип. 138ºС при 1.5 мм рт. ст.
17.19. ЦИКЛОГЕКСАНОН
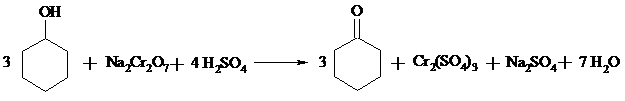
Реактивы | Посуда и приборы | ||
циклогексанол | 12.5 г | колба круглодонная, трехгорлая на 500 мл | |
диэтиловый эфир | 65 мл | капельная воронка | |
дихромата натрия дигидрат | 11.5 г | стакан на 250 мл | |
конц. серная кислота | 10 мл | механическая мешалка | |
карбонат калия | колба Бунзена | ||
воронка Бюхнера | |||
установка для простой перегонки |
В трехголую колбу вместимостью 500 мл, снабженную мешалкой, капельной воронкой и термометром, помещают 12.5 г (0.125 моль, 13.3 мл) циклогексанола и 15 мл диэтилового эфира. Содержимое колбы охлаждают до 0-5ºС в бане со льдом. Отдельно в стеклянном стакане растворяют 11.5 г (0.039 моль) дихромата натрия (в виде дигидрата) в 125 мл воды. К полученному раствору осторожно приливают 10 мл (18.4 г, 0.188 моль) концентрированной серной кислоты. Окислительную смесь охлаждают до 4ºС, переносят в капельную воронку и постепенно при перемешивании прибавляют к раствору циклогексанола. Температуру реакционной смеси поддерживают в интервале 3-5ºС. После прибавления всего количества окислителя перемешивание продолжают в течение 3 ч при комнатной температуре. Затем смесь переносят в делительную воронку и экстрагируют диэтиловым эфиром 2 раза по 25 мл. Эфирные вытяжки объединяют, встряхивают с небольшим количеством безводного карбоната калия, фильтруют через слой карбоната калия и сушат сульфатом натрия.
Высушенный раствор переносят в колбу Вюрца и отгоняют эфир на водяной бане. Затем на воздушной бане с воздушным холодильником перегоняют циклогексанон, собирая фракцию с т. кип. 153-156ºС.
Циклогексанон – бесцветная маслянистая жидкость с резким запахом, т. кип. 156ºС, d, nD20 1.4507; растворим в этаноле, диэтиловом эфире, мало растворим в воде.
17.20. 1-АЗА-8,9-БЕНЗЦИКЛОНОНЕНДИОН-2,7

Реактивы | Посуда и приборы | ||
1,2,3,4-тетрагидрокарбазол | 2.52 г | колба плоскодонная на 250 мл | |
этанол | 75 мл | делительная воронка | |
метапериодат натрия | 6.92 г | установка для простой перегонки | |
дихлорметан | колба Бунзена | ||
этилацетат | воронка Бюхнера |
Раствор 2.52 г (14.7 ммоль) тетрагидрокарбазола в 75 мл этанола добавляется к раствору 6.92 г (3.23 ммоль) метапериодата натрия в 35 мл воды. При этом раствор становится теплым и начинает выпадать иодат натрия в виде бесцветных игл. Через 2.5 ч водный раствор экстрагируют хлористым метиленом, экстракт сушат безводным Na2SO4, растворитель отгоняют на водяной бане. Остаток перекристаллизовывают из этилацетата. Выход 2.38 г (80%).
1-Аза-8,9-бензциклононендион-2,7 – бесцветное кристаллическое вещество, т. пл. 156-157ºС.
17.21. БЕНЗИМИДАЗОЛ-2-СУЛЬФОКИСЛОТА
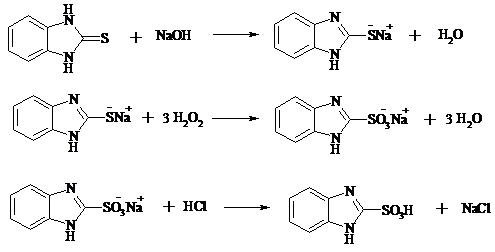
Реактивы | Посуда и приборы | ||
2-меркаптобензимидазол | 7.5 г | колба круглодонная, трехгорлая на 100 мл мешалка | |
NaOH | 4 г | капельная воронка | |
30%-ный раствор H2O2 | 30 мл | термометр | |
конц. соляная кислота | колба Бунзена | ||
воронка Бюхнера |
В трехгорлой колбе, снабженной мешалкой, термометром и капельной воронкой (Не допускать герметичности прибора!), растворяют 7.5 г (0.05 моль) 2-меркаптобензимидазола в растворе 4 г (0.1 моль) NaOH в 200 мл воды. Полученный раствор охлаждают до 20ºС и прибавляют к нему по каплям при энергичном перемешивании и охлаждении ледяной водой 30 мл 30%-ного раствора H2O2 с такой скоростью, чтобы температура реакционной массы не поднималась выше 37-40ºС. Первые 10-15 мл пероксида водорода необходимо добавлять особенно осторожно, так как вследствие сильного разогревания возможен выброс реакционной массы. По окончании прибавления H2O2 смесь перемешивают при комнатной температуре еще 4 ч, а затем оставляют на ночь. Далее раствор при необходимости фильтруют и подкисляют конц. HCl до pH 1-2. Белоснежный осадок бензимидазол-2-сульфокислоты отфильтровывают из охлажденного раствора, тщательно промывают ледяной водой, ацетоном и высушивают при 100-120ºС.
Выход около 7 г (70%), т. пл. 365-368ºС.
18. ВОПРОСЫ И УПРАЖНЕНИЯ
ДЛЯ САМОКОНТРОЛЯ
1. Составьте уравнения реакций:
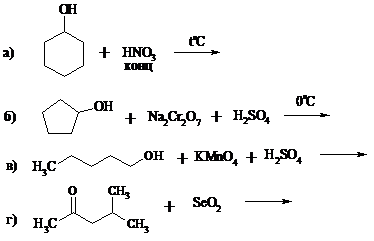
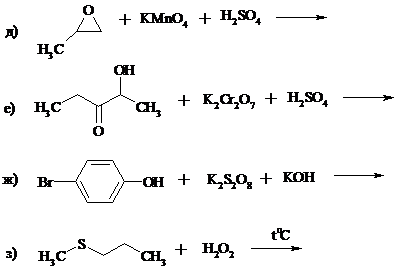
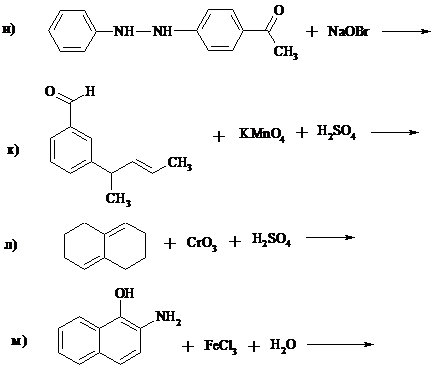
2. Почему акролеин превращается в эпоксид под действием надкислот значительно медленнее и в более жестких условиях, чем пропен?
3. Расположите соединения в ряд по увеличению скорости в реакции Прилежаева:
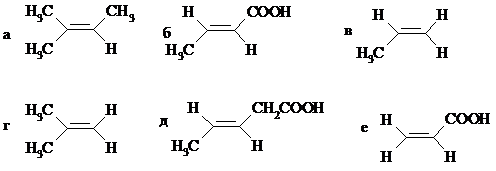
4. Из каменноугольной смолы выделен углеводород состава С9Н8, который взаимодействует с водным раствором брома с образованием дибромида С9H8Br2; вступает в реакцию с озоном в мольном соотношении 1:4, образуя тетраозонид; при восстановительном гидролизе последнего получены следующие вещества:
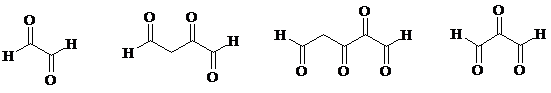
Установите строение углеводорода.
5. Почему аутоокисление простых эфиров протекает в a-положение к атому кислорода?
6. Почему муравьиная кислота легко окисляется, отличаясь этим от других карбоновых кислот? Напишите схему реакции.
7. Какие из приведенных ниже соединений будут подвергаться галоформному расщеплению под действием I2 в присутствии водного раствора Na2CO3:
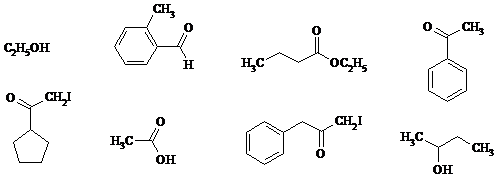
8. Какие продукты образуются при действии аммиачного раствора оксида серебра на бутилформиат?
9. Почему фенол и анилин темнеют на воздухе, а бензол не темнеет?
10. Назовите несколько способов превращения первичного спирта в альдегид с тем же числом атомов углерода. Почему окисление первичного спирта бекмановской смесью применимо для получения альдегидов С2-С5 и мало пригодно для получения, например, альдегида С10?
11. Из n-ацетилэтилбензола получите: а) n-диацетилбензол и б) n-этилбензойную кислоту.
12. Установите строение вещества С7H12O, если при его окислении диоксидом селена образуется смесь двух веществ С7H10O2, а при действии горячей концентрированной азотной кислоты – смесь 2- и 3-метиладипиновых кислот.
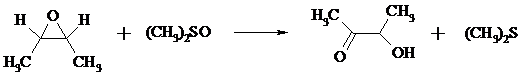
13. Предложите механизм следующей реакции:
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. , , П. Органическая химия. В 4-х ч. – М.: Изд-во БИНОМ. Лаборатория знаний, 2004.
2. Органическая химия: 3-е изд., испр. – М.: Химия, 2000.
3. Ф. Органическая химия: Учебник для вузов: В 2 т. – М.: Академкнига, 2004.
4. , Айхер Т. Препаративная органическая химия /Пер. с нем. – М.: Мир, 1999. – 704 с.
5. , , Практические работы по органической химии. Выпуск IV. – М.:Изд. МГУ, 1969. – 255 с.
6. Органическая химия: В 4-х т./Пер. с англ. – М.: Мир, 1987. – Т.с.
7. Современная органическая химия: В 2-х т. – М.: Мир, 1981.
8. Органикум: Практикум по органической химии: В 2 т. / Пер. с нем. – М.: Мир, 1979.
9. Методы окисления органических соединений: Алканы, алкены, алкины и арены: Пер. с англ. – М.: Мир, 1988.
10. Препаративная органическая химия: Пер. с польского – М.: ГХИ, 1959.
11. Органические синтезы. – М.: Мир, 1973. Ч.1, 620 с. Ч.2, 591 c.
Учебное издание
ОСЯНИН Виталий Александрович
КЛИМОЧКИН Юрий Николаевич
ВОССТАНОВЛЕНИЕ
К о с т е р и н а
Технический редактор В. Ф. Е л и с е е в а
Оригинал-макет
Подп. в печать 02.05.06
Формат 60х84 1/16. Бумага офсетная. Печать офсетная.
Усл. п.л. 4,88. Усл. кр.-отт. 4,88. Уч.-изд. л. 4,79
Тираж 100 экз. С.-115
_____________________________________________________________________________________________
Государственное образовательное учреждение
высшего профессионального образования
«Самарский государственный технический университет»
443100. 44. Главный корпус
Отпечатано в типографии Самарского государственного
технического университета
443100. 44. Корпус №8

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 |



