2. МИТОХОНДРИАЛЬНОЕ ОКИСЛЕНИЕ
Все ферменты дыхательной цепи митохондрий являются сложными белками. Их небелковые фрагменты способны принимать электроны, а1атем~отда^ать следующему партнеру. Благодаря этому возможно возникновение потока электронов от окисляемого субстрата к молекуле кислорода. Он направлен в сторону возрастания редокс-потенциала участников процесса (стандартный окислительно-восстановительный потенциал пары окислитель/восстановитель). Именно в такой последовательности целесообразно рассмотреть главные звенья системы митохондриального окисления (МтО): никоти-намидные дегидрогеназы, флавиновые ферменты, убихинон, цитохромы. Многие из этих компонентов образуют прочные комплексы с особыми белками - «железо-серными».
5.2.1. ФЕРМЕНТЫ МИТОХОНДРИАЛЬНОГО ОКИСЛЕНИЯ
Никотинамидные дегидрогеназы, (НД). Составляют большую группу ферментов, получивших название по своей главной функции - отнимать водород от окисляемого метаболита. Обладают высокой субстратной избирательностью, диктуемой спецификой строения адсорбционного центра. Но в качестве кофермента всегда используют либо НАД, либо НАДФ, хотя некоторые НД способны функционировать с любым из них.
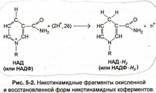
Ведущую роль в них игра-ет никотинамидная группа (витамин PP)Именно к ней присоединяются отнимаемые от субстрата два атома водорода, т. е., два электрона и два протона. Точнее, оба_;лшк1рона переходят к азоту гетероцикла, восстанавливая его из гштавалент1юТ^д^^ехвалентного_ состояния (рис. 5-2), тогда как лишь один из протонов фиксируется коферментом (присоединяясь в пара-положении относительно этого азота, с гшрераспределением двойных связей в кольце), а другой остается в растворе (среда при этом подкисляется). Тем не менее, для краткости удобнее обозначать восстановленные формы НАД и НАДФ в виде WAJ\H2 и НАДФ-Да соответственно.
НД |
А-#2 + НАД(Ф) |
Если обозначить окисляемый субстрат как А х Н2 реакцию, катализируемую никотин-амидными дегидрогеназами, можно представить в виде общей схемы:
-> А + НАД(Ф)#2
В этой схеме использован частый прием: сокращения НАД(Ф) и НАД(Ф)-/72 применяют тогда, когда имеют в виду любой из этих коферментов (без конкретизации их).
Почти все клетки содержат больше НАД, чем НАДФ. Внутриклеточное распределение их (и соответствующих дегидрогеназ) очень неравномерно. НАД сосредоточен главным образом в магриксемитохондрий, в НАДФ-в цитоплазме
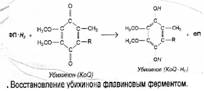
Убихинон - единственный компонент системы МтО, не имеющий собственного апофер-мента. Тем не менее, он сохраняет изначальное название кофермент Q (по первой букве слова «quinone»). Гидрофобность и малые размеры обеспечивают ему мобильность в неполярной среде. Поэтому кофермент Q (KoQ) способен, мигрируя в пределах мембраны, принимать восстановительные эквиваленты (атомы водорода) от одних участников дыхательной цепи и передавать их другим сложным протеинам, -обладающим более высоким значением редокс-потенциала («оправдывая» тем самым звание кофермента).
Обычным «поставщиком» водорода для убихинона являются восстановленные формы флавиновых ферментов (ФП-Н2). Принимая от них два электрона и два протона, хинонная структура кофермента Q превращается в гидро-хинонную (убшшол), как это показано на рис. 5-5.
ЦитохромъЪ Так обозначают сравнительно небольшие белки (обычно 15-45 кДа), простети-ческая группа которых почти или совсем идентична гему Ь, содержащемуся в гемоглобине (см. рис. 1-26). Нередко их называют белками, содержащими гемовов железо.
По мере открытия цитохромов, их обозначали латинскими буквами. Выявление все новых аналогов потребовало добавления цифровых символов к уже принятым буквенным.
В дыхательной цепи МтО функционируют цитохромы Ь, Си с и ааъ. Первый из них коор динационно связывает 2 молекулы гема Ъ. Ци тохромы С\ и с обладают таким же гемом, но фиксированным ковалентно, тиоэфирными связями. А вот цитохром ааъ содержит две молекулы гема а, который немного отличается от гема Ь (см. подпись к рис. 1-26). Эти молекулы в нем/Обозначаются как гем а и гем я3 из-за неравно-\ ценности их свойств, обусловленной, похоже, | разным расстоянием от атома меди (Cu2+/Cu+), ) связанного с этим гемопротеином через радика-члы цистеина и гистидина.
Главным функциональным центром цитохромов является железо гема. В отличие от гемоглобина, здесь оно довольно легко может менять свою валентность. Принимая электрон, окисленное железо феррицитохрома (Fe3+) переходит в восстановленную форму (Fe2+). Отдавая затем электрон подходящему акцептору, возникший ферроцитохром вновь превращается в ферри-форму:
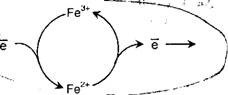
Вариации в строении гема, в способах его связывания с белком, а также в структуре прилегающих фрагментов апопротеина, - все это заметно отражается на степени сродства железа цитохромов к электронам. Приведенный выше перечень цитохромов дан в порядке возрастания их редокс-потенциала. Поэтому именно в такой последовательности компоненты системы цитохромов транспортируют электроны от убихинола в конечном счете на молекулярный кислород (рис. 5-6).
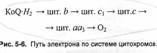
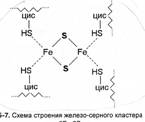
Железо-серные белки /(FeS-протеины; FeS-PJ. Так называют небольшие белки (по - рядка 20 кДа), содержащие негемовое железо и неорганическую серу. Обычно в молекуле имеется один железо-серный центр, включающий по два атома железа и серы (2Fe-2S-npoTeHHbi). Как показано на рис. 5-7, каждый атом железа в нем, помимо связей с сульфидной серой, ком-плексирован еще и с группами - SH двух радикалов цистеина (вместо одной из них возможен радикал гистидина). Вся эта структура локализована в петле, выступающей на поверхность бочкообразной молекулы 2Fe-2S-npoTettHa. Нередко встречаются и белки с двумя такими кластерами (4Fe-4S-npoTeHHbi) либо с неполным удвоением их.
Подобно цитохромам, железо-серные белки тоже осуществляют одноэлектронный транспорт. Однако делают это они не самостоятельно, а в составе неразрывных комплексов с другими компонентами дыхательной цепи - флавопро-теинами или цитохромами. Влияние партнера в таком комплексе, как и специфика собственного апопротеина, - все это сильно отражается на величине редокс-потенциала железо-серного центра: в разных FeS-белках он составляет обычно от -0,30 до -0,15 В. Неудивительно, что FeS-P со столь^азличающимися характеристиками «встроены» в совершенно разные звенья дыхательной цепи.
5.2.2. ПОЛНАЯ ЦЕПЬ СИСТЕМЫ МИТОХОНДРИАЛЬНОГО ОКИСЛЕНИЯ
Систему, в которой участвуют все перечисленные компоненты митохондриального окисления, целесообразно назвать полной дыхательной цепью. В виде общей схемы она изображена""™" рис. 5-8. Эта давняя схема удобна своей наглядностью. Во-первых, она демонстрирует, что окисление одного компонента цепи невозможно без одновременного восстановления другого (это отражено обязательным соприкосновением полукруглых стрелок). Во-вторых, здесь виден (светлые стрелки) путь электронов (и протонов) от исходного субстрата (А-Я2)в конечном счете^а_молеку-jry^Pj. Приведенные на схеме цифры показывают, что этот путь пролегает в направлении постепенного увеличения редокс-потенциала - от^032~В для пары НАД / НАД - Я2 до +0,82 В для пары V2O21 О.
Наконец, схема отражает экспериментальные данные о том, что в трех участках цепи перенос пары электронов с одного звена на другое сопряжен с синтезом молекулы АТФ. Это сопряжение происходит лишь на уровне тех звеньев, где перепад редокс-потенциала наиболее значителен (порядка 0,2 В): именно в этих пунктах освобождаемая порция энергии достаточна для обеспечения синтеза одной молекулы АТФ из АДФ и фосфата.
Таким образом, митохондриальное окисление представляет собой по существу реакцию гремучего газа:
Н2 + Уг 02 = Н20 + 230 кДж/моль.
Разница заключается в том, что в митохондриях используется не молекула газообразного водорода, а два атома водорода, изымаемые у окисляемого субстрата. Но самое главное отличие - в том, что дыхательная цепь расчленяет реакцию гремучего газа на множество пром^жушчнтях стадий. Из-за этого энергия выделяется не мгновенно (как при взрыве гремучей смеси) и не столь интенсивно, как при горении струи водорода в воздухе, а - постепенно, небольшими порциями. Некоторые из них достаточны для трансформации в энергию макроэргических связей АТФ. Она составляет =30 кДж/моль в стандартных условиях (в реальной среде митохондрий - и того больше: до 42 кДж/моль). Следовательно, при окислении субстрата полной дыхательной цепью из 230 кДж/моль освобождаемой энергии не менее 3x30 = 90 кДж/моль концентрируется в молекулах АТФ. Это очень высокий коэффициент полезного действия - более 40%! Остальная энергии рассеивается в форме теплоты (хотя и она небесполезна, ибо пригодна для терморегуляции организма).
Синтез АТФ из АДФ и Фн кратко обозначают как реакцию фосфорилирования (подразумевая фосфорилирование молекулы АДФ неорганическим фосфатом).
Окислительным фосфоршированием^ называют образование АТФ, сопряженное с работой дыхательной цепи (т. е., за счет энергии, освобождаемой в процессах митохондриального окисления).
Критерием эффективности окислительного фосфорилирования служит количество АТФ, вырабатываемое на единицу утилизируемого 02. Как показывает схема (см. рис. 5-8), на пути двух атомов водорода от субстрата до кислорода образуются 3 молекулы АТФ (т. е., используется 3 молекулы Фн в расчете на каждый атом потребляемого кислорода). Этот критерий - отношение фосфор/кислород (коэффициент Р к О) - предложили в 1939 г. и . Экспериментальные измерения in vitro поначалу подтверждали, что в полной дыхательной цепи коэффициент Р/О равен 3.
В митохондриях содержатся никотинамид-ные дегидрогеназы для многих веществ. Однако преобладающими субстратами полной дыха-тельной 1депи являются всего только 5 метаболитов, - те, которые в организме человека окисляются сотнями граммов (первые три из приведенного списка) или десятками граммов в сутки:
- изолимонная кислота (изоцитрат);
яблочная кислота (малатУ
- Р-гидроксиацил-КоА (|3-гидроксипроиз-водное а^кШшрШКШшСжирных кислот);
- Р-гидроксимасляная кислота ф-гид-роксибутират);
- глутаминовая кислота (глутамат). Митохондриальное окисление именно
этих веществ поставляет клеткам основную массу АТФ. Соответствующие дегидрогеназы локализованы в митохондриальном матриксе. По___су_ществу, вырабатываемый всеми ими НАД-Я2 оказывается единым субстратом для полной цепи МтО. И даже если в митохондриях появляются молекулы НАДФ-//2, которые возникают в отдельных реакциях, они легко отдают водород молекулам НАД благодаря имеющейся здесь НАД(Ф)-трансгидрогеназе:
НАДФН22 + НАД =НАДФ + НАДН2. [5-1]
Со временем было установлено, что мембранные белки, переносящие электроны (часть из них - и протоны), организованы в блоки, каждый из которых сохраняет свою функцию даже после выделения из митохондрий. Блоки оказались устроенными гораздо сложнее, чем это показано на рис. 5-8, и были названы комплексами МтО. Современные данные о них обобщены в табл. 5-1. В работе полной дыхательной цепи участвуют, однако, не все электрон-транспортные белки мембраны, а только комплексы i, iii и iv. Рисунок 5-9 в самом общем виде показывает очередность их вовлечения в процесс переноса электронов (и протонов). Детальнее роль каждого звена представлена на рис. 5-10.

Название | Локализация, состав, функции | Редокс-центры | Транслокация |
А. НАЧАЛЬНЫЕ (альтернативные) звенья митохондриального окисления | |||
Комплекс I (НАД-Н2 - убихинон-оксидоредуктаза) | Трансмембранный комплекс из десятков субъединиц. Предназначен для окисления молекул НАД-Нг, продуцируемых растворимыми (внемембранными) никотинамидными дегидрогена-зами | 1 ФМН 4 FeS-белка 2 KoQ | 4н+ |
Комплекс II (сукцинат-дегидрогеназа) | Состоит из серии субъединиц, внедренных во внутреннюю мембрану со стороны матрикса; переносит 2 ё и 2 Н+от янтарной кислоты (сукцинат) на мобильный убихинон липидного бислоя | 1 ФАД 3 FeS-белка 1 гем Ь | 0 |
ЭТФ-дегидро-геназа | ФАД-содержащий железо-серный белок, обладающий трансмембранным участком. Генерирует убихинол за счет окисления ЭТФ (электронтранспортирующий флавопротеин), восстанавливаемого различными ФАД-зависимыми дегидрогеназами митохондрий | 1 ФАД 4 FeS-центра | 0 |
Б. ЗАКЛЮЧИТЕЛЬНЫЕ (общие) звенья системы митохондриального окисления | |||
Комплекс III (цитохром Ь-й; убихинол-цито-хром-с-редуктаза) | Трансмембранный белок из 11 субъединиц, включая цитохром Ь (с двумя молекулами гема Ь), цитохром Ci (с ковалентно связанным гемом Ь) и FeS-белок. Они образуют цепочку поочередного транспорта каждого электрона от KoQ-Нг на цитохром с межмембранного пространства, примыкающий к мембране | 3 гема b 1 FeS-белок | 2 Н+ |
Комплекс IV (цитохром-оксидаза) | Ансамбль из 6 субъединиц. Из них каталитическая богата трансмембранными доменами (12) и содержит не только два гема, но и атом меди (медь В). С привлечением «иной» меди (медь А) другой субъединицы, она обеспечивает поток электронов от цитохрома с снаружи мембраны на молекулу Ог в матриксе | 1 гем а 1 гем аз 1 медь «Л» 1 медь «В» | 4 Н+ |
Комплекс I является начальным из мембранных звеньев полной дыхательной цепи, выполняя роль посредника между никотинамидными дегидрогеназами матрикса и мобильным KoQ мембраны. Он обозначается как НАДН2-дегидрогеназа и представляет собой кругшоё~Хяо 900 кДа) объединение десятков разных субъединиц" семь из которых кодируются митохондриальной ДНК. Многие субъединицы гидрофобны и организованы в трансмембранные а-спирали. На весь комплекс приходится одналго^екула ФМН, которая некова-лентно, но прочно связана~с гидрофильным фрагментом фермента, выступающим в мат-рикс, и является первичным акцептором электронов от НАДН2 (см. рис. 5-10). Следующее затем поочередное восстановление FeS-центров соответствующих субъединиц, сопряжено с протонированием определенных группировок апопротеина. Обладая



