Задача 6. Константа скорости омыления уксусноэтилового эфира в щелочной среде – реакция 2 порядка. При 10оС её k = 2,38. Определить время (мин), необходимое для омыления 90% уксусноэтилового эфира, если смешать при 10оС 1 л 0,05 М раствора эфира с а) 1 л 0,05 М NaOH; б) 1 л 0,1 М NaOH.
Ответ: а) 2 часа 31 мин; б) » 28 мин.
Работа 5.1
Изучение кинетики реакции инверсии сахарозы
Цель работы: изучение кинетических характеристик реакции первого (псевдопервого) порядка.
Целевые задачи: овладение способом расчета порядка реакции с использованием поляриметрического метода; освоение методики работы на поляриметре; расчет кинетических характеристик реакции (константы скорости, энергии активации, времени полупревращения, времени инверсии сахарозы на 10%).
Реакция гидролиза сахарозы в присутствии ионов Н+:
С12Н22О11 + Н2О = С6Н12О6 + С6Н12О6 сахароза глюкоза фруктоза |
является бимолекулярной и её скорость может быть рассчитана по уравнению
v = k CсахарозыСводы
Однако при проведении гидролиза в разбавленном растворе, когда концентрация воды в ходе процесса меняется незначительно, величину Своды можно считать постоянной и тогда уравнение закона действующих масс можно записать следующим образом:
V = k¢Cсахарозы
где k¢ = k Своды.
При этом течение гидролиза подчиняется кинетическому уравнению для реакции 1-го порядка:
1 C0 k = ¾ ln ¾¾ t C |
где С0 – начальная концентрация сахарозы; С - концентрация сахарозы, наблюдаемая ко времени t, прошедшему от начала реакции. Поэтому данную реакцию относят к псевдомономолекулярным (или реакциям псевдопервого порядка).
Сахароза и продукты её гидролиза являются оптически активными веществами, поэтому для контроля за ходом данной реакции возможно использование поляриметрического метода.
Устройство и принцип действия поляриметра
Существует несколько различных типов поляриметров, отличающихся, главным образом, природой источника света и точностью отсчитываемых показаний. Опишем устройство прибора на примере кругового поляриметра.
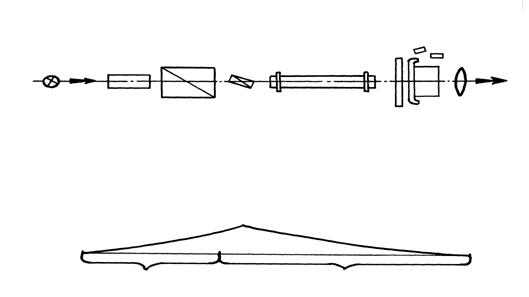
Монохроматический свет от источника (натриевой лампы), расположенного в отделении (1) проходит через поляризатор (2), становясь при этом поляризованным. Далее луч поляризованного света попадает в кюветное отделение (3), где располагается кювета (4) с исследуемым раствором. Если в кювете имеется оптически активное вещество, плоскость поляризации света поворачивается вправо или влево в зависимости от природы вещества. Вследствие поворота плоскости поляризации луч света может пройти через анализатор (5) и попасть в окуляр (6) только в том случае, если анализатор повернут на тот же угол и в том же направлении. Поворот анализатора осуществляется регулятором (7).
|
Отсчет показаний производится с помощью шкал, расположенных по обе стороны от окуляра в окошках (8). Включение и выключение прибора осуществляется тумблером (9).
Измерения с помощью поляриметра проводятся следующим образом:
1. После включения прибор прогревается около 10 мин до появления яркого желтого света в вентиляционных отверстиях отделения (1).
2. Кювета (4) заполняется без пузырьков воздуха исследуемым раствором и помещается в кюветное отделение (3), крышка кюветного отделения закрывается.
3. Вращением регулятора (10) устанавливается резкость изображения в окуляре (6). При этом на черном фоне должен быть виден желтый кружок, разделенный вертикальной линией; одна из половин кружка может быть более темной, чем другая.
4. Поворотом регулятора (7) достигается такое положение, при котором обе половины освещенного кружка приобретают одинаковую яркость и вертикальная граница полукружий исчезает.
ВНИМАНИЕ! Если при вращении регулятора (7) вокруг светового кружка вместо черного фона появляется желтое свечение, значит анализатор выведен из чувствительной области. В этом случае следует ориентируясь по шкале (8) совместить нули подвижной шкалы и неподвижного нониуса и начать измерение снова. |
5. Угол поворота (“вращения”) плоскости поляризации светового луча определяется с помощью шкал (8). При прецизионных измерениях угол отсчитывается дважды (по левой и по правой шкале) с вычислением среднего арифметического; при учебных измерениях можно ограничиться одним отсчетом по левой шкале.
Принцип отсчета показаний приведен на рисунке. Деления подвижной шкалы нанесены через каждые 0,5 градуса. Неподвижный нониус позволяет определить угол с точностью 0,02о. Сначала определяется число градусов, отделяющих нуль нониуса от нуля подвижной шкалы. Затем среди делений нониуса находится такое, которое сливается в одну линию с каким-либо делением подвижной шкалы. Это деление нониуса дает десятые и сотые доли градуса. Оба показания складывают. Так, изображение на рисунке соответствует углу 3,5 + 0,06 = 3,56о. Вставить рисунок.
Примечание 1. Перед началом работы правильность показаний прибора проверяется по кювете с дистиллированной водой. При этом нули подвижной шкалы и нониуса должны совпадать друг с другом. Примечание 2. Правовращающие вещества вызывают смещение подвижной шкалы по часовой стрелке; левовращающие – против часовой стрелки. |
Оснащение рабочего места
Поляриметр с кюветой Водяная баня
Склянка с притертой пробкой Термометр
Цилиндры на 10 мл Раствор сахарозы 20%
Растворы соляной кислоты 1н., 2н., 3н., 4н.
Проведение опыта
1. Проверить оснащение рабочего места. Измерить и записать температуру опыта.
2. Включить водяную баню или термостат и довести температуру до 60оС. Включить поляриметр и дать ему прогреться не менее 10 мин.
3. Отмерить раствор сахарозы и раствор HCl (концентрации и объёмы растворов указываются преподавателем). Слить оба раствора в склянку с притертой пробкой. В момент смешивания начать отсчет времени.
Примечание. Сахароза и продукт её гидролиза – глюкоза вращают плоскость поляризации вправо, а фруктоза – влево, поэтому в ходе реакции угол поворота анализатора уменьшается до 0о, а к концу реакции вращение становится левым из-за большего удельного вращения фруктозы по сравнению с глюкозой. Это явление изменения знака направления оптического вращения называется инверсией. |
4. Полученной реакционной смесью заполнить кювету поляриметра и измерить углы вращения плоскости поляризации (at) через 3, 6, 10, 20, 30, 40 минут от начала реакции.
5. Оставшуюся в склянке смесь поместить в водяную баню или термостат при 60оС на 30 мин. При этом реакция проходит практически до конца.
6. Смесь охладить, заполнить ею кювету и определить угол вращения, соответствующий наступлению равновесия (a¥).
7. Результаты показать преподавателю и занести в таблицу.
Концентрация раствора HCl: | |||||||||||||
Температура опыта Т = оС | |||||||||||||
№ | Время от начала опыта t, мин | 1/t | Угол вращения a, о | at-a¥ | ln(at-a¥) | a0-a¥ ln¾¾¾ at-a¥ | k, мин-1 | ||||||
1 | 0 | – | – | – | – | – | |||||||
2 | 3 | ||||||||||||
3 | 6 | ||||||||||||
··· | ··· | ||||||||||||
6 | ¥ | – | – | – | – | – | |||||||
kсредн | |||||||||||||
9. Привести в порядок рабочее место и сдать дежурному.
ВНИМАНИЕ! Чтобы не потерять и не разбить покровное стекло, находящееся под завинчивающейся крышкой кюветы, раствор из неё следует осторожно выливать в кристаллизатор. |
10. Построить график зависимости ln(at–a¥)от времени и продлить его до пересечения с осью ординат, как показано на рисунке ниже.
Измерить отрезок ОА, равный ln(a0–a¥), и записать его значение в
таблицу.
* * * *
0 t |
(a0–a¥) ln ¾¾¾¾ = ln (a0–a¥) – ln (at–a¥) (at–a¥) |
11. Вычислить величины
и 1/t для каждого момента времени; результаты занести в таблицу.
1 (a0–a¥) 1 k = ¾ ln ¾¾¾¾¾ = ¾ [ln (a0–a¥) – ln ( at–a¥ )]. t (at–a¥ ) t |
13. Рассчитать для каждого интервала времени константу скорости инверсии сахарозы:
Данное уравнение получается из кинетического уравнения для реакции 1-го порядка k = (1/t) · ln(C0/Ct) при подстановке вместо Со и Ct пропорциональных им величин a0–a¥ и at–a¥. Ýòî ìîæíî ïðî-èëëþñòðèðîâàть ñõåìîé, приведенной ниже, где отрезок a0-a¥ пропорционаленС0, отрезок a0-at - количеству сахарозы х, прореагировавшему за время t, а отрезок at-a¥ пропорционален оставшемуся непрореагировавшим количеству сахарозы Сt, или, что то же самое, С0 - х. Поскольку величину a0 невозможно определить экспериментально, её находят графически, причем сразу в виде ln (a0–a¥).
14. После того, как будут найдены константы скорости инверсии для каждого момента времени, вычислить среднее значение kсредн.
|
15. Рассчитать энергию активации по уравнению Аррениуса:
R Т1 Т2 k2 Е¹ = ¾¾¾¾ ln ¾¾ , Ò2 - Т1 k1 |
используя указанные преподавателем значения k2 и Т2 из таблицы и принимая температуру опыта за Т1, а среднее значение константы скорости – за k1.
Константы скорости инверсии сахарозы в присутствии соляной кислоты
|
16. Рассчитать время полупревращения (t1/2) и время инверсии сахарозы на 10% по уравнениям:
ln 2 0,693 ln 1,1111 0,1054 t1/2 = ¾¾ = ¾¾¾ ; t1/10 = ¾¾¾¾ = ¾¾¾ . k k k k |
17. Сформулировать выводы.
Работа 5.2
Изучение кинетики реакции взаимодействия
хлорида железа с иодидом калия
Цель работы: изучение кинетических характеристик реакции 2 порядка (случай одинаковых начальных концентраций реагентов).
Целевые задачи: овладение способом определения кинетических характеристик с использованием фотоколориметрии; освоение расчета кинетических характеристик реакции (порядок, энергия активации, время полупревращения).
Реакция
2FeCl3 + 2KI = 2FeCl2 + 2KCl + I2
является бимолекулярной и её скорость зависит от концентрации обоих реагентов:
v = k CFeCl3 СKI
Поскольку концентрации обоих реагентов в данном случае берутся равными друг другу (CFeCl3 = СKI = C), то можно записать v = k C2. Кинетическое уравнение в этом случае выглядит так:
1 х k = ¾ · ¾¾¾¾¾¾ t С0 (С0 - х) |
где С0 – начальная концентрация реагентов; х – часть концентрации, на которую уменьшилось количество реагентов за время t; С0 – х – концентрация исходных веществ, оставшихся по истечении времени t.
В ходе реакции выделяется иод, поэтому за ней удобно следить по его накоплению в реакционной смеси. Это делается с помощью фотоколориметра.
Устройство и принцип действия фотоколориметра
Принципиальная схема прибора изображена на рисунке.
|
Луч света от источника (1) проходит через светофильтр (2) и попадает в кювету с исследуемым раствором (3). В растворе часть светового потока поглощается. Ослабленный луч попадает на фотоэлемент (4), преобразующий световой сигнал в электрический, который передается на показывающий прибор (5).
Измерения с помощью фотоколориметра сводятся к следующему:
1. Прибор включается в сеть и прогревается в течение »20 мин. Во время прогрева крышка кюветного отделения должна быть открытой.
2. Специальным переключателем подбирается светофильтр, обеспечивающий максимальное поглощение света в исследуемом растворе. Как правило, цвет светофильтра должен быть дополнительным к цвету исследуемого раствора.
3. Перед началом работы прибор балансируется. Для этого в кюветодержатель помещается кювета с эталонным раствором и стрелка показывающего прибора устанавливается на нуль регуляторами «Установка нуля», «Грубо» и «Точно».

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 |






 *
*