0 фенол вода 0 состав, масс. % |
15. Провести конноды, отвечающие температурам 40, 45, 50, 60, 65оС (или другим, указанным преподавателем), как показано на рисунке. Определить составы сопряжённых растворов при температурах, указанных преподавателем.
16. Найти и отметить точки, отвечающие среднему арифметическому из составов сопряжённых фаз, которые находятся точно в середине каждой конноды. Провести прямую линию, соединяющую середины коннод, и продлить её до пересечения с кривой расслоения. Определить критическую температуру растворения системы. Установить, подчиняется ли данная система правилу Алексеева.
17. Занести расчетные данные в таблицу.
Температура, оС | |||
Составы сопряжённых фаз: | % фенола % воды | % фенола % воды | % фенола % воды |
Среднее арифметическое из состава сопряжённых фаз: | % фенола % воды | % фенола % воды | % фенола % воды |
Критическая температура растворения КТР = |
18. Сформулировать выводы.
Работа 2.4. Определение коэффициента распределения третьего компонента между двумя жидкими фазами.
Цель работы: Определение коэффициента распределения третьего компонента между водой и органическим растворителем путем проведения жидкостной экстракции.
Целевые задачи: Проведение жидкостной экстракции третьего компонента из водного раствора органическим растворителем; титриметрическое определение концентрации третьего компонента в обеих фазах системы; расчет коэффициента распределения и степени ассоциации вещества в органическом растворителе; оценка экстракционной эффективности органического растворителя.
Если в систему из двух несмешивающихся жидкостей ввести небольшое количество третьего компонента, то после установления равновесия он окажется в обеих фазах, но в разном количестве. Для каждой температуры отношение концентраций третьего компонента в двух равновесных жидких фазах является величиной постоянной, независимо от этих концентраций (закон распределения Нернста):
С1 ¾¾ = К С2 |
где К - коэффициент распределения.
Закон распределения является теоретической основой жидкостной экстракции. Экстракцией из растворов называется извлечение и разделение компонентов раствора путем перевода их из одной жидкой фазы в другую, содержащую экстрагент. Основными условиями экстракции являются:
а) несмешиваемость экстрагента с исходным раствором,
б) отсутствие химического взаимодействия извлекаемого вещества с экстрагентом,
в) намного большая растворимость извлекаемого вещества в экстраген - те, чем в первоначальном растворителе.
Фаза, в которую после экстракции переходит извлекаемое вещество, называется экстрактом, а фаза, обедненная им - рафинатом.
Количественной характеристикой эффективности экстракции является коэффициент распределения. В данных методических указаниях выбрана такая система обозначений: С1 - концентрация извлекаемого вещества в рафинате, С2 - его концентрация в экстракте. При этом чем меньше значение коэффициента распределения, тем эффективнее экстрагент и тем больше степень извлечения третьего компонента. Она определяется как отношение массы извлекаемого вещества в экстракте к его массе, содержавшейся в исходном растворе до экстракции.
В ряде случаев при переходе третьего компонента через поверхность раздела фаз его средняя молярная масса изменяется вследствие ассоциации или диссоциации в одном из растворителей. В таких случаях уравнение закона распределения можно представить в виде
С1 ¾¾ = К, (1) С2n |
где n - показатель при данной температуре, обусловленный свойствами
всех трех компонентов системы, и представляющий собой отношение средних молярных масс третьего компонента в исходном растворителе и в экстрагенте. Например, если уксусная кислота в воде существует главным образом в виде отдельных молекул, а в бензоле - в виде ассоциатов из двух молекул (димеров), то:
Ммолекулы 60 1 n = ¾¾¾¾¾ = ¾¾ = -¾ . Массоциата 120 2 |
Из методов определения К наиболее употребителен графический. Его принцип заключается в следующем. Уравнение (1) путем логарифмирования линеаризуется, т. е. преобразуется в уравнение прямой, не проходящей через начало координат:
lgC1 = lgK + n lgC2 .
Затем по экспериментальным данным строится график зависимости lgC1 от lgC2, отсекающий от оси ординат отрезок, равный lgK. Тангенс угла наклона этого графика к оси абсцисс равен n. (подробнее об этом см. «Проведение опыта»).
Оснащение рабочего места
Пипетка на 1 мл. Склянки с пробками на 100 мл.
Колбы для титрования. Раствор NаОН 0,1 н.
Цилиндр на 10 мл. Бюретка на 25 мл.
Раствор фенолфталеина в спирте.
Растворы экстрагируемого вещества и органические растворители (по указанию преподавателя).
ВНИМАНИЕ! Органические растворители отмеривать только под тягой! После окончания работы категорически запрещается сливать их в канализацию. Для этого имеется специальный сосуд в вытяжном шкафу. |
Проведение опыта
1. Проверить оснащение рабочего места.
2. Измерить и записать температуру.
3. В три склянки с притертыми пробками поместить по 10 мл водных растворов экстрагируемого вещества кислотной природы (по указанию преподавателя).
4. Добавить к каждому раствору по 10 мл указанного преподавателем органического растворителя (под тягой!).
5. Склянки плотно закрыть пробками и после интенсивного встряхивания в течение трех минут оставить для перераспределения не менее чем на 20 минут.
6. Определить титрованием концентрацию экстрагируемого вещества во всех исходных растворах (обозначается С0I, С0II и С0III) для чего отмерить 1 мл исходного раствора экстрагируемого вещества в колбу для титрования, затем добавить 1 каплю раствора фенолфталеина и титровать 0,1 н. раствором NaOH до появления слабо-розового окрашивания, не исчезающего в течениесекунд. Повторить титрование трижды для каждого раствора. Рассчитать С0I, С0II и С0III по уравнению:
СNaOHVNaOH С = ¾¾¾¾¾¾ (2) Vк |
где VNaOH - объём раствора NaOH, пошедший на титрование (среднее арифметическое из результатов трех титрований), CNaOH - концентрация NaOH, моль-экв/л, Vк - объём раствора экстрагируемого вещества, взятый для титрования (в данном случае – 1 мл).
Данные занести в таблицу 1.
7. После установления экстракционного равновесия определить равновесные концентрации экстрагируемого вещества С1I, С1II и С1III в водном слое (рафинате). Для этого из склянок отобрать пипеткой по 1 мл водных растворов экстрагируемого вещества (нижний слой) в колбы для титрования и оттитровать 0,1 н. раствором NaOH. Титрование провести трижды для каждого раствора (все результаты титрования сверить у преподавателя). Для расчета использовать уравнение (2).
8. По разности С0 – С1 = С2 вычислить равновесные концентрации экстрагируемого вещества С2I, С2II и С2III в органическом слое (экстракте). Данные сверить у преподавателя и занести в таблицу 1.
9. Рассчитать логарифмы С1 и С2 (с точностью до четырех десятичных
Таблица 1. |
№ п. п. | V0 щ | C0 | V1 щ | C1 | lgC1 | C2 | lgC2 | K=C1/C2n |
1 | ||||||||
2 | ||||||||
3 | ||||||||
Kсредн= |
знаков) и занести данные в таблицу 1.
11. Построить график зависимости lgC1 от lgC2 (см. рис.) и продлить его до пересечения с осью Y. При этом от неё отсекается отрезок ОВ, равный lgК, а тангенс угла наклона графика к оси Х равен n.
lg C1
0 lg C2 A C
|
Рассчитать коэффициент распределения К = 10ОВ. Построить прямоугольный треугольник АВС (так, чтобы отрезки ВС и АС были как можно больше для повышения точности расчета). Рассчитать степень ассоциации экстрагируемого вещества в экстрагенте n = BC/AC.
Примечание. Отрезки ВС и АС измеряются в масштабных единицах. |
12. Рассчитать по уравнению (1) К для каждого опыта (КI, КII и КIII) и вычислить среднее арифметическое. Сравнить это значение с найденным графически. Все расчетные данные занести в таблицу 2.
13. Привести в порядок рабочее место и сдать его дежурному.
Таблица 2.
Температура T = îÑ |
Экстрагируемое вещество: |
Органический растворитель (экстрагент): |
Степень ассоциации вещества в экстрагенте n = |
Коэффициент распределения, найденный графически: К = |
Коэффициент распределения, рассчитанный по уравнению Нернста: Ксредн = |
14. Сформулировать выводы.
Тема 3. Кондуктометрия
Кондуктометрия – совокупность физико-химических методов исследования и анализа различных систем (главным образом водных растворов), основанных на измерении электрической проводимости. Кондуктометрический метод позволяет определить наличие или отсутствие диссоциации исследуемого вещества в растворе (т. е. является оно электролитом или нет), термодинамические характеристики электролитической диссоциации вещества (в частности, энергию диссоциации), растворимость труднорастворимых соединений, степень и константу диссоциации слабых электролитов, константы устойчивости комплексных ионов и др.
Зависимость электрической проводимости растворов от концентрации веществ лежит в основе одного из методов количественного анализа - кондуктометрического титрования.
Перечисленные возможности кондуктометрического метода определяют его значение для фармацевтического анализа лекарственных веществ, для описания свойств новых веществ (как синтезированных, так и выделенных из растительного сырья), а также для изучения термодинамики и кинетики биохимических и физиологических процессов, связанных с проницаемостью биологических мембран, со свойствами аминокислот, белков и других, способных к ионизации соединений.
Изучив данную тему и выполнив лабораторные работы, относящиеся к ней, студент должен знать:
n свойства растворов электролитов;
n теорию электролитической диссоциации;
n основные положения теории растворов сильных электролитов Дебая–Хюккеля;
n закон разведения Оствальда, закон Кольрауша;
n расчетные формулы используемых кондуктометрических методов;
n устройство и принцип работы кондуктометра.
Студент должен уметь:
n измерять электрическое сопротивление растворов электролитов с помощью кондуктометра;
n рассчитывать константу ячейки кондуктометра;
n определять удельную и эквивалентную электрические проводимости, степень и константу диссоциации (ионизации) электролитов;
n проводить кондуктометрическое титрование;
n строить и анализировать кривые кондуктометрического титрования.
Студент должен приобрести или закрепить навыки:
n приготовления, разбавления и отмеривания растворов;
n расчета концентрации веществ в растворах;
n титрования;
n табулирования величин, построения и анализа графиков;
n пользования справочной литературой.
Вопросы для самоподготовки.
1. Электрохимия. Основные понятия. Электролитическая диссоциация. Теория растворов сильных электролитов Дебая-Хюккеля. Ионная сила растворов.
2. Коллигативные свойства (криоскопия, эбуллиоскопия, осмотическое давление) растворов электролитов. Изотонический и осмотический коэффициенты, их расчет.
3. Электролитическая диссоциация воды. Водородный показатель рН как мера активной реакции среды.
4. Буферные растворы в фармации. Механизм буферного действия. Связь рН буферных растворов с их составом. Буферная ёмкость.
5. Активность ионов и её связь с концентрацией электролита. Коэффициент активности. Константа диссоциации слабых электролитов. Степень диссоциации. Закон разведения Оствальда. Вывод его математического выражения.
6. Удельная и эквивалентная (мольная) электрическая проводимость растворов. Зависимость электропроводимости от различных факторов. Подвижность ионов. Закон Кольрауша.
7. Кондуктометрическое определение степени и константы диссоциации слабых электролитов.
8. Кондуктометрическое титрование.
Решение типовых задач.
Задача 1. Удельная электрическая проводимость 0,175 М раствора аммиака равна 0,476 Ом-1см-1. Подвижности ионов NH4+ и ОН– при 25оС соответственно равны 73,5 и 198,3 Ом-1см2моль-1. Рассчитать молярную проводимость, степень и константу ионизации аммиака рКb, концентрацию ионов водорода в растворе и его рН.
Решение: Удельная k и молярная l электрические проводимости связаны между собой соотношением l = k/С, где С – концентрация в моль/л.
Рассчитываем l:
k · 1000 l = ¾¾¾¾¾ = 2,72 Ом-1см2моль-1 С |
Степень ионизации вычисляется с помощью уравнения: a = l/l¥, где l¥ – мольная (эквивалентная) проводимость при бесконечном разведении, которую определяют по закону Кольрауша: l¥ = l+ + l, (где l+ и l- – подвижности ионов).
l¥ = 73,5 + 198,3 = 271,8 Ом-1см2моль-1,
отсюда: a = 2,72/271,8 = 0,01.
В соответствии с законом разведения Оствальда
a2 С К = ¾¾¾ , 1 - a |
где К - константа ионизации электролита (в данном случае К = Кb аммиака), С - концентрация в моль/л,
(0,01)2 ´ 0,175 Кb = ¾¾¾¾¾¾¾ = 1,77´10-5. 1 · 0,01 |
Отсюда рКb = - lg Кb = 4,752.
Концентрация ионов ОН - в растворе будет равна aС:
Сон- = 0,01´0,175 = 0,00175 моль/л.
Отсюда рОН = - lg 0,00175 = 2,76; рН =,76 = 11,24.
Задачи для самостоятельного решения.
Задача 1. Эквивалентная электрическая проводимость при бесконечном разведении пикрата калия при 25оС равна 1,0397 Ом-1см2моль-1. Подвижность иона калия 0,7358 Ом-1см2моль-1 . Рассчитать подвижность пикрат-иона. Какова будет эквивалентная электрическая проводимость раствора при степени диссоциации пикрата калия, равной 0,2?
Ответ: 0,3039 Ом-1см2моль-1; 0,2079 Ом-1см2моль-1.
Задача 2. Эквивалентная электрическая проводимость 0,117 М раствора уксусной кислоты при 25оС равна 4,815 Ом-1см2моль-1. Рассчитать степень диссоциации СН3СООН в этом растворе и константу диссоциации, если подвижность ионов водорода и ацетата при 25оС, соответственно, равны 349,8 и 40,9 Ом-1см2моль-1.
Ответ: 0,0123; 1,75´10-5.
РАБОТА 3.1.
Определение константы и степени диссоциации (ионизации) слабых электролитов в водных растворах.
Цель работы: определение степени и константы диссоциации (ионизации) слабых электролитов кондуктометрическим методом.
Целевые задачи: Освоение кондуктометрического метода; расчет константы ячейки (ёмкости сопротивления); измерение сопротивления растворов слабых электролитов; определение удельной и молярной электрической проводимости, степени и константы ионизации растворов электролитов.
Электрическая проводимость раствора – свойство, характеризующее способность проводить электрический ток. Она зависит от количества и природы ионов, природы растворителя и температуры раствора. Измерение электрической проводимости лежит в основе метода исследования и анализа, называемого кондуктометрией. Различают прямую кондуктометрию и кондуктометрическое титрование.
В прямой кондуктометрии по электрической проводимости находят степень и константу диссоциации электролитов, константу устойчивости комплексных соединений, произведение растворимости солей и т. д.
При кондуктометрическом титровании по изменению электрической проводимости контролируют ход взаимодействия титранта с определяемым веществом и находят эквивалентные точки реакций нейтрализации, осаждения, окисления – восстановления и др.
Электрическую проводимость определяют по сопротивлению, которое измеряют с помощью установки, состоящей из измерительного прибора - кондуктометра и кондуктометрической ячейки.
Растворы электролитов характеризуются удельной и эквивалентной электрическими проводимостями.
Удельная электрическая проводимость k – величина, обратная удельному сопротивлению раствора r (которое можно рассчитать, зная общее сопротивление R, длину и площадь поперечного сечения проводника: r = RS/l): k= 1/r. Размерность её в системе СИ Ом-1м-1, однако в практических расчетах обычно используется размерность Ом-1см-1. Физический смысл k при этом будет таким: проводимость объёма раствора, заключенного между двумя плоскими параллельными электродами (площадь поверхности каждого из которых равна 1 см2), расположенными на расстоянии 1 см друг от друга.
Эквивалентная (мольная) электрическая проводимость l - проводимость объёма раствора, содержащего 1 моль эквивалента исследуемого вещества, и заключенного в объёме между плоскими параллельными электродами, расположенными на расстоянии 1см друг от друга. Размерность l в системе СИ Ом-1м2моль-1, однако пользуются и другой размерностью (Ом-1см2моль-1).
Эквивалентная и удельная электропроводимости связаны между собой уравнением:
l = kV,
где V – разведение, то есть объём (в см3) раствора, в котором содержится 1 моль эквивалента исследуемого электролита.
Так как V = 1/С (где С – концентрация), то, при выражении концентрации в моль/л, получается соотношение
l = (k·1000)/С, (3.1)
где 1000 – пересчетный коэффициент из л в см3.
Проводимость растворов зависит от концентрации, температуры, природы растворенного вещества и растворителя, вязкости, диэлектрической проницаемости и других факторов. Поэтому для характеристики свойств электролита в данном растворителе в кондуктометрии обычно используют эквивалентную (мольную) электрическую проводимость при бесконечном разведении l¥. Она представляет собой предел, к которому стремится l с ростом разведения (или с уменьшением концентрации, стремящейся к нулю).
В соответствии с законом Кольрауша l¥ может быть рассчитана как сумма ионных электрических проводимостей при бесконечном разведении (или, иначе, подвижностей ионов):
l¥ = l+ + l- .
Устройство кондуктометра и принцип его действия
Кондуктометр состоит из измерительного прибора и кондуктометрической ячейки, в которую помещается исследуемый раствор электролита. Ячейка представляет собой стеклянный сосуд с вмонтированными в него электродами.
Для прецизионных (высокоточных) измерений используются платиновые электроды, покрытые для увеличения поверхности слоем тонкодисперсной платины (платиновой чернью). При менее точных измерениях, в т. ч. для учебных целей, можно использовать электроды из других металлов (инертных по отношению к исследуемому раствору).
Поскольку невозможно изготовить ячейки с одинаковыми характеристиками, для получения соизмеримых результатов надо для каждой ячейки определять поправочный коэффициент (т. н. константу ячейки). Константа находится с помощью измерения сопротивления данной ячейки, заполненной эталонным раствором с известной электропроводимостью, обычно 0,02 М раствором хлорида калия:
Кя = RKCl ·kKCl,
где kKCl - удельная проводимость раствора KCl при температуре опыта.
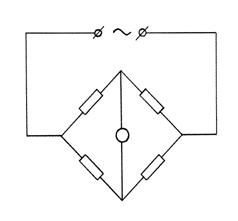
В основе конструкции кондуктометра лежит схема четырехплечного уравновешенного моста (мост Уитстона), изображенная на рисунке.
|
Ток, поступающий от источника в точку А, разветвляется к точкам В и D и затем через точку Е возвращается к источнику. Сопротивления отрезков АВ, ВЕ, АD и DЕ соответственно равны Rx, R3, R1, R2. Если к точкам В и D подключить нуль-индикатор (гальванометр) U, то в том случае, когда падения напряжения на участках АВ и АD и, соответственно, ВЕ и DЕ будут одинаковы, он покажет отсутствие тока. При этом будет иметь место соотношение
Rx/R3 = R1/R2,
называемое уравнением баланса моста. Сопротивления R1 и R2 выбираются так, чтобы они были одного порядка с измеряемым сопротивлением, а в качестве R3 берутся магазин сопротивлений и реохорд. Если известны сопротивления R1, R2, и R3, то можно определить и исследуемое сопротивление Rx.
Оснащение рабочего места
Кондуктометр Мерные цилиндры
Ячейка для измерения Колбы или стаканы на 50 мл
электропроводимости Бюретка на 50 мл
Раствор хлорида калия 0,02 М Термометр
Растворы слабых электролитов
Проведение опыта
1. Проверить оснащение рабочего места. Измерить и записать температуру, при которой проводится опыт.
2. Приготовить методом разбавления вдвое растворы слабого электролита (по указанию преподавателя). Для этого, например, отмерить в 4 колбы (пронумерованные от № 1 до № 4) по 30 мл дистиллированной воды. Добавить в 4-ю колбу 30 мл исходного раствора электролита. После тщательного перемешивания перенести последовательно по 30 мл раствора из 4-й колбы в 3-ю, из 3-й - во 2-ю, из 2-й - в 1-ю. В колбу № 5 отмерить 30 мл исходного раствора электролита.
3. Подготовить к работе кондуктометр, для чего не менее 3 раз промыть дистиллированной водой ячейку кондуктометра; подключить её к клеммам «датчик»; установить ручку «термокомпенсация» в положение, соответствующее температуре опыта; включить прибор в сеть в соответствии с описанием и инструкцией.
4. Для определения константы ячейки Кя поместить в ячейку эталонный 0,02 М раствор хлорида калия и измерить его сопротивление RKCl.

|
Из за большого объема этот материал размещен на нескольких страницах:
1 2 3 4 5 6 7 8 9 10 |






 T, oC T, oC
T, oC T, oC